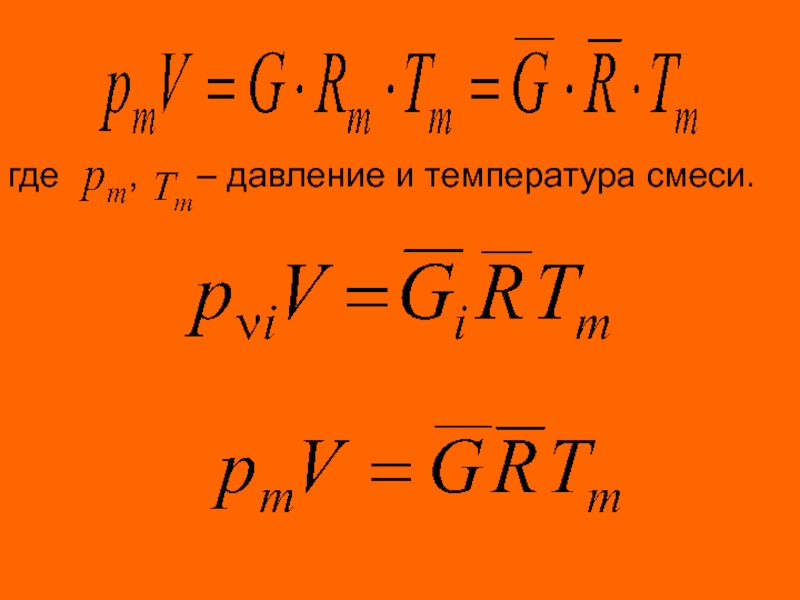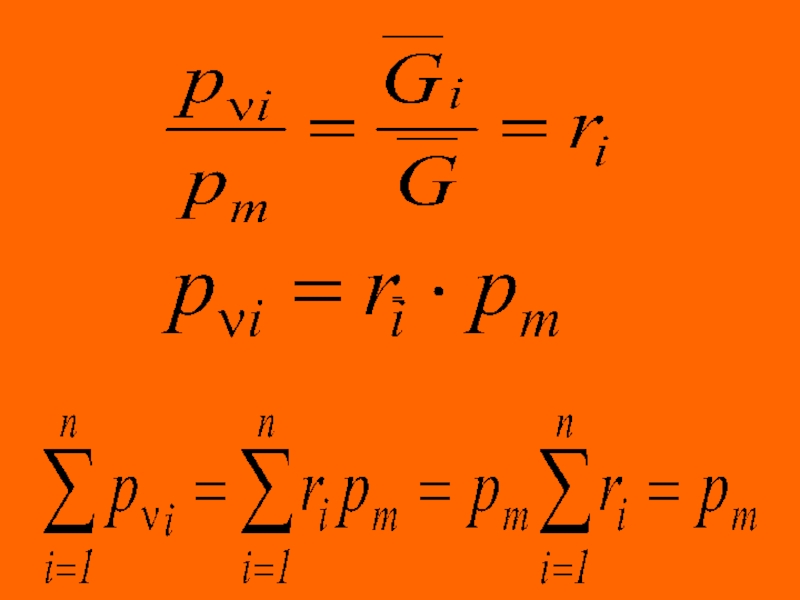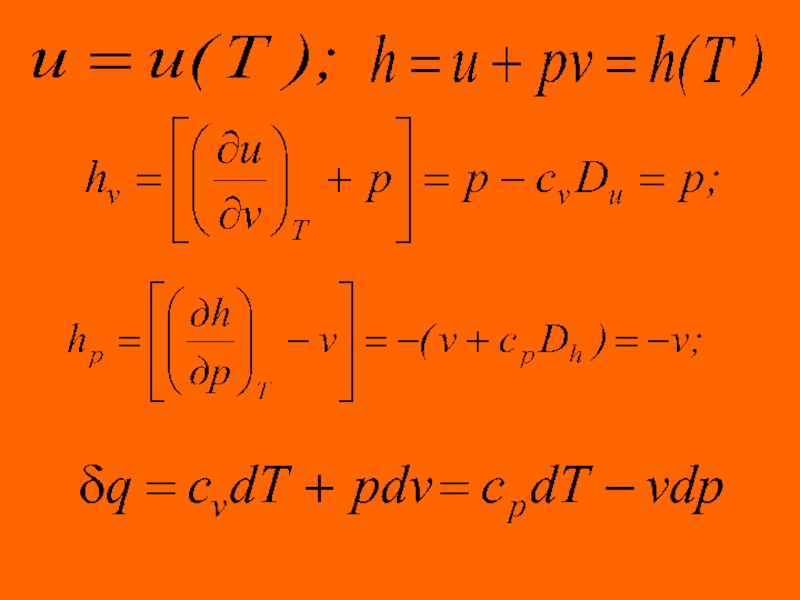- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
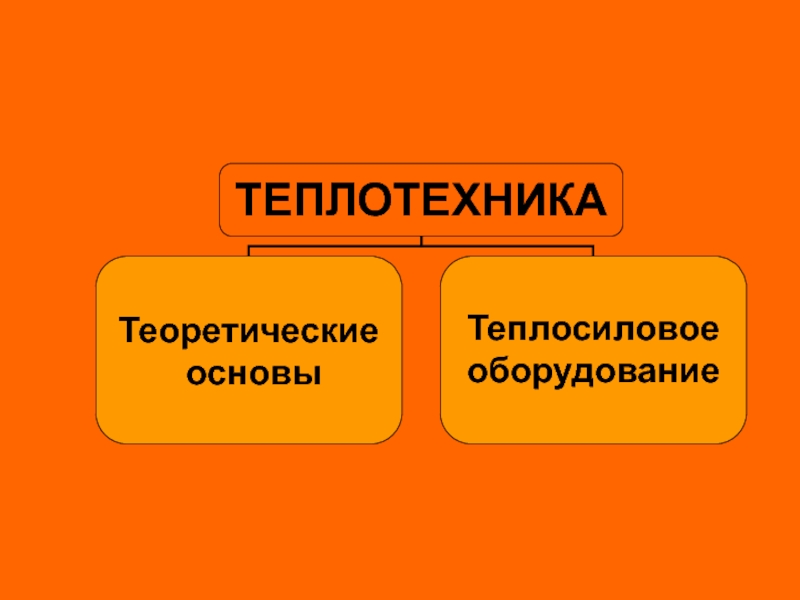
Теплотехника. Теоретические основы. Теплосиловое оборудование презентация
Содержание
- 1. Теплотехника. Теоретические основы. Теплосиловое оборудование
- 2. Правила рейтинга по курсу термодинамика ника
- 3. Семестровый рейтинговый балл складывается из выполнения
- 4. Индивидуальное задание состоит из двух домашних
- 5. К экзамену допускаются студенты получившие зачет
- 9. Основные определения и понятия Термодинамическая
- 10. Термодинамической системой принято называть закрытую
- 11. Идеальным газом называется система,
- 12. Термодинамические процессы Изменение состояния системы
- 13. Термодинамическая работа В простейшем случае
- 14. Термодинамическая работа обратимого изменения объема
- 15. Поскольку термодинамическая работа зависит от пути
- 16. Потенциальная (техническая) работа Потенциальной (технической) работой называется
- 17. Потенциальная работа обратимого изменения давления
- 18. Для определения интегральных значений полной
- 19. Необратимые потери термодинамической (
- 20. В условиях механических процессов (dEcz=G⋅c⋅dc+G⋅g⋅dz) уравнение
- 21. Внутренняя энергия тела Внутренняя энергия представляет
- 22. Теплота Теплота - количество энергии, передаваемой
- 23. Теплоемкость Истиной теплоемкостью называется
- 24. Связь между массовой, молярной и
- 25. Теплоемкость реального газа зависит от температуры
- 26. Для некоторых
- 27. Различают три агрегатных состояния простых систем:
- 28. Диаграмма фазовых состояний чистого вещества
- 29. Критические параметры являются важнейшими термодинамическими постоянными
- 30. Поэтому в принципе, для простых тел
- 31. где R –
- 32. Для обобщения данных по коэффициентам
- 33. Степень удаления от критической точки
- 34. Зависимость коэффициента сжимаемости углеводородных газов
- 35. Смеси жидкостей, паров и газов Смесью называется
- 36. Молярной концентрацией или молярной
- 37. Средняя (кажущаяся) молярная масса смеси равна
- 38. Зависимость между массовой и молярной концентрациями
- 39. Схемы смешения при постоянном объеме (а) и при постоянном давлении (б)
- 40. где
- 42. где
- 43. Смеси реальных газов
- 44. Первое начало термодинамики Первое начало термодинамики
- 45. Первое начало термодинамики как математическое выражение
- 46. Таким образом изменение внутренней энергии системы
- 49. Первое начало термодинамики для простых тел
- 50. Выражение удельной потенциальной работы можно представить
- 51. Первое начало термодинамики для 1 кг
- 52. Аналитическое выражение первого начала термодинамики Значения удельных
- 53. Подставляя выражения
- 54. Данное соотношение называется первым началом термодинамики
- 55. –
- 56. Калорические коэффициенты по физическому смыслу являются
- 58. С другой стороны из выражения первого начала
- 59. Из уравнения первого начала термодинамики для
- 60. Уравнение может быть записано и для
- 61. С учетом того, что для идеального
- 62. Правая часть уравнения представляет собой сумму
- 63. После интегрирования уравнения получим, что
Слайд 1Шотиди Константин Харлампиевич
Литература:
1.Теоретические основы теплотехники:
часть первая «Техническая термодинамика,
Часть вторая «Теплопередача»,
Авторы: Поршаков
2. Термодинамика и теплопередача.
Авторы: Поршаков Б.П. и др.
Слайд 2Правила рейтинга по курсу
термодинамика ника и теплопередачадля
Максимальное количество рейтинговых баллов
В зачетную книжку и в ведомость проставляется итоговая оценка, определяемая по итоговому баллу по схеме: [50-69 – «удовл.», [70-85] – «хорошо», [85-100] – «отлично».
Слайд 3
Семестровый рейтинговый балл складывается из выполнения и защиты лабораторных работ (до
Лабораторный практикум состоит из пяти лабораторных работ оцениваемых максимальными баллами до 6. В случае пропуска по уважительной причине лабораторная работа может быть выполнена в течении двух недель на консультации.
Контрольная работа по термодинамики состоит из теоретического теста (пять вопросов) и двух задач. Максимальное количество баллов за контрольную работу до 10. Контрольная работа по теплопередаче состоит из теоретического теста (пять вопросов)-до 5 баллов.
Слайд 4
Индивидуальное задание состоит из двух домашних заданий и оценивается первая максимум
Премиальные баллы за работу вне программы начисляются:
За выступление на конференции СНО с докладом по термодинамике.
Для получения зачета надо набрать семестровый рейтинг не меньше 30 баллов, при условии выполнения всех лабораторных работ (минимальное количество баллов 20). Студенты, не набравшие 30 баллов, могут довести свой балл до 30 в течение последней недели семестра.
Слайд 5
К экзамену допускаются студенты получившие зачет по теплотехнике и включенные деканатом
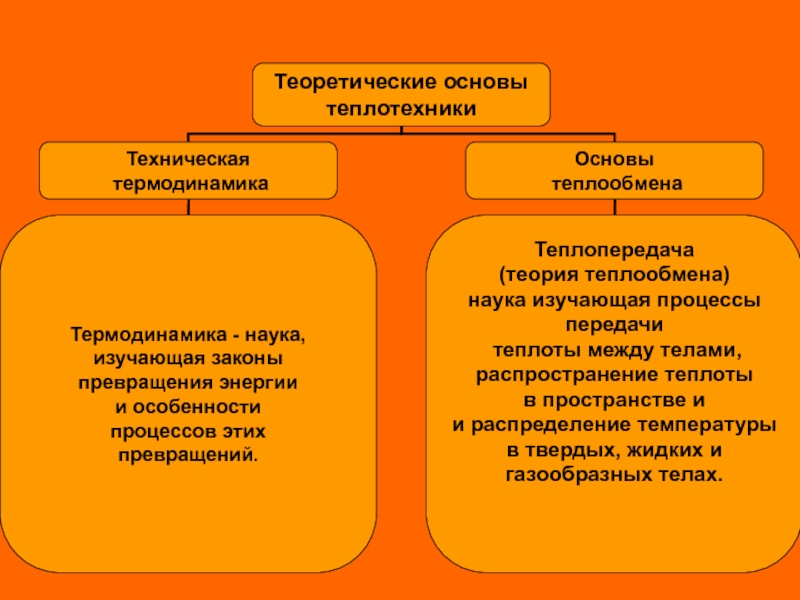
Слайд 9 Основные определения и понятия
Термодинамическая система
Под понятием
Система называется закрытой, если она сохраняет постоянное количество вещества при всех происходящих в ней изменениях; если нет, то систему принято называть открытой.
Если между системой и окружающей ее средой нет каких-либо энергетических взаимодействий (обмен работой и теплотой), то такую систему принято называть изолированной системой.
Если отсутствует теплообмен систему называют адиабатический изолированной.
.
Слайд 10
Термодинамической системой принято называть закрытую систему, внутреннее состояние которой определяется значениями
Равновесным состоянием системы называется такое тепловое, химическое, механическое состояние системы, которое может существовать сколь угодно долго при отсутствии внешнего воздействия.
Простейшей термодинамической системой или простым телом называется система, физическое состояние которой вполне определяется значениями двух независимых переменных.
Слайд 11
Идеальным газом называется система, физическое состояние которой вполне определяется значением
Параметры состояния - физические величины, характеризующие внутреннее состояние термодина-мической системы.
К простейшим термодинамическим параметрам состояния относятся: удельный объем (v), давление (p) и температура (T).
Связь между параметрами, характеризующими состояние простого тела, называется уравнением состояния F (р, v, T) = 0.
Слайд 12
Термодинамические процессы
Изменение состояния системы называется
процессом.
Равновесный процесс - это непрерывная последо-вательность
Обратимым процессом называется такой равно-весный процесс, который допускает возможность возврата этой системы из конечного состояния в исходное путем обратного процесса. В результате прямого и обратного обратимых процессов в системе и во внешней среде не происходит каких либо остаточных конечных изменений.
Термодинамическим процессом принято считать обратимый равновесный процесс.
Слайд 13
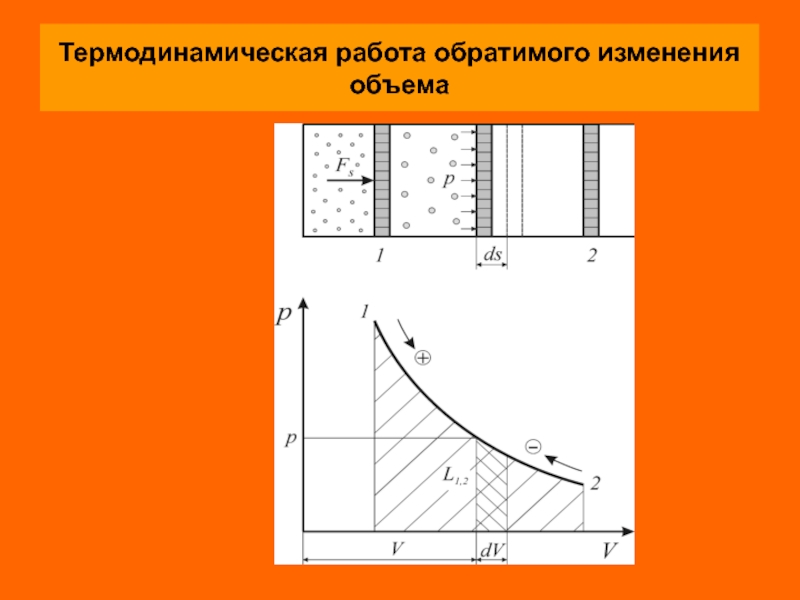
Термодинамическая работа
В простейшем случае элементарная термодинамическая работа L (Дж) простых
Удельная элементарная термодинамическая работа обратимого изменения объема (Дж/кг) определяется соотношением
Слайд 15
Поскольку термодинамическая работа зависит от пути (вида) процесса, для вычисления интегральных
Как следует из рисунка термодинамическая работа определяется площадью под кривой процесса независимо от вида рабочего тела и его свойств.
В силу этого координаты р–V и р–v называются универсальными координатами работы.
Работа расширения считается положительной
( , ), а работа сжатия – отрицательной
( ).
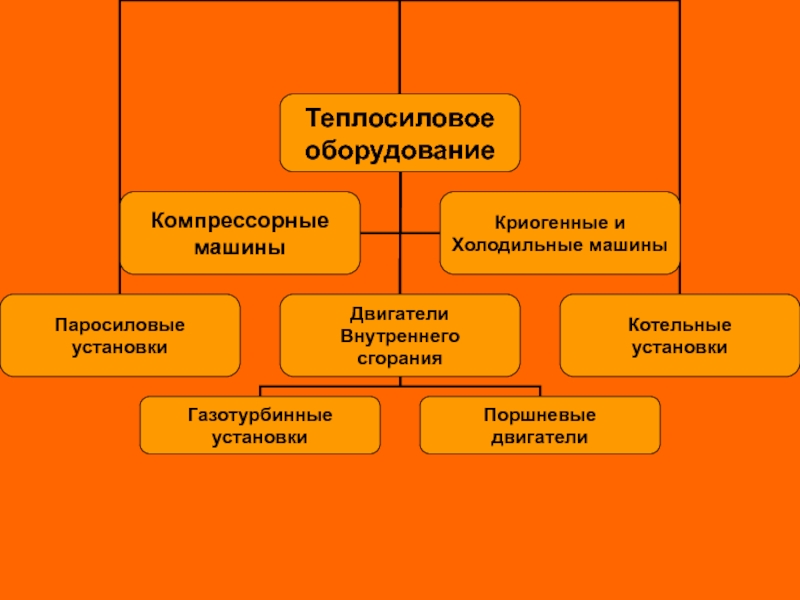
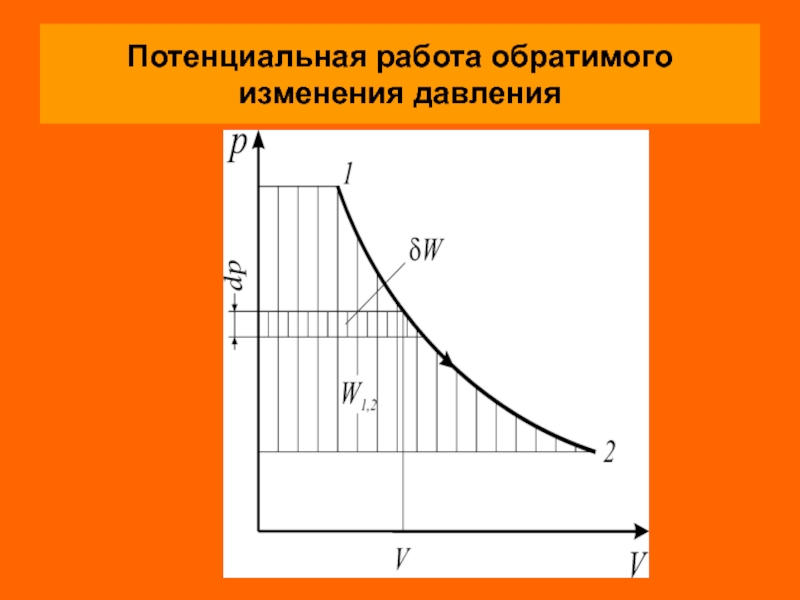
Слайд 16Потенциальная (техническая) работа
Потенциальной (технической) работой называется работа по перемещению сплошных масс
Элементарная потенциальная работа простого тела определяется из соотношения
Удельная потенциальная работа в элементарном процессе определяется по формуле
Слайд 18
Для определения интегральных значений полной
( ) или
Как и в случае термодинамической работы, потен-циальная работа определяется в кооординатах р–V площадью между кривой процесса и осью абсцисс независимо от вида рабочего тела и его свойств.
Термодинамическая и потенциальная работы в обратимом процессе есть сумма эффективной работы и необратимых потерь работы
Слайд 19
Необратимые потери термодинамической ( ) и
Эффективная термодинамическая работа ( ) простого тела в замкнутом пространстве и эффектив-ная потенциальная работа ( ) потока непосредст-венно передаются внешней системе ( ) и ( или ) используются для изменения энергии внешнего положения тела (dEcz).
= + dEcz; = + dEcz
Слайд 20
В условиях механических процессов (dEcz=G⋅c⋅dc+G⋅g⋅dz) уравнение распределения термодинамической и потенциальной работ
Слайд 21
Внутренняя энергия тела
Внутренняя энергия представляет собой полный запас энергии тела и
Внутренняя энергия U является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в Джоулях (Дж), а удельная внутренняя энергия (u) - в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р,T; р,v или T,v).
Слайд 22
Теплота
Теплота - количество энергии, передаваемой от одного тела к другому посредством
Количество теплоты , получаемое телом в результате теплообмена, зависит от вида термо-динамического процесса и аналогично работе является функцией процесса. Поэтому, элементар-ное количество теплоты не является полным дифференциалом ( ). Количество теплоты
измеряется в Джоулях (Дж), а удельное количество
теплоты = / в Дж/кг.
Слайд 23
Теплоемкость
Истиной теплоемкостью называется количество теплоты, которое надо сообщить единице количества
Различают массовую теплоемкость с, измеряемую в Дж/(кг⋅К), молярную – Дж/(кмоль⋅К) и объемную с' – Дж/(м3⋅К).
Слайд 24
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
Экспериментальное
Слайд 25
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из выражения истинной теплоемкости следует, что количество теплоты, подведенной к телу (или отведен-ной от него) в изобарном или изохорном процессе 1-2, определяется соотношением
Отсюда следует выражение средней теплоемкости газа
Слайд 26
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по
тогда
сzm- первая средняя теплоемкость. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
Слайд 27
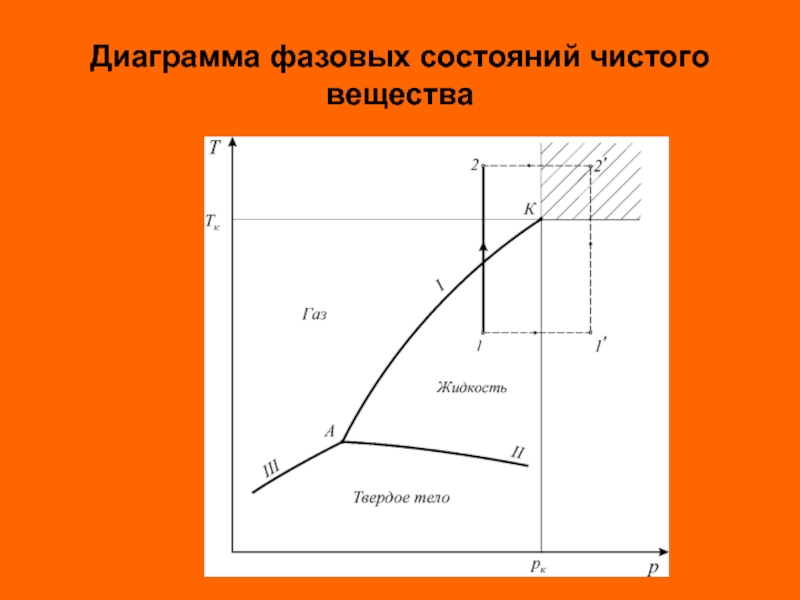
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
Линии
Энергетической границей между жидкостью и паром является теплота испарения, а между твердым телом и жидкостью – теплота плавления. Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода обозначается символом r.
Слайд 29
Критические параметры являются важнейшими термодинамическими постоянными вещества. Критическая температура – это
В закритической области ( ) вещество может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии
Слайд 30
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое
Уравнение состояния идеальных газов - уравнение Клапейрона:
для 1 кг газа
для G кг газа
для 1 кмоля газа
для кмолей газа
Слайд 31
где R – характеристическая постоянная газа; Т –
( Дж/кмоль К ) – универсальная газовая постоянная, не зависящей от природы газов.
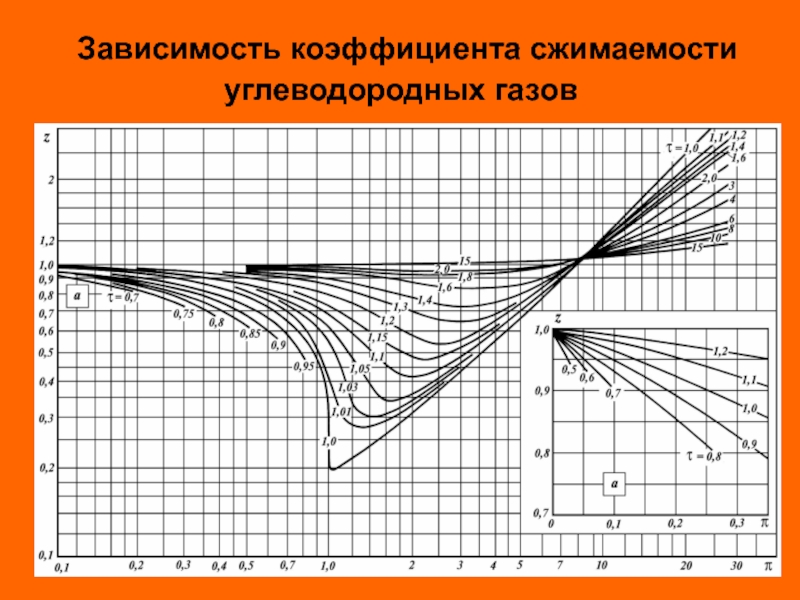
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в него поправочного коэффициента (z), называемого коэффициентом сжимаемости
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеаль-ного газа z = 1).
Слайд 32
Для обобщения данных по коэффициентам сжимаемости различных газов был использован прин-цип
В критической точке для всех веществ r = 0,
, , .
Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.
Слайд 33
Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления
приведенной температуры
приведенного объема
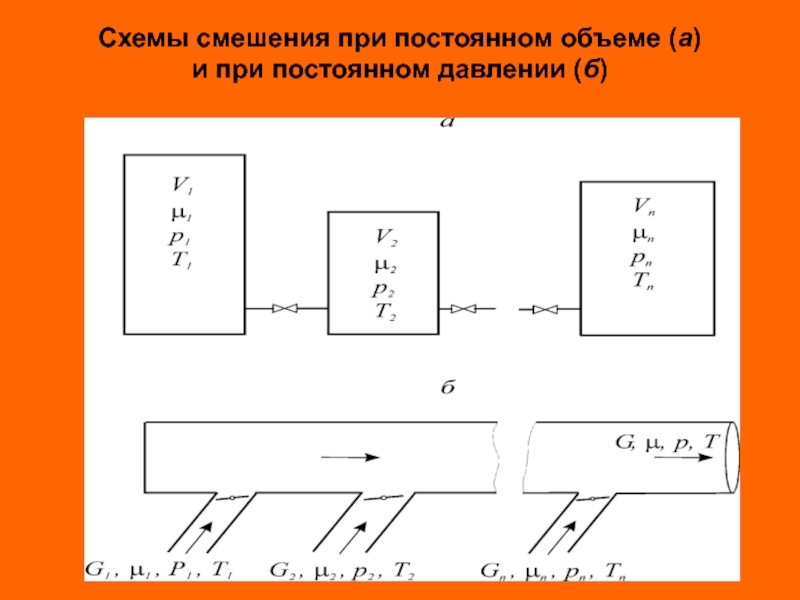
Слайд 35Смеси жидкостей, паров и газов
Смесью называется термодинамическая система состоящая из n-компонентов
Массовой концентрацией или массовой долей mi называется отношение массы компонента к массе всей смеси
Слайд 36
Молярной концентрацией или молярной долей i-го компонента называется отношение
Слайд 37
Средняя (кажущаяся) молярная масса смеси равна отношению массы смеси к количеству
= = = =
= = = = =
Слайд 38
Зависимость между массовой и молярной концентрациями устанавливается соотношением
Газовая постоянная смеси может
= =
Слайд 42
где массовая и молярная концентрации
Слайд 43Смеси реальных газов
pк,i и Тк,i − критические давление и температура компонентов газовой смеси.
Слайд 44Первое начало термодинамики
Первое начало термодинамики – это количественное выражение закона
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Это утверждение и принимается в качестве пастулата первого начала термодинамики
Слайд 45
Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии
Рассмотрим
В этом случае в соответствии с пастулатом первого начала термодинамики имеем duиз=0.
Рассмотрим систему к которой извне подводится или отводится теплота и подводится или отводится термодинамическая работа
Слайд 46
Таким образом изменение внутренней энергии системы равно алгебраической сумме подведенных извне
в интегральной форме
или
Слайд 47
-
- внешний теплообмен
Полученные уравнения учитывают только внешние эффекты и справедливы только для обратимых процессов.
Уравнения являются математическим выраже- нием первого начала термодинамики по внешнему балансу теплоты и работы и гласят: количество теплоты подведенное извне идет на изменение внутренней энергии системы и совершение работы.
Принимая во внимание, что эффективная работа связана с термодинамической работой соотношение
и
Слайд 48
уравнения первого начала термодинамики по балансу рабочего тела, и справедливы для реальных процессов . В обратимых процессах
и уравнения первого начала термодинамики по внешнему балансу и балансу рабочего тела совпадают
имеем
Слайд 49Первое начало термодинамики для
простых тел
Для простых тел, то есть
и математическое выражение первого начала термодинамики в дифференциальной форме примет следующий вид:
для термодинамической системы
для 1 кг системы
Слайд 50
Выражение удельной потенциальной работы можно представить в виде соотношения
из которого следует,
;
и
,
Сумма удельной внутренней энергии ( ) и потенциальной функции ( ) называется удельной энтальпией ( ) (Дж/кг).
Слайд 51
Первое начало термодинамики для 1 кг простого тела по балансу рабочего
Первое начало термодинамики по внешнему балансу
Слайд 52Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого
Изменения внутренней энергии и энтальпии простого тела, как функций состояния, в элементарных процессах являются полными дифференциалами и определяются соотношениями
Слайд 53
Подставляя выражения полных дифференциалов внутренней энергии и энтальпии в уравнение первого
имеем
Слайд 54
Данное соотношение называется первым началом термодинамики для простых тел в аналитической
Выражения в квадратных скобках в литературе часто называют калорическими коэффициентами, которые могут быть определены по формулам, полученным с использованием дифференциальных соотношений термодинамики,
Слайд 55
– коэффициент Джоуля – Гей Люссака,
Коэффициенты Джоуля – Гей Люссака ( ) и Джоуля-Томсона ( ) реальных газов определяются по таблицам термодинамических свойств.
Слайд 56
Калорические коэффициенты по физическому смыслу являются аналогами теплоемкостей в изотермическом процессе.
Данную
Первое начало термодинамики для идеальных газов. Закон Майера. Энтропия идеального газа
Идеальные газы подчиняются уравнению состояния Клапейрона и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
Слайд 58 С другой стороны из выражения первого начала термодинамики для простого тела
С
имеем
Слайд 59
Из уравнения первого начала термодинамики для идеального газа
из которого следует,
Это выражение впервые было получено
Р. Майером (1842 г.) и называется законом Майера.
Слайд 60
Уравнение может быть записано и для одного кмоля газа
Разделив уравнение первого
Слайд 61
С учетом того, что для идеального газа, исходя уравнения Клапейрона, справедливы
получим
Слайд 62
Правая часть уравнения представляет собой сумму полных дифференциалов. Это значит, что
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением .
Полученное выражение называется принципом существования энтропии идеального газа
Слайд 63
После интегрирования уравнения получим, что изменение удельной энтропии идеального газа в