- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теоретические основы хроматографии презентация
Содержание
- 1. Теоретические основы хроматографии
- 2. План Способы получения хроматограмм Основные понятия хроматографии
- 3. Способы получения хроматограмм: элюентная вытеснительная фронтальная
- 4. Время удерживания (элюирования) tR. t1 –
- 5. Время выхода t0 несорбируемого компонента
- 6. Исправленное время удерживания tR' tR' = tR - t0
- 7. Удерживаемый объем VR - объем
- 8. Исправленный удерживаемый объем VR' = VR - V0
- 9. Коэффициент удерживания (замедления)
- 10. Коэффициент емкости k = tR′ / t0
- 11. Число теоретических тарелок рассчитывают непосредственно из хроматограммы,
- 12. Если длина хроматографической колонки составляет L, а
- 13. Кинетическая теория хроматографии, предложена датскими химиками Ван-Деемтером
- 14. Вихревая диффузия А зависит от структуры сорбента
- 16. Коэффициент селективности является мерой относительного удерживания или
- 17. Разделение двух соседних пиков характеризуется разрешением пиков RS (степенью разделения), которое описывается уравнением
- 18. Коэффициент селективности α и разрешение пиков RS связаны соотношением
Слайд 2План
Способы получения хроматограмм
Основные понятия хроматографии
Теория хроматографического разделения
Теория теоретических тарелок
Кинетическая теория хроматографии
Параметры
разделения
Газовая хроматография
Газотвердофазная (газоадсорбционная) хроматография
Газожидкостная хроматография
Жидкостная хроматография
Газовая хроматография
Газотвердофазная (газоадсорбционная) хроматография
Газожидкостная хроматография
Жидкостная хроматография
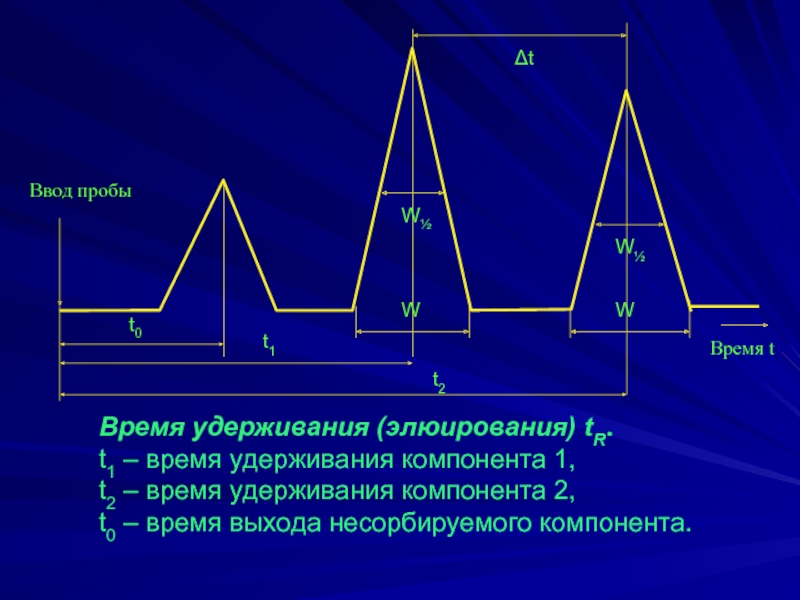
Слайд 4Время удерживания (элюирования) tR.
t1 – время удерживания компонента 1,
t2
– время удерживания компонента 2,
t0 – время выхода несорбируемого компонента.
t0 – время выхода несорбируемого компонента.
t0
t1
t2
Δt
W½
W
W½
W
Время t
Ввод пробы
Слайд 5 Время выхода t0 несорбируемого компонента
t0 = L/ υ ,
где
L - длина хроматографической колонки,
υ - скорость потока.
υ - скорость потока.
Слайд 7
Удерживаемый объем VR - объем ПФ, который нужно пропустить через колонку
с определенной скоростью, чтобы элюировать вещество:
VR = tR ∙ υ
VR = tR ∙ υ
Слайд 11Число теоретических тарелок рассчитывают непосредственно из хроматограммы, сравнивая ширину пика w
и время пребывания tR компонента в колонке:
N=16
N=16
Или
где w1/2 - полуширина пика, выраженная в тех же единицах, что и tR.
Слайд 12Если длина хроматографической колонки составляет L, а число теоретических тарелок равно
N, то величина Н (ВЭТТ):
Н = L/ N
Эффективность колонки тем выше, чем меньше Н и больше N.
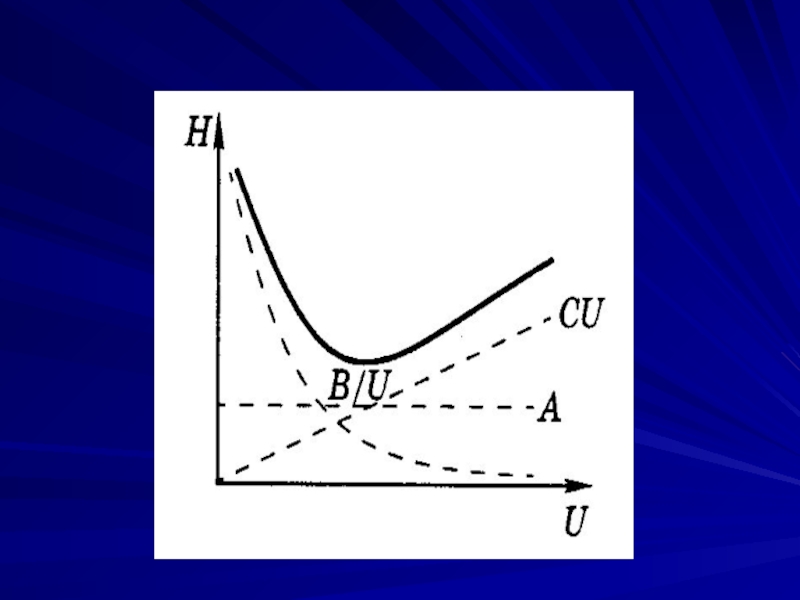
Слайд 13Кинетическая теория хроматографии, предложена датскими химиками Ван-Деемтером и Клинкенбергом Высота, эквивалентная теоретической
тарелке, связана со скоростью потока уравнению Ван-Деемтера:
Н = А + В/υ + Сυ,
где А, В/υ, Сυ – члены, учитывающие неравномерность движения потока ПФ (вихревая диффузия), молекулярную диффузию и отклонение от сорбционного равновесия (сопротивление массопереносу) соответственно;
υ – линейная скорость потока.
Слайд 14Вихревая диффузия А зависит от структуры сорбента и изменяется по длине
колонки.
Молекулярная (продольная) диффузия В/υ обусловлена миграцией молекул в ПФ из участков полосы с большей концентрацией в направлении, где концентрация меньше.
Сопротивление массопереносу Сυ характеризует кинетику процесса сорбция-десорбция, массопередачу и другие эффекты, т.е. скорость распределения вещества между двумя фазами.
Молекулярная (продольная) диффузия В/υ обусловлена миграцией молекул в ПФ из участков полосы с большей концентрацией в направлении, где концентрация меньше.
Сопротивление массопереносу Сυ характеризует кинетику процесса сорбция-десорбция, массопередачу и другие эффекты, т.е. скорость распределения вещества между двумя фазами.
Слайд 16 Коэффициент селективности является мерой относительного удерживания или относительной подвижности разделяемых веществ:
где
D – коэффициент распределения, равный отношению концентраций вещества в подвижной и неподвижной фазах соответственно.
Слайд 17 Разделение двух соседних пиков характеризуется разрешением пиков RS (степенью разделения), которое
описывается уравнением