- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Техническая термодинамика. Первый закон термодинамики. (Лекция 2) презентация
Содержание
- 1. Техническая термодинамика. Первый закон термодинамики. (Лекция 2)
- 2. Наряду с механической энергией любое тело (или
- 3. Внутренняя энергия идеального газа Внутренняя энергия U
- 4. В общем случае термодинамическая система может обладать
- 5. Первый закон термодинамики Количество теплоты, сообщаемой телу,
- 6. Термодинамические процессы
- 7. Теплоёмкость идеального газа Теплоёмкость тела характеризуется количеством
- 8. Теплоёмкость термодинамической системы зависит от
- 9. При нагревании одного моля идеального газа при
- 10. В случае идеального газа справедлива формула
- 11. При изобарическом процессе кроме увеличения внутренней энергии
- 12. Уравнение Майера Уравнение Майера для одного моля
- 14. Из уравнения Майера
- 15. Так как
- 16. Числом степени свободы называется число независимых переменных,
- 17. Молекулы многоатомных газов нельзя рассматривать как материальные
- 19. У двухатомных жестких молекул пять степеней свободы
- 20. Закон о равномерном распределении энергии по степеням
- 21. Теплоёмкости многоатомных газов В общем случае, для молярной массы газа Для произвольного количества газов:
- 22. Применение первого начала термодинамики к изопроцессам
- 23. Применение первого начала термодинамики к изопроцессам Рассмотрим
- 24. Применение первого начала термодинамики к изопроцессам С
- 25. Применение первого начала термодинамики к изопроцессам Изохорный
Слайд 2Наряду с механической энергией любое тело (или система) обладает внутренней энергией. Внутренняя
Внутренняя энергия. Работа и теплота
Слайд 3Внутренняя энергия идеального газа
Внутренняя энергия U одного моля идеального газа равна:
Таким
Слайд 4В общем случае термодинамическая система может обладать как внутренней, так и
Внутренняя энергия. Работа и теплота
Слайд 5Первый закон термодинамики
Количество теплоты, сообщаемой телу, идёт на увеличение внутренней энергии
– это и есть первый закон термодинамики или закон сохранения энергии в термодинамике.
В дифференциальном виде:
U – функция состояния системы; dU – её полный дифференциал, а δQ и δА таковыми не являются.
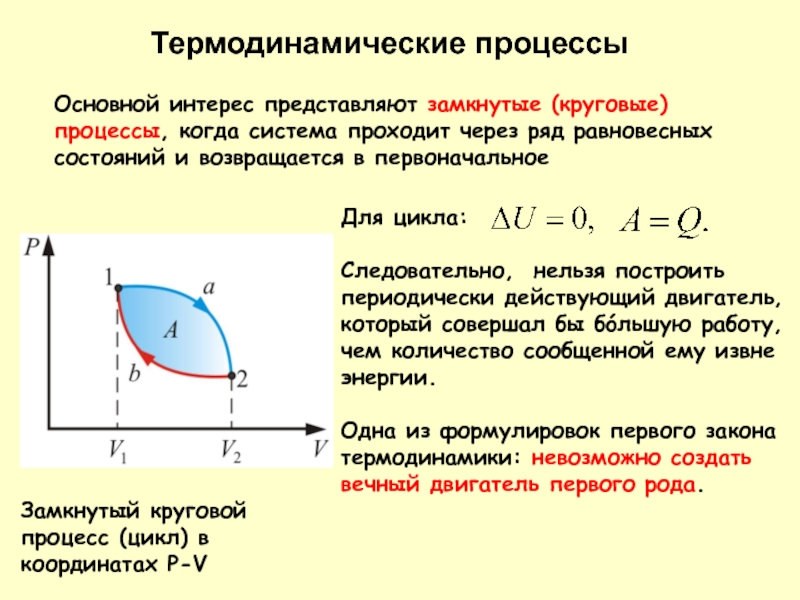
Слайд 6Термодинамические процессы
Замкнутый круговой процесс (цикл) в координатах P-V
Основной интерес представляют замкнутые
Для цикла:
Следовательно, нельзя построить периодически действующий двигатель, который совершал бы бóльшую работу, чем количество сообщенной ему извне энергии.
Одна из формулировок первого закона термодинамики: невозможно создать вечный двигатель первого рода.
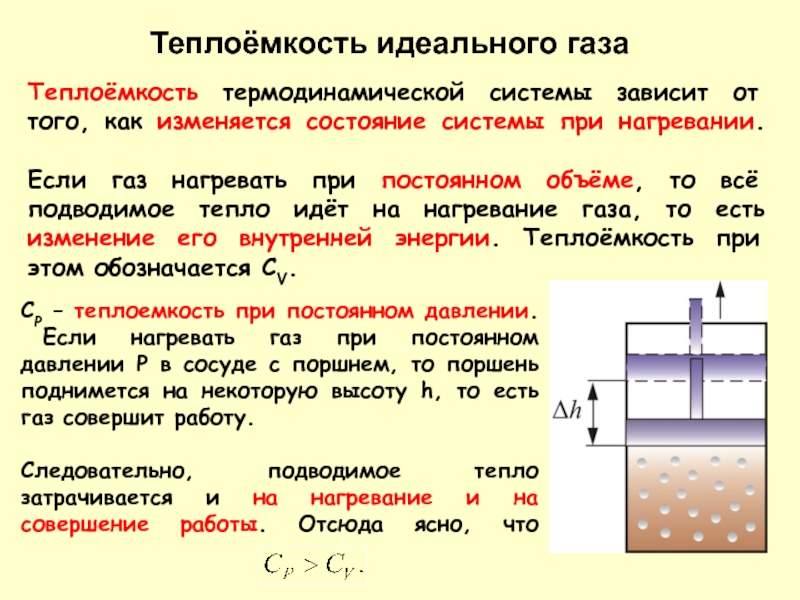
Слайд 7Теплоёмкость идеального газа
Теплоёмкость тела характеризуется количеством теплоты, необходимой для нагревания этого
Удельная теплоёмкость (Суд) – есть количество теплоты, необходимое для нагревания единицы массы вещества на 1 градус
Для газов удобно пользоваться молярной теплоемкостью Сμ - количество теплоты, необходимое для нагревания 1 моля газа на 1 градус.
Молярная масса – масса одного моля.
Моль – количество вещества, в котором содержится число молекул, равное числу атомов в 12 г изотопа углерода 12С.
Слайд 8
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при
Теплоёмкость идеального газа
СР – теплоемкость при постоянном давлении.
Если нагревать газ при постоянном давлении Р в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит работу.
Следовательно, подводимое тепло затрачивается и на нагревание и на совершение работы. Отсюда ясно, что
Слайд 9При нагревании одного моля идеального газа при постоянном объёме, первый закон
Теплоемкость при постоянном объёме будет равна:
В общем случае
Теплоёмкость идеального газа
Слайд 10В случае идеального газа справедлива формула
Из этого следует, что
Внутренняя
Для произвольной массы идеального газа:
Теплоёмкость идеального газа
Слайд 11При изобарическом процессе кроме увеличения внутренней энергии происходит совершение работы газом:
Из
Подставив полученный результат в уравнение, получим
Теплоёмкость идеального газа
Слайд 12Уравнение Майера
Уравнение Майера для одного моля газа.
Из него следует физический смысл
Слайд 13
Теплоемкость при постоянном объеме СV – величина постоянная, от температуры не
Внутренняя энергия одного моля идеального газа равна
Теплоёмкости одноатомных газов
Слайд 14Из уравнения Майера
Тогда, теплоемкость при постоянном давлении для одноатомных газов:
Теплоёмкости одноатомных
Полезно знать отношение:
где γ - коэффициент Пуассона
Слайд 15Так как
где i – число степеней свободы молекул.
Теплоёмкости одноатомных газов
Тогда
Из этого
Кроме того
Слайд 16Числом степени свободы называется число независимых переменных, определяющих положение тела в
Подставив в выражение для внутренней энергии, получим:
Так как
Теплоёмкости одноатомных газов
Внутреннюю энергию можно найти по формуле:
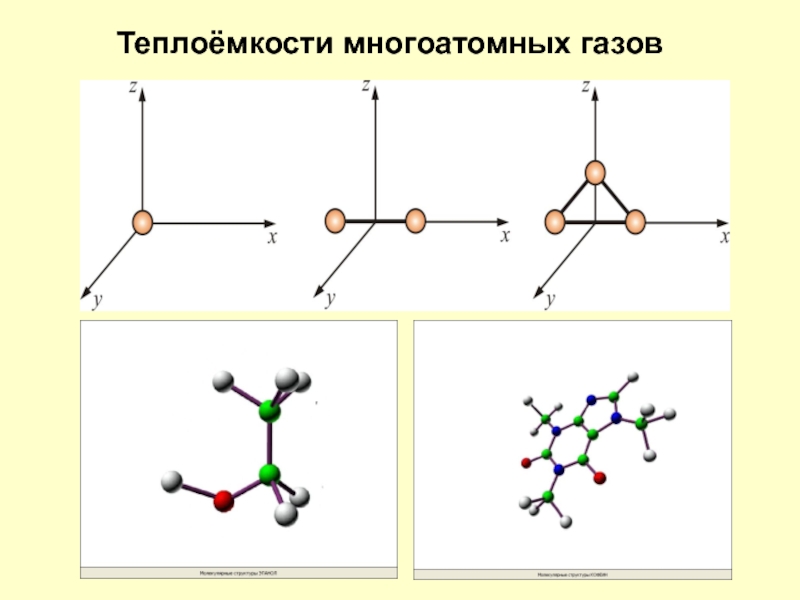
Слайд 17Молекулы многоатомных газов нельзя рассматривать как материальные точки. Необходимо учитывать вращательное
Число степеней свободы таких молекул
Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два независимых вращения. Любое вращение можно разложить на три вращательных движения вокруг взаимно перпендикулярных осей. Но для двухатомных молекул вращение вокруг оси z не изменит её положение в пространстве.
Теплоёмкости многоатомных газов
Слайд 19У двухатомных жестких молекул пять степеней свободы
(i = 5), а у
Если молекула не жесткая, то она обладает еще колебательными степенями свободы. На каждую колебательную степень свободы приходится энергия, равная kT.
1/2 kT приходится на кинетическую энергию и 1/2 kT на потенциальную .
Теплоёмкости многоатомных газов
Слайд 20Закон о равномерном распределении энергии по степеням свободы
Больцман доказал, что, средняя
Закон Больцмана о равномерном распределении средней кинетической энергии по степеням свободы.
На среднюю кинетическую энергию молекулы, имеющей i-степеней свободы приходится
Слайд 21Теплоёмкости многоатомных газов
В общем случае, для молярной массы газа
Для произвольного количества
Слайд 23Применение первого начала термодинамики к изопроцессам
Рассмотрим политропный процесс – такой процесс,
Уравнение политропы
n – показатель политропы.
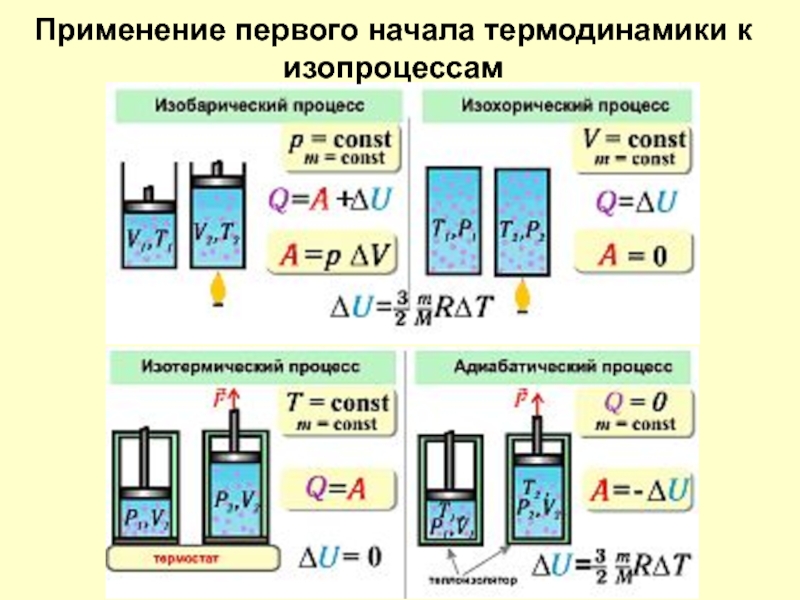
Слайд 24Применение первого начала термодинамики к изопроцессам
С помощью показателя n можно легко
Изобарный процесс Р = const, n = 0
Изотермический процесс Т = const, n = 1,
Слайд 25Применение первого начала термодинамики к изопроцессам
Изохорный процесс
Адиабатический процесс ΔQ = 0,
Во всех этих процессах работу можно вычислить по одной формуле: