Ст. преп. Пономарёв Д.Б.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение и структура материалов презентация
Содержание
- 1. Строение и структура материалов
- 2. 2.1. Виды химической связи При сближении атомов
- 3. Кривая изменения потенциальной энергии при взаимодействии двух
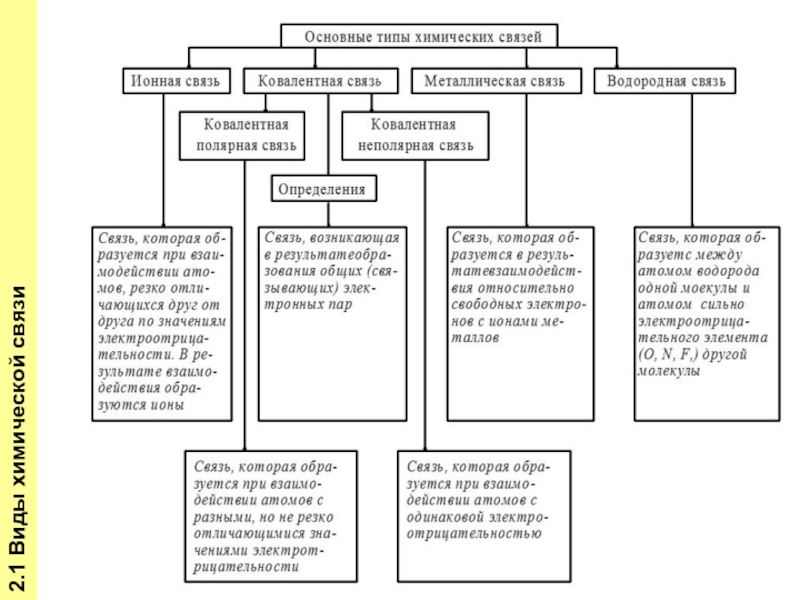
- 4. 2.1 Виды химической связи
- 5. 2.1 Виды химической связи
- 6. 2.1 Виды химической связи
- 7. 2.1 Виды химической связи
- 8. 2.1 Виды химической связи
- 9. 2.1 Виды химической связи
- 10. 2.1 Виды химической связи
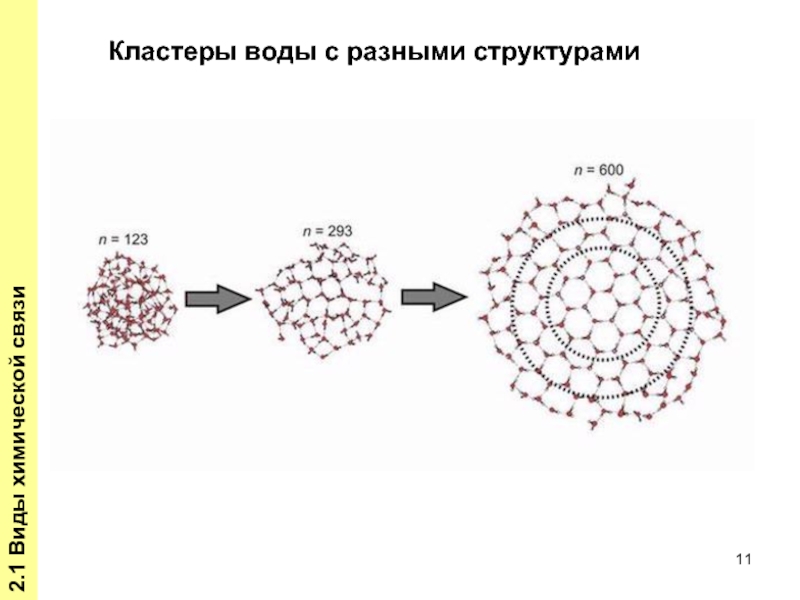
- 11. 2.1 Виды химической связи Кластеры воды с разными структурами
- 12. 2.1 Виды химической связи Парафины, компаунд Жидкие кристаллы
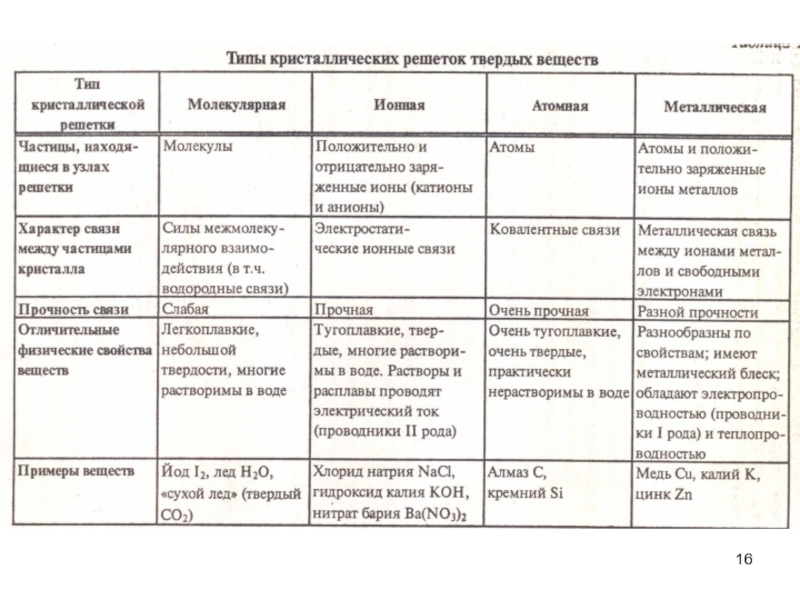
- 13. 2.1 Виды химической связи
- 14. Газообразное состояние молекул наиболее беспорядочное и структурно
- 15. Твердое состояние характеризуется тремя признаками: упругостью, кристаллической
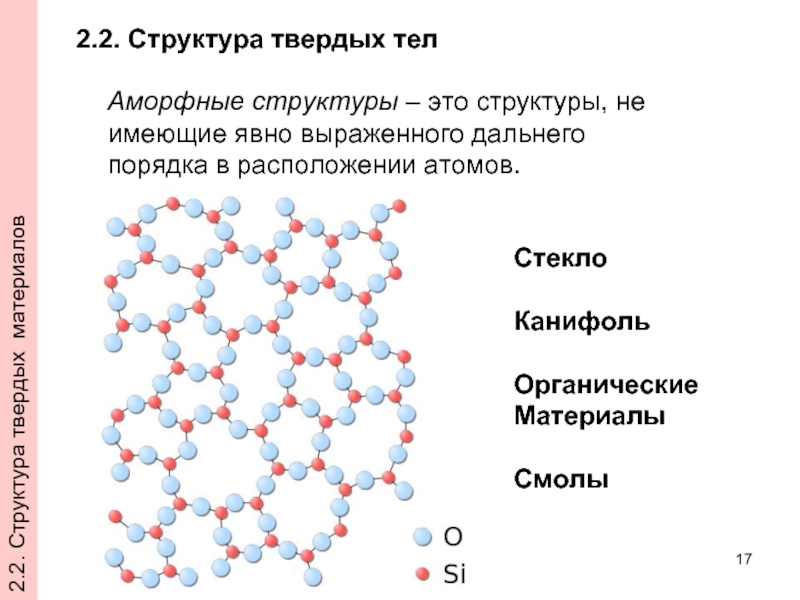
- 17. Аморфные структуры – это структуры, не имеющие
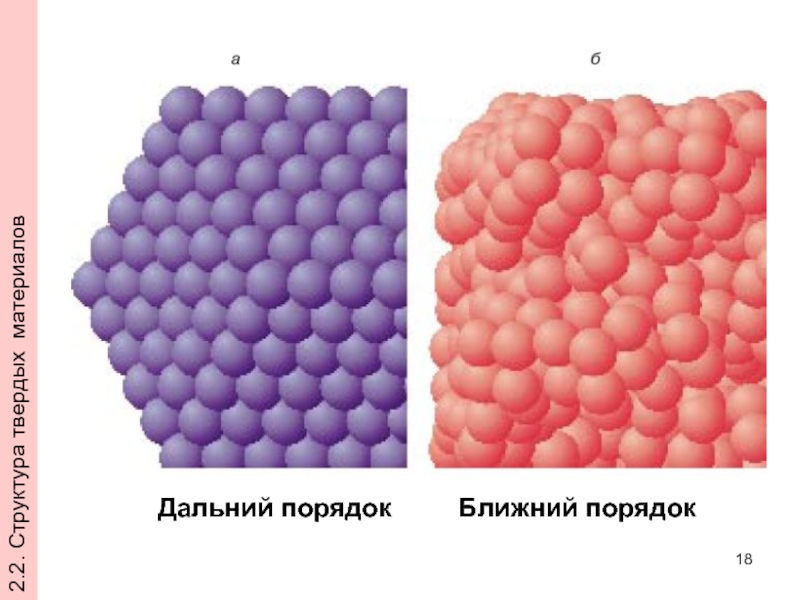
- 18. 2.2. Структура твердых материалов Дальний порядок Ближний порядок
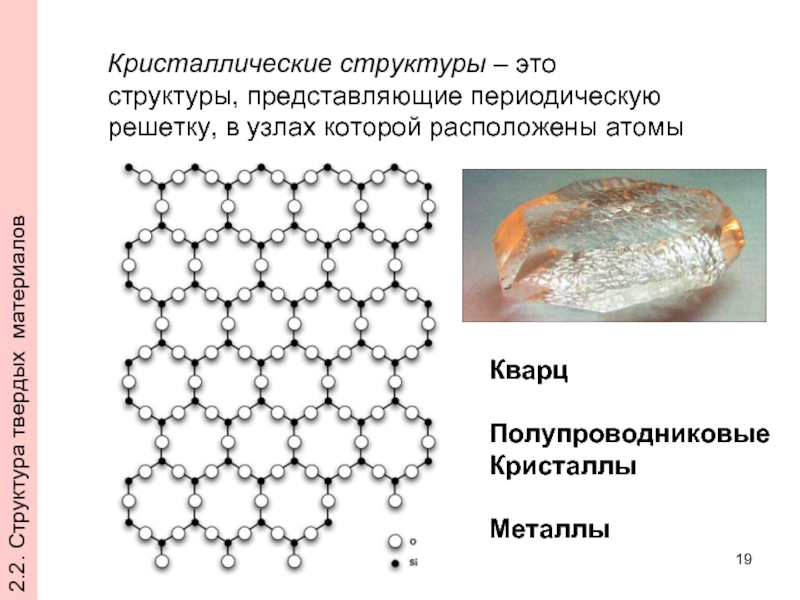
- 19. Кристаллические структуры – это структуры, представляющие периодическую
- 20. Монокристаллы – однородные анизотропные тела, которые характеризуются
- 21. Однако большинство кристаллических веществ являются поликристаллическими.
- 22. Физические свойства: 1)Правильная форма. 2)Постоянная
- 23. Если ориентацию кристаллитов упорядочить (мехобработкой металла, поляризацией
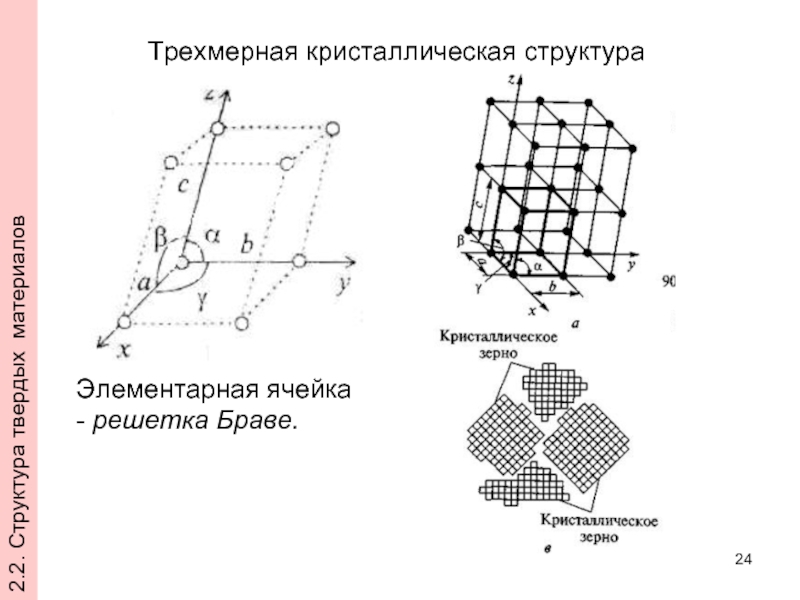
- 24. Трехмерная кристаллическая структура Элементарная ячейка
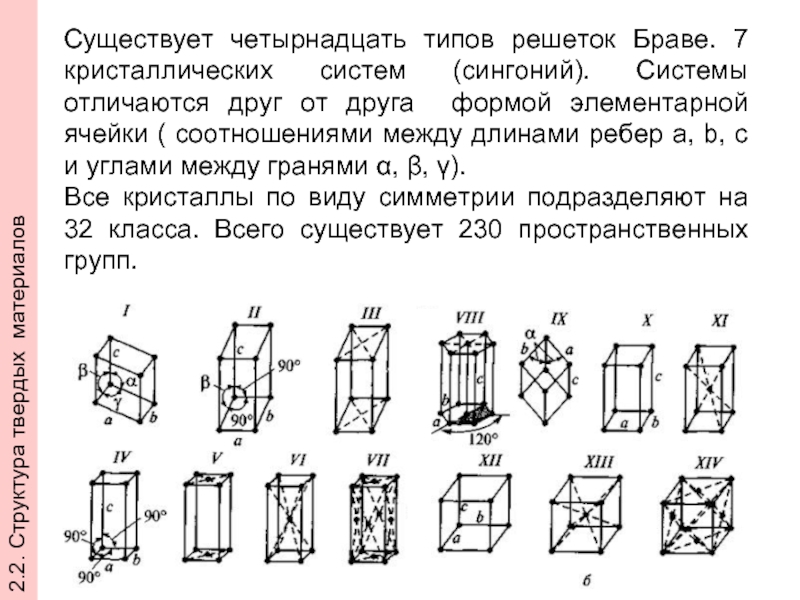
- 25. Существует четырнадцать типов решеток Браве. 7 кристаллических
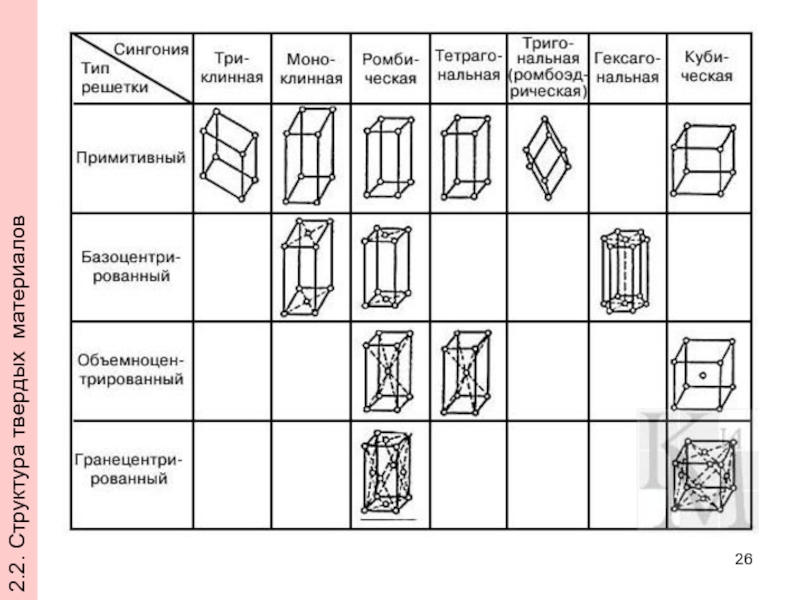
- 26. 2.2. Структура твердых материалов
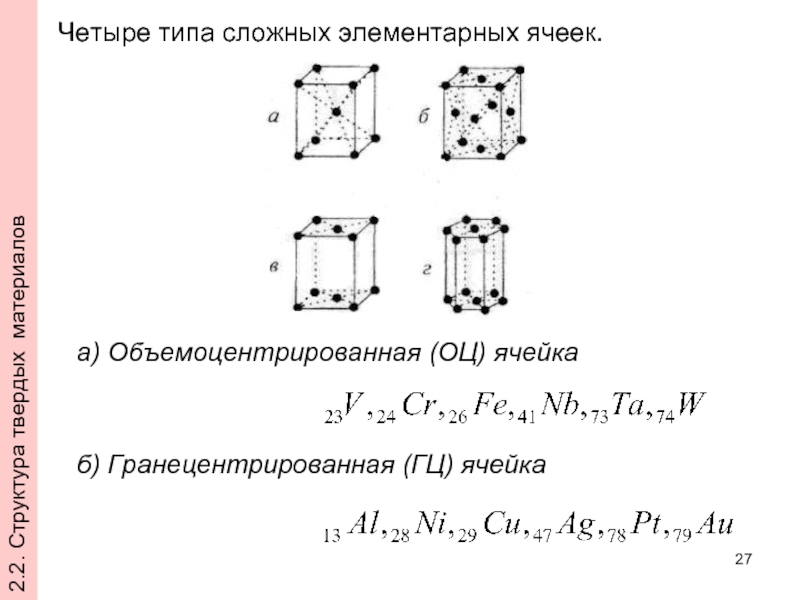
- 27. Четыре типа сложных элементарных ячеек. а) Объемоцентрированная
- 28. Четыре типа сложных элементарных ячеек. в) Базоцентрированная
- 29. Индексы Миллера.
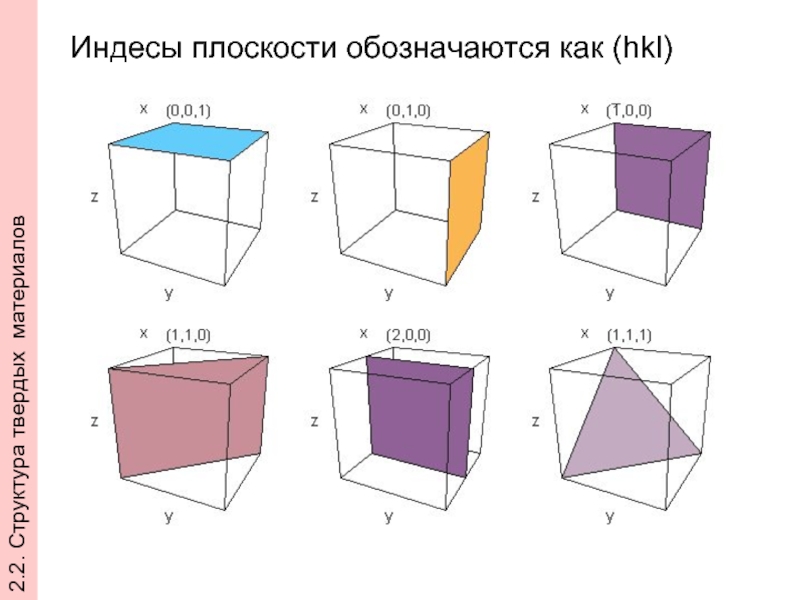
- 30. Индесы плоскости обозначаются как (hkl) 2.2. Структура твердых материалов
- 31. Полиморфизм (аллотропия) это способность образовывать не
- 32. 2.2. Структура твердых материалов α-Fe, β-Fe, γ-Fe Кривая охлаждения железа Fe
- 33. 2.2. Структура твердых материалов Полиморфизм углерода C Фуллерен Графит Алмаз
- 34. 2.2. Структура твердых материалов Полиморфизм углерода
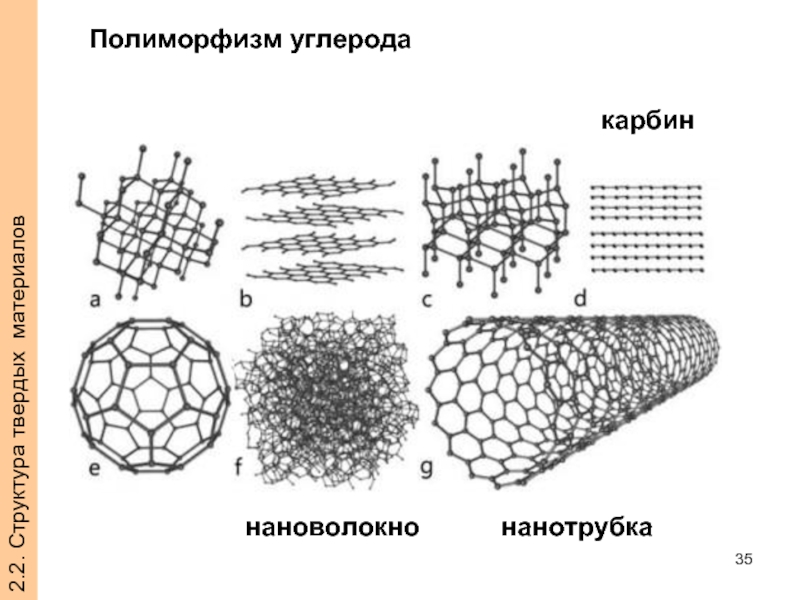
- 35. 2.2. Структура твердых материалов Полиморфизм углерода карбин нанотрубка нановолокно
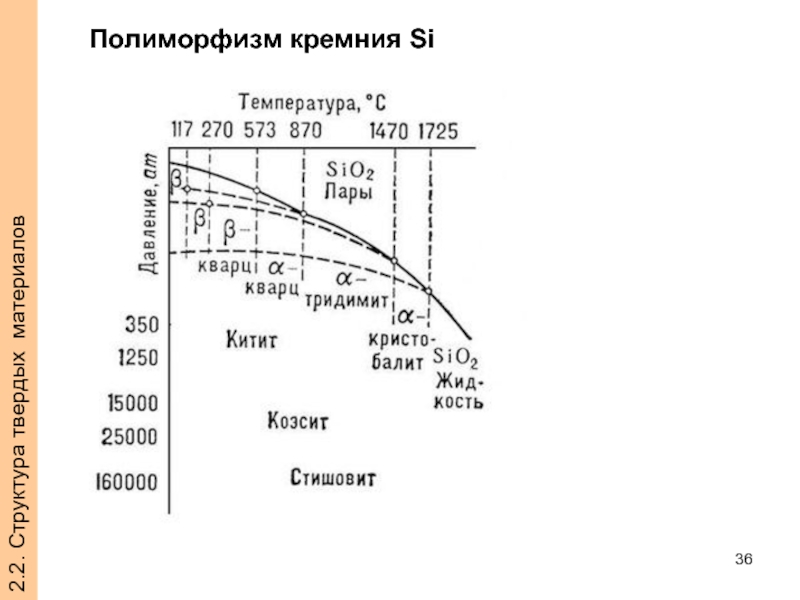
- 36. 2.2. Структура твердых материалов Полиморфизм кремния Si
- 37. 2.2. Структура твердых материалов Полиморфизм олова Sn T < 13,2 °C
- 38. 2.3. Структурные дефекты твердых тел. Дефекты
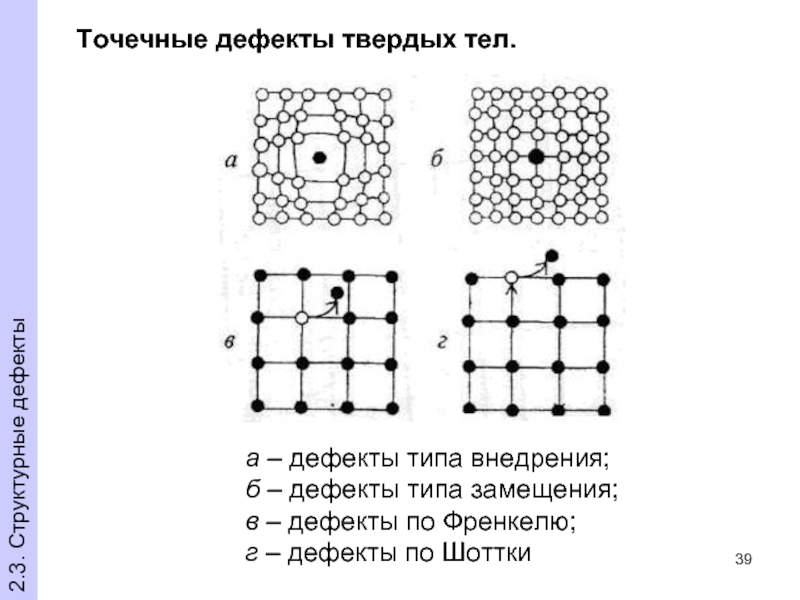
- 39. Точечные дефекты твердых тел. а –
- 40. Линейные дефекты твердых тел. Дислокация –
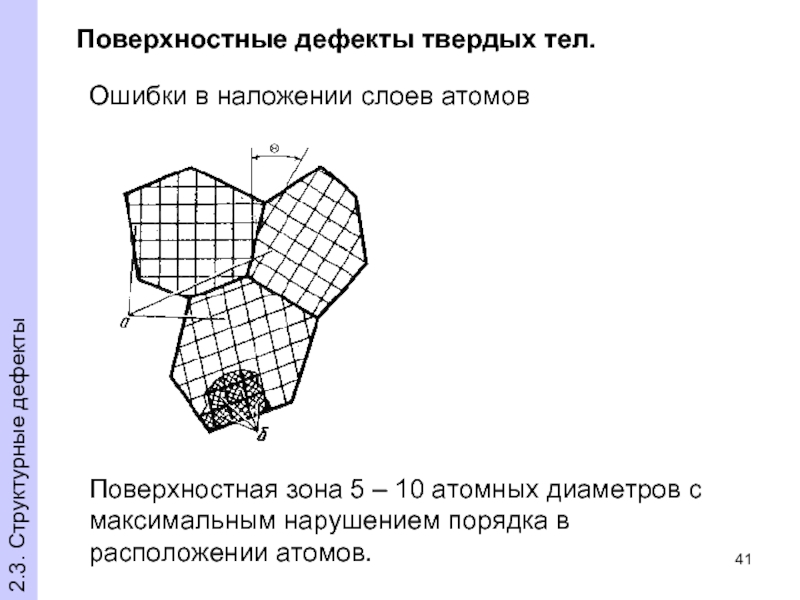
- 41. Поверхностные дефекты твердых тел. Поверхностная зона
- 42. Объемные дефекты твердых тел. Имеют в
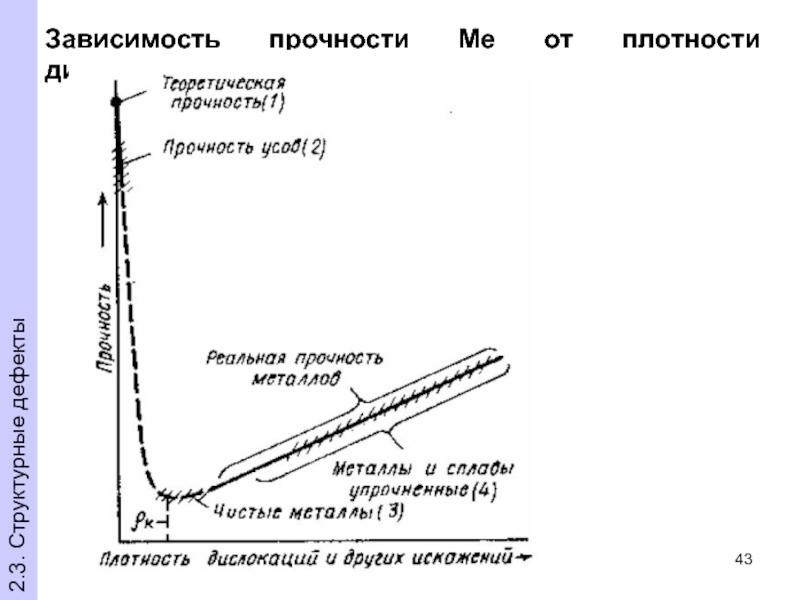
- 43. Зависимость прочности Ме от плотности дислокаций 2.3. Структурные дефекты
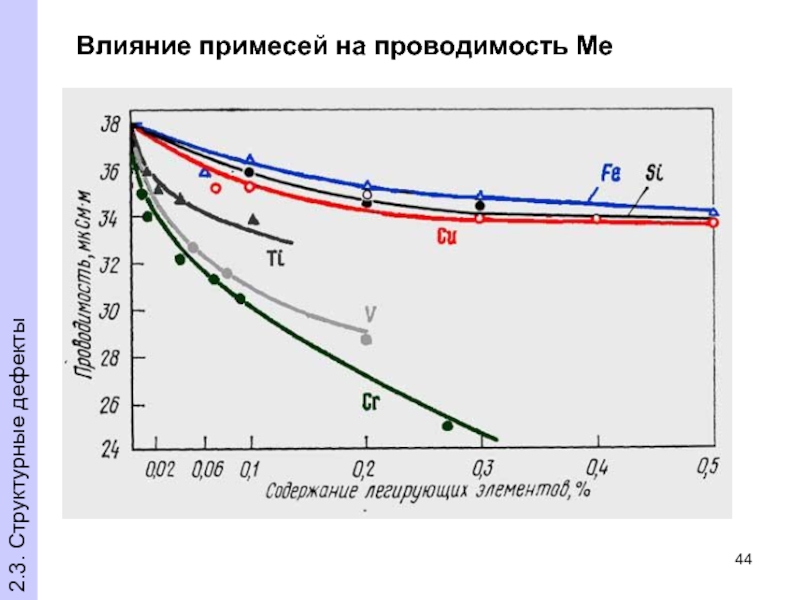
- 44. Влияние примесей на проводимость Ме 2.3. Структурные дефекты
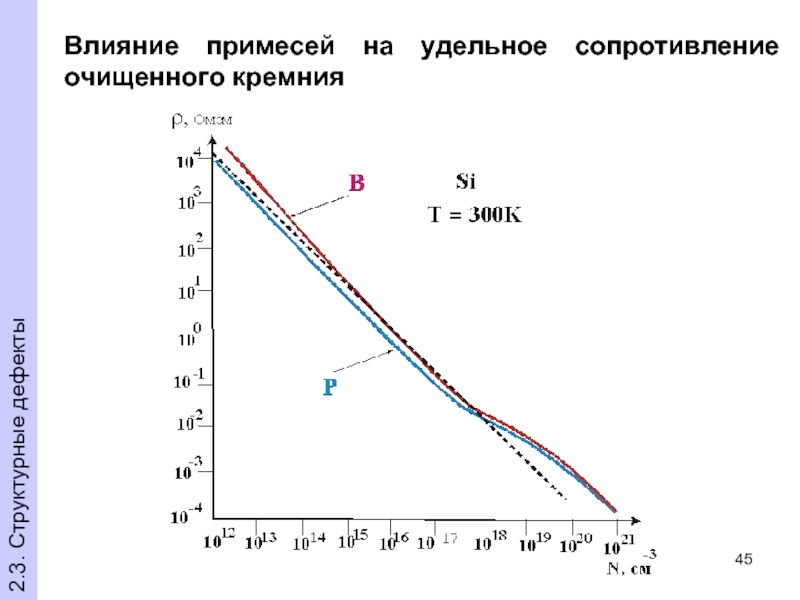
- 45. Влияние примесей на удельное сопротивление очищенного кремния 2.3. Структурные дефекты
- 46. Спасибо за внимание!
Слайд 1Омский государственный технический университет
каф. Технология электронной аппаратуры
Дисциплина
Радиоматериалы и радиокомпоненты
Лекция 2. Строение
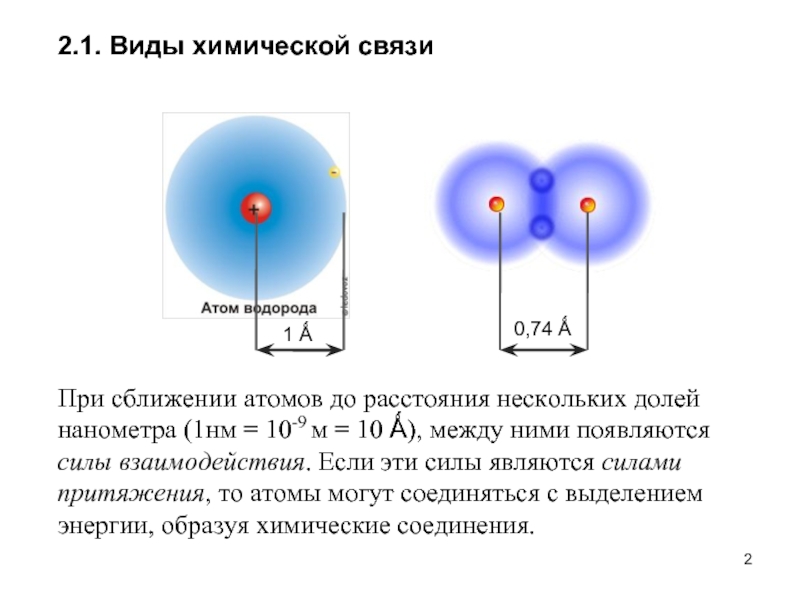
Слайд 22.1. Виды химической связи
При сближении атомов до расстояния нескольких долей нанометра
1 Ǻ
0,74 Ǻ
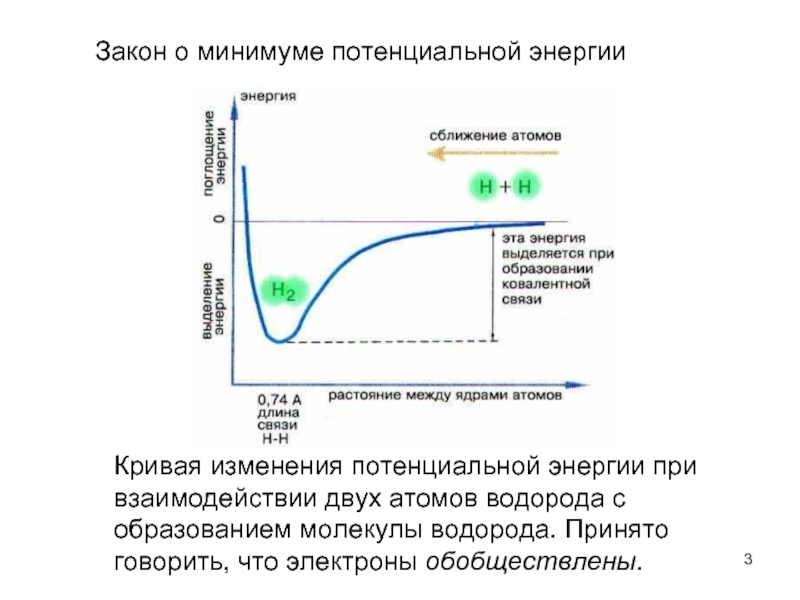
Слайд 3Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием
Закон о минимуме потенциальной энергии
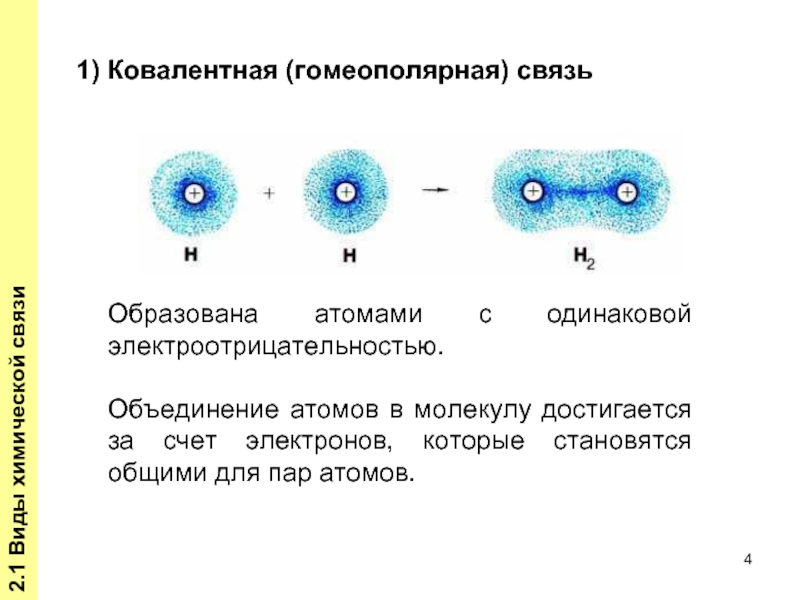
Слайд 42.1 Виды химической связи
Образована атомами с одинаковой электроотрицательностью.
Объединение атомов в молекулу
1) Ковалентная (гомеополярная) связь
Слайд 52.1 Виды химической связи
Ковалентная связь характерна как для органических, так и
Слайд 62.1 Виды химической связи
Ковалентная неполярная связь
центры положительных и отрицательных зарядов совпадают.
Ковалентная
центры положительных и отрицательных зарядов не совпадают и находятся на некотором расстоянии друг от друга.
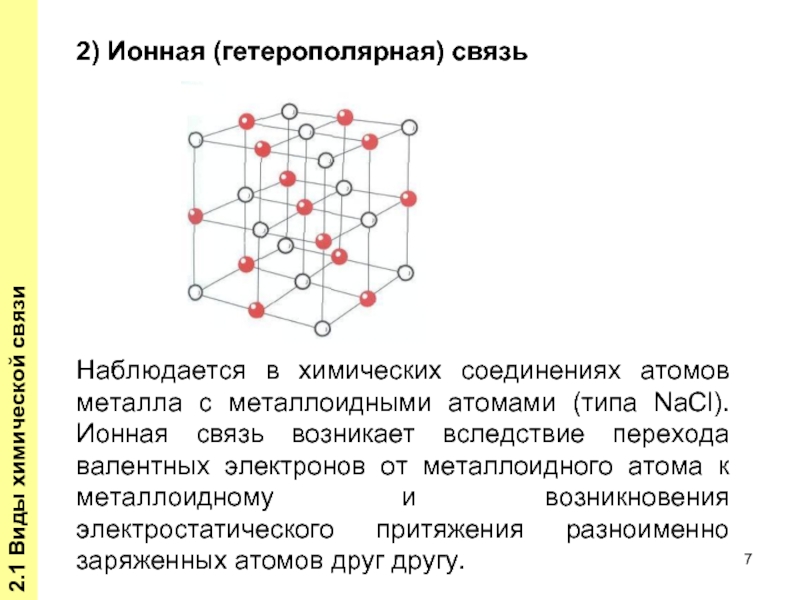
Слайд 72.1 Виды химической связи
Наблюдается в химических соединениях атомов металла с металлоидными
2) Ионная (гетерополярная) связь
Слайд 82.1 Виды химической связи
Сульфид свинца PbS
Сульфид свинца — хороший материал полупроводниковой
Слайд 92.1 Виды химической связи
Существует в системах, построенных из положительных атомных островов,
3) Металлическая связь
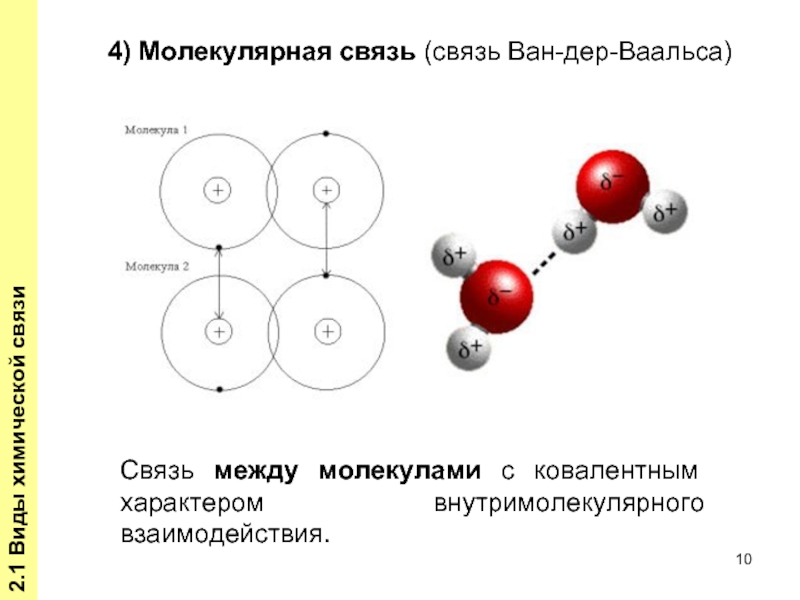
Слайд 102.1 Виды химической связи
Связь между молекулами с ковалентным характером внутримолекулярного взаимодействия.
4)
Слайд 14Газообразное состояние молекул наиболее беспорядочное и структурно не устойчивое.
Жидкое состояние вещества
Агрегатные состояния вещества
Слайд 15Твердое состояние характеризуется тремя признаками: упругостью, кристаллической структурой и скачкообразным изменением
При медленном охлаждении расплава и специальном выращивании получают монокристалл; при средней скорости охлаждения – поликристаллические структуры; при очень быстром охлаждении – вещества аморфной структуры.
Агрегатные состояния вещества
Слайд 17Аморфные структуры – это структуры, не имеющие явно выраженного дальнего порядка
2.2. Структура твердых тел
Стекло
Канифоль
Органические
Материалы
Смолы
2.2. Структура твердых материалов
Слайд 19Кристаллические структуры – это структуры, представляющие периодическую решетку, в узлах которой
Кварц
Полупроводниковые
Кристаллы
Металлы
2.2. Структура твердых материалов
Слайд 20Монокристаллы – однородные анизотропные тела, которые характеризуются правильным порядком в расположении
Большое промышленное значение имеют монокристаллы полупроводниковых и диэлектрических материалов, выращиваемые в специальных условиях.
Физические свойства:
1)Правильная геометрическая форма 2)Постоянная температура плавления. 3)Анизотропия.
2.2. Структура твердых материалов
Слайд 21Однако большинство кристаллических веществ являются поликристаллическими.
Поликристаллические материалы состоят из множества
Al, Be, Mg, Ti и др.
2.2. Структура твердых материалов
Слайд 22Физические свойства:
1)Правильная форма.
2)Постоянная температура плавления 3)Изотропия.
электротехническая сталь
поликристалличский
кремний
2.2. Структура
Слайд 23Если ориентацию кристаллитов упорядочить (мехобработкой металла, поляризацией сегнетокерамики), то материал становится
2.2. Структура твердых материалов
Слайд 24Трехмерная кристаллическая структура
Элементарная ячейка
- решетка Браве.
2.2. Структура твердых материалов
Слайд 25Существует четырнадцать типов решеток Браве. 7 кристаллических систем (сингоний). Системы отличаются
Все кристаллы по виду симметрии подразделяют на 32 класса. Всего существует 230 пространственных групп.
2.2. Структура твердых материалов
Слайд 27Четыре типа сложных элементарных ячеек.
а) Объемоцентрированная (ОЦ) ячейка
б) Гранецентрированная
2.2. Структура твердых материалов
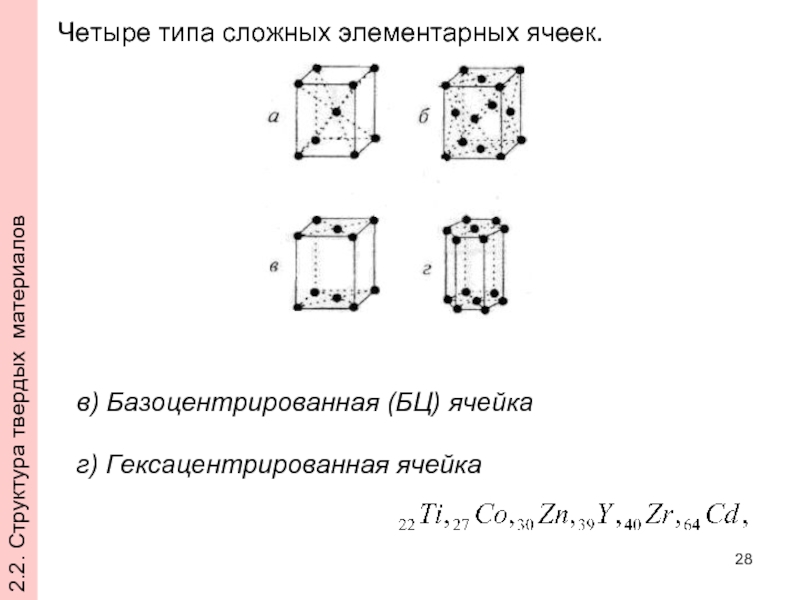
Слайд 28Четыре типа сложных элементарных ячеек.
в) Базоцентрированная (БЦ) ячейка
г) Гексацентрированная
2.2. Структура твердых материалов
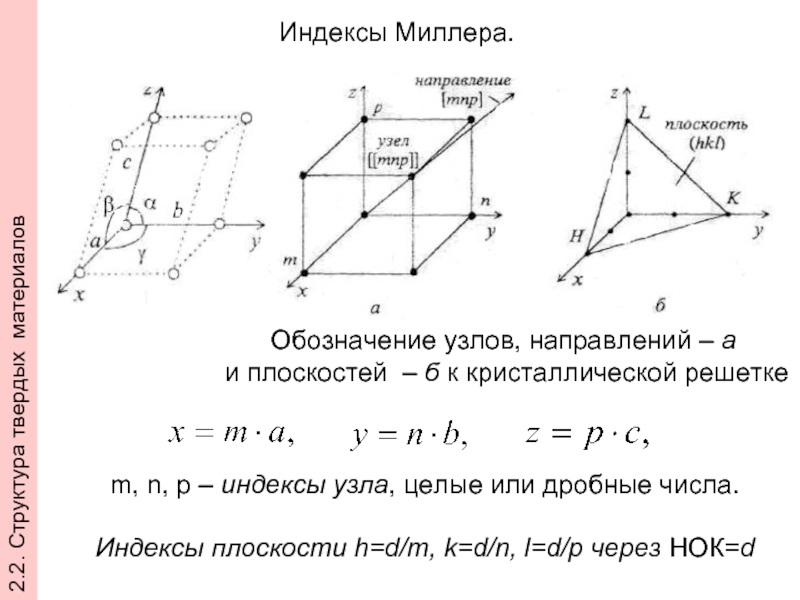
Слайд 29Индексы Миллера.
Обозначение узлов, направлений – а
и плоскостей – б
m, n, p – индексы узла, целые или дробные числа.
Индексы плоскости h=d/m, k=d/n, l=d/p через НОК=d
2.2. Структура твердых материалов
Слайд 31Полиморфизм (аллотропия)
это способность образовывать не одну, а две и более кристаллические
Модификация, устойчивую при нормальной и более низкой температуре обозначается α
Кристаллические структуры называют полиморфными формами или аллотропными модификациями вещества.
2.2. Структура твердых материалов
Слайд 382.3. Структурные дефекты твердых тел.
Дефекты – отклонения от регулярного расположения
1) Динамические (временные) д. возникают при механических, тепловых (фононы) и электромагнитных воздействиях.
2) Статические (постояные) д. это точечные (атомные) или протяженные несовершенства структуры
Слайд 39Точечные дефекты твердых тел.
а – дефекты типа внедрения;
б –
в – дефекты по Френкелю;
г – дефекты по Шоттки
2.3. Структурные дефекты
Слайд 40Линейные дефекты твердых тел.
Дислокация – это линейный дефект, заключающийся в
а – линейная дислокация; б – винтовая дислокация
2.3. Структурные дефекты
Слайд 41Поверхностные дефекты твердых тел.
Поверхностная зона 5 – 10 атомных диаметров
Ошибки в наложении слоев атомов
2.3. Структурные дефекты
Слайд 42Объемные дефекты твердых тел.
Имеют в трех измерениях сравнительно большие размеры
К ним относят микропустоты, включения другой фазы, поры, трещины.
2.3. Структурные дефекты