- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атома презентация
Содержание
- 1. Строение атома
- 2. Маленькая точка, сделанная карандашом, состоит из огромного
- 3. Демокрит В основе философии Демокрита лежит учение
- 4. М.В. Ломоносов (1711-1765 гг.) Материя
- 5. В 1895 году немецкий учёный Уильям Конрад
- 6. В 1898 году Пьер Кюри и Мария
- 7. Английский физик Эрнест Резерфорд в 1909 г.
- 8. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
- 9. Модель Томсона Дж. Дж. Томсон в 1898
- 10. Э. Резерфорд предложил планетарную модель атома: в
- 11. Родители атома. Демокрит (460 до н. э.
- 13. Строение атома электроны ядро 1-внутреняя сфера, в
- 14. 1. В центре атома находится положительно заряженное
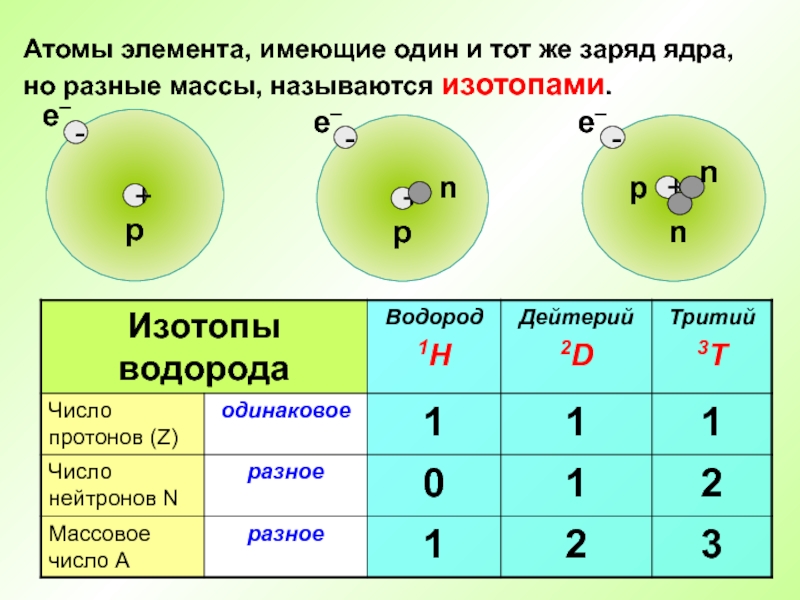
- 15. Атомы элемента, имеющие один и тот же заряд ядра, но разные массы, называются изотопами.
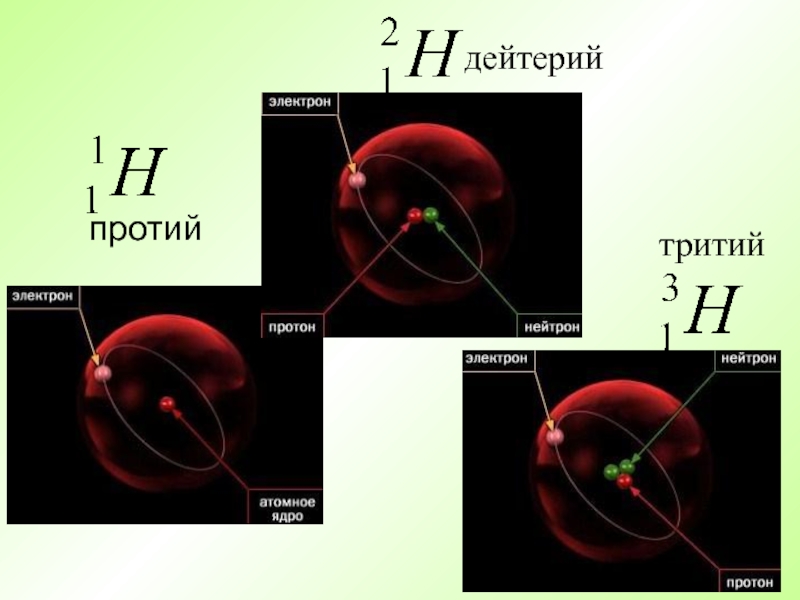
- 16. протий дейтерий тритий
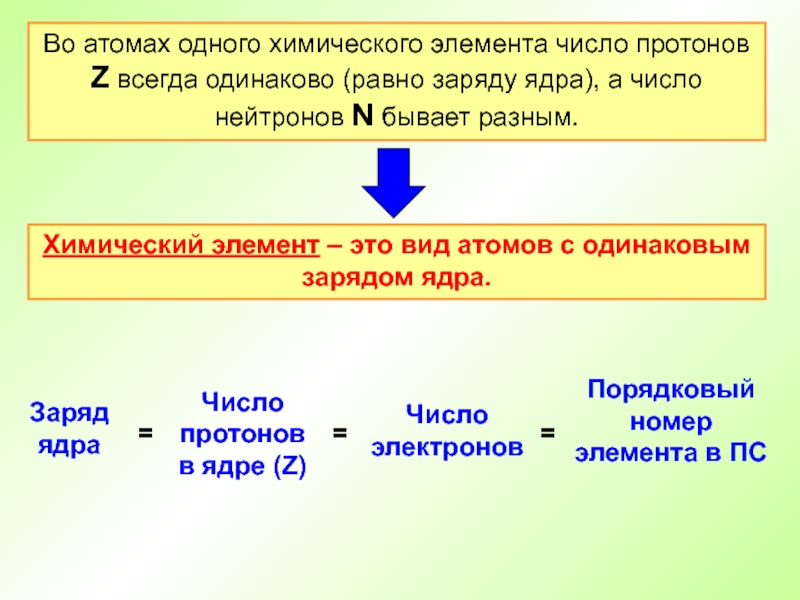
- 17. Во атомах одного химического элемента число протонов
- 18. Атом – электронейтральная частица Число протонов
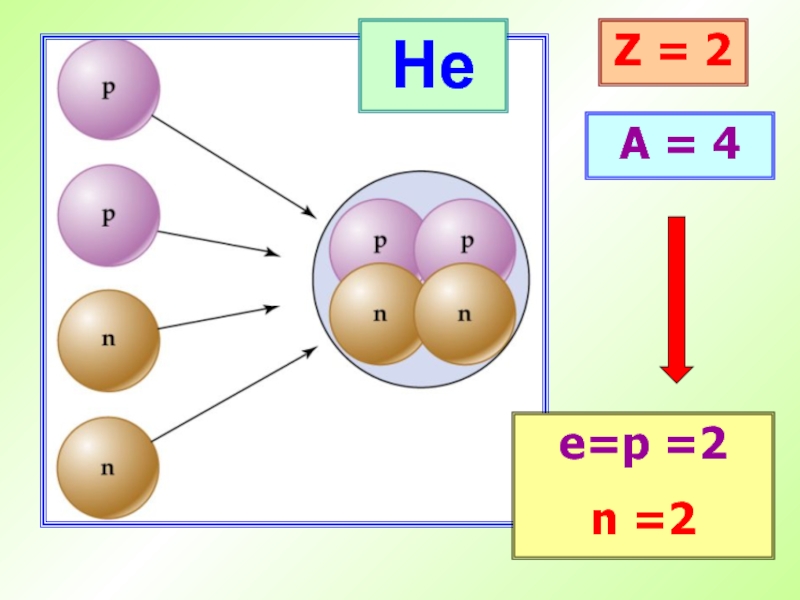
- 20. He Z = 2 A = 4 е=p =2 n =2
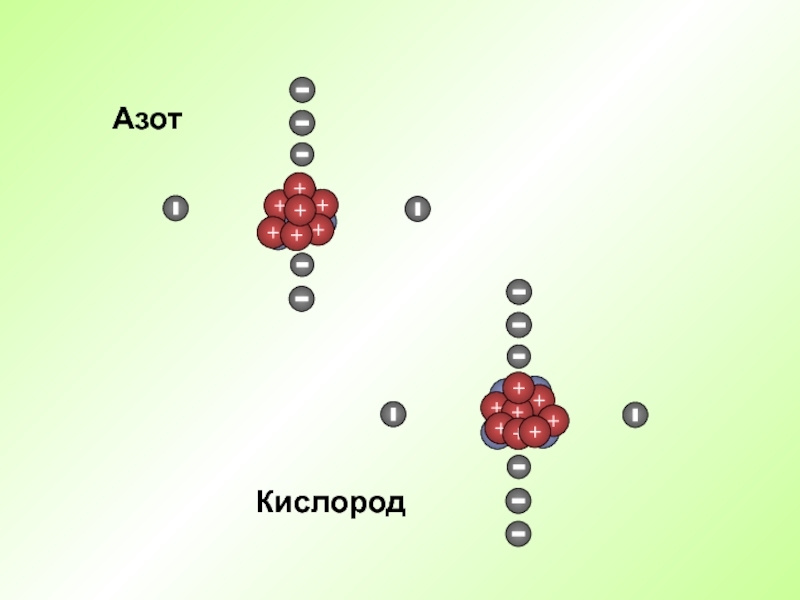
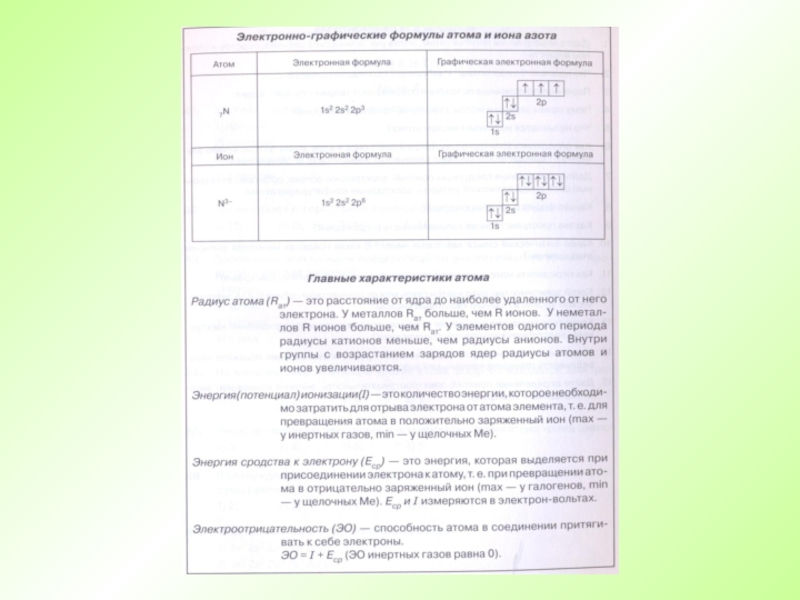
- 21. Кислород Азот
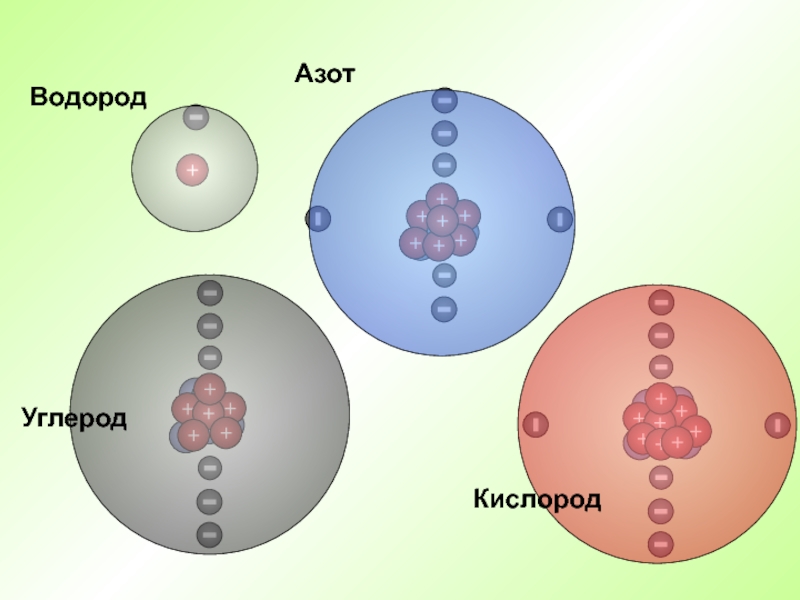
- 22. Водород
- 23. (13p + 14n) 13e
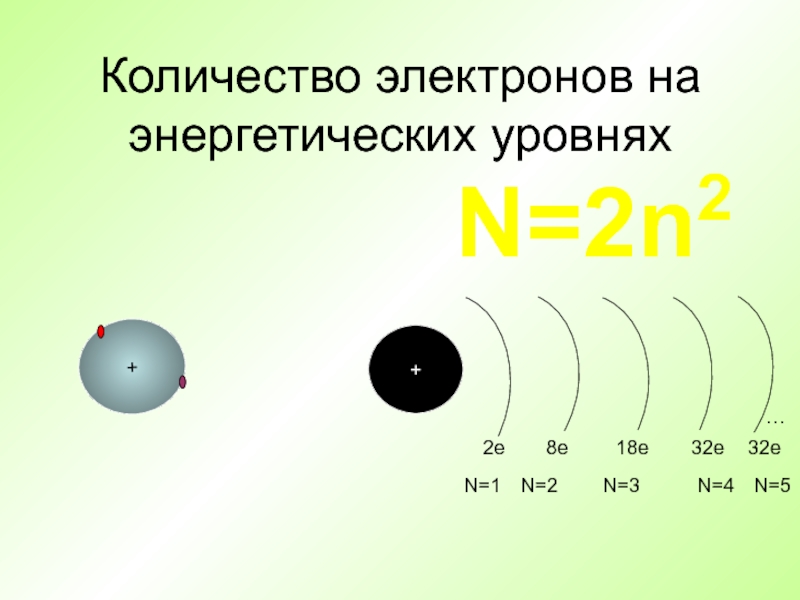
- 25. Количество электронов на энергетических уровнях + +
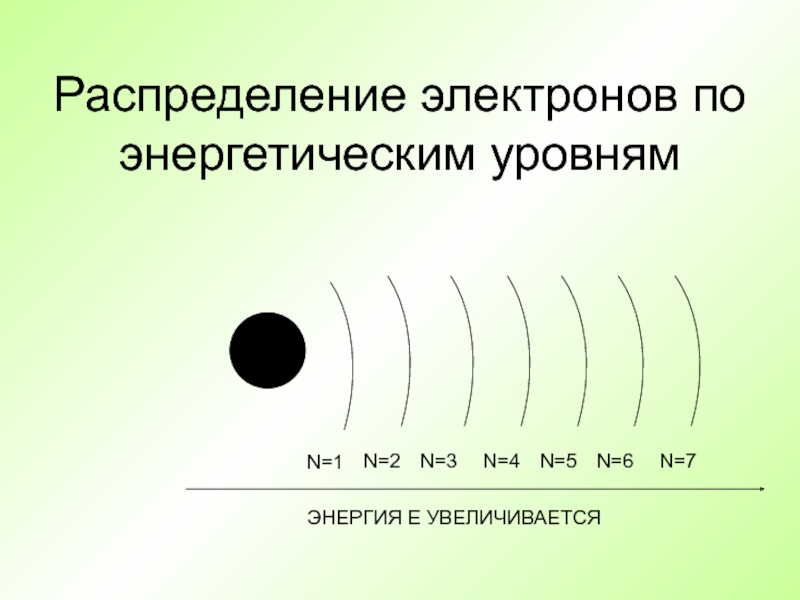
- 26. Распределение электронов по энергетическим уровням +
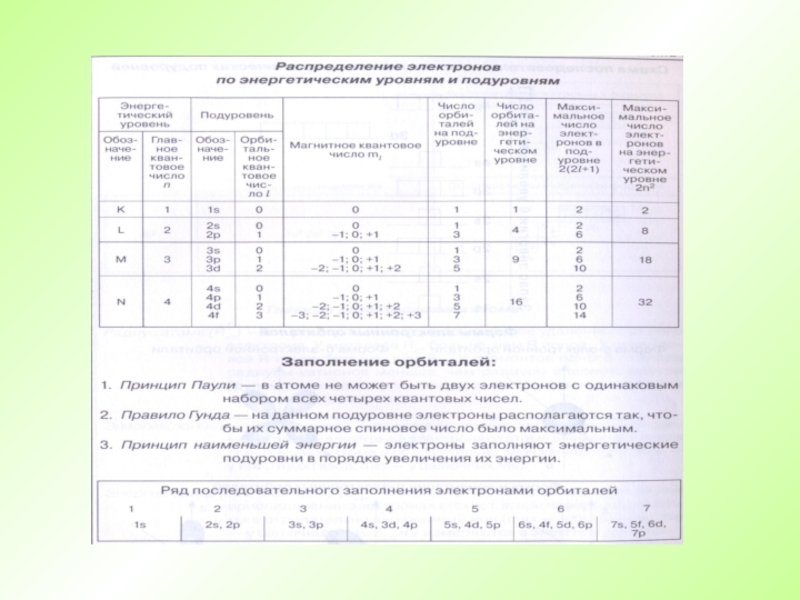
- 29. Правила для составления электронно-графической схемы Каждый уровень
- 31. Порядок заполнения орбиталей электронами VII – 7s5f6d7p 32
- 32. p+ =1 ē = 1 n0
- 33. p+ =2 ē = 2 n0
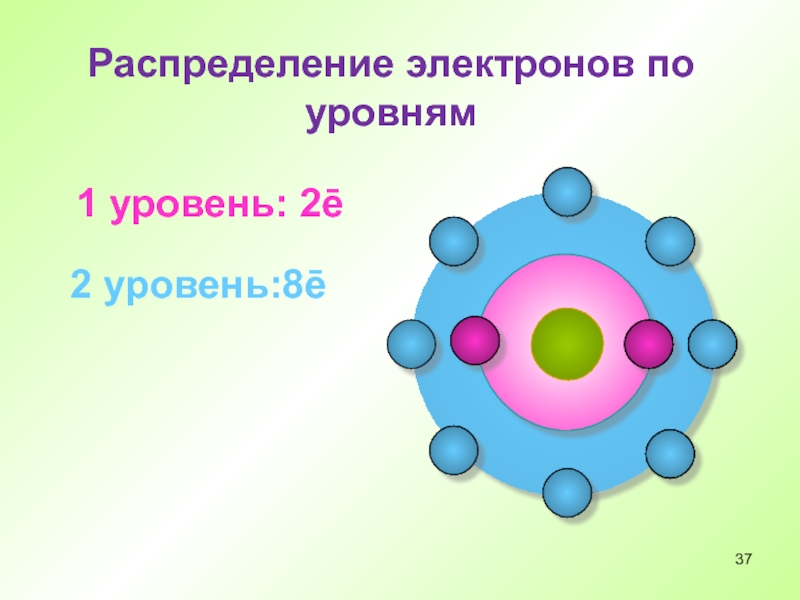
- 34. Распределение электронов по уровням 1 уровень: 2ē
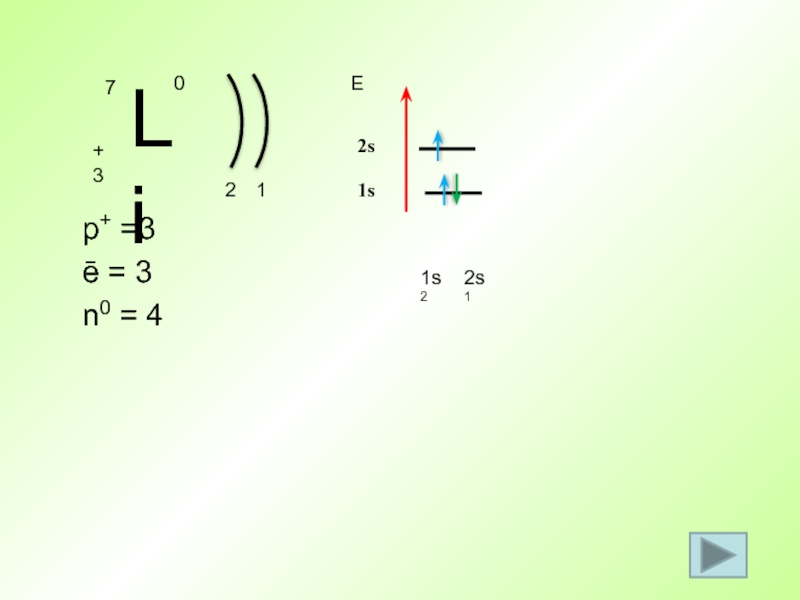
- 35. p+ =3 ē = 3 n0
- 36. p+ =7 ē =7 n0 =
- 37. Распределение электронов по уровням 1 уровень: 2ē 2 уровень:8ē
- 38. p+ =12 ē =12 n0 = 12
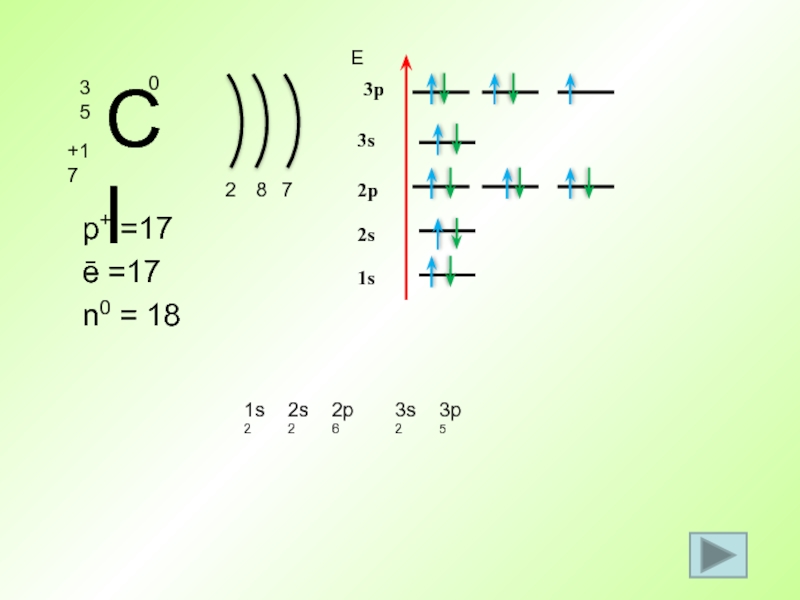
- 39. p+ =17 ē =17 n0 = 18
- 40. Проверка знаний Устно Письменно Далее: Электронная оболочка атома.
- 41. I. Строение электронной оболочки Электронная оболочка атома.
- 42. I. Строение электронной оболочки - Подуровень
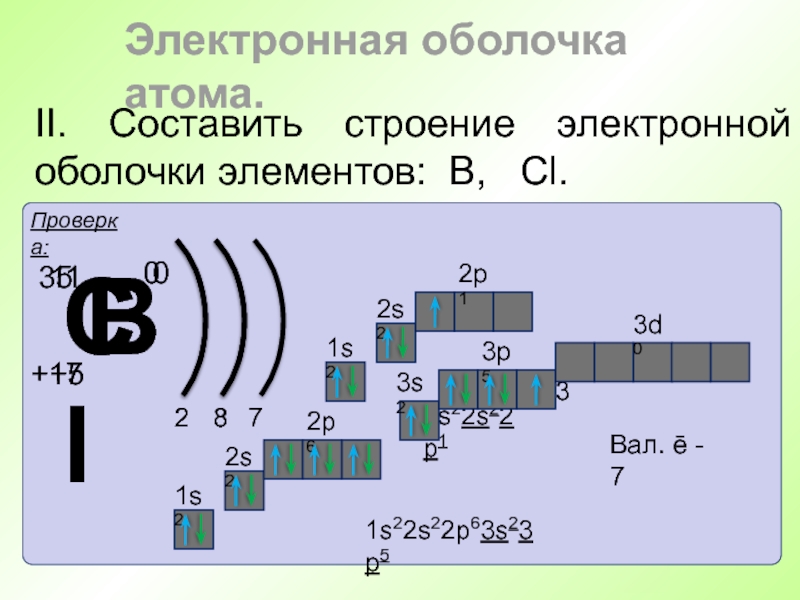
- 43. II. Составить строение электронной оболочки элементов: В, Cl. Электронная оболочка атома.
- 44. Периодический закон и периодическая система элементов Д.И. Менделеева
- 45. Открытию периодического закона предшествовало накопление знаний о
- 46. В основу своей работы по классификации химических
- 47. При переходе от лития к
- 48. Если написать ряды один под другим
- 49. Li Be B
- 50. На основании своих наблюдений 1 марта 1869
- 51. Уязвимым моментом периодического закона сразу после
- 52. Только с открытием строения атомного ядра и
- 54. Открытый Д. И. Менделеевым закон и построенная
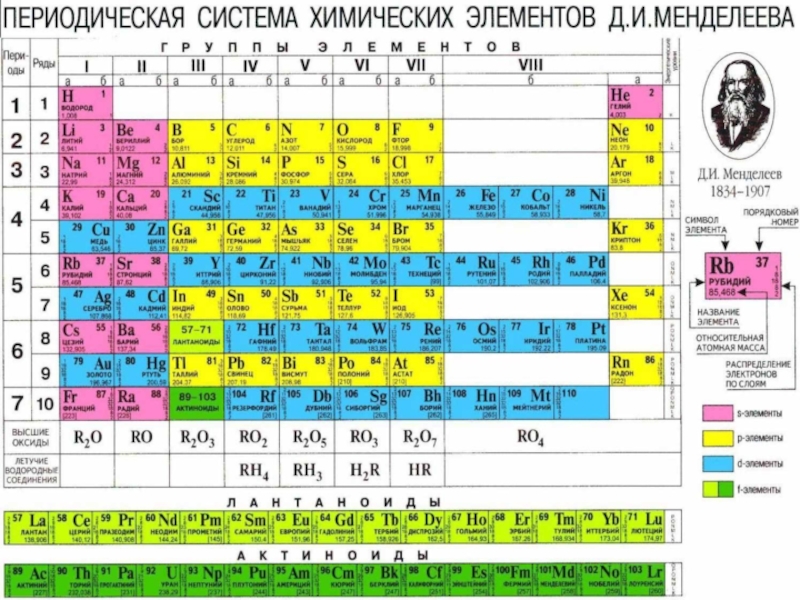
- 55. Периодическая таблица химических элементов Периоды -
- 56. Периодическая таблица химических элементов Группы - вертикальные
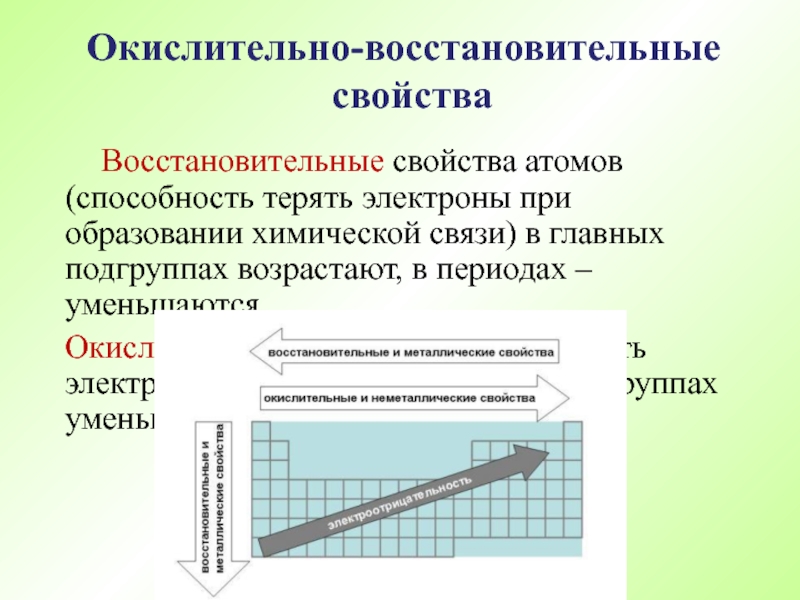
- 57. Поскольку окислительно – восстановительные свойства атомов оказывают
- 58. Восстановительные свойства атомов (способность терять электроны при
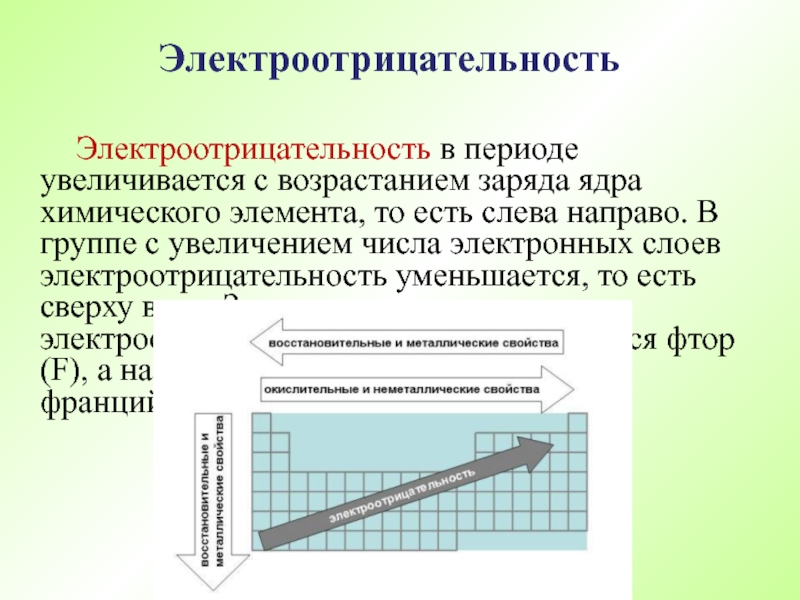
- 59. Электроотрицательность в периоде увеличивается с возрастанием заряда
- 60. Радиус атома с увеличением зарядов ядер атомов
- 61. В одной и той же группе с
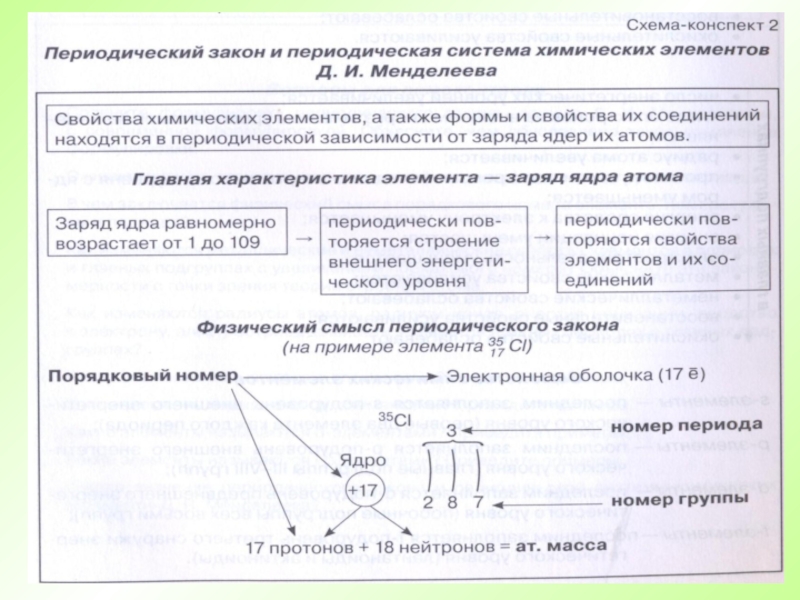
- 62. Свойства химических элементов, а также образованных ими
- 67. Значение Открытие периодического закона и создание
- 68. Памятник Д.И. Менделееву в Санкт-Петербурге
- 69. МОЛОДЦЫ !!! Вы справились. Желаю дальнейших успехов в изучении химии!
Слайд 2Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем
Слайд 3Демокрит
В основе философии Демокрита лежит учение об атомах и пустоте как
Слайд 4М.В. Ломоносов
(1711-1765 гг.)
Материя состоит из мельчайших первичных частиц, или атомов.
Атомы
Атомы характеризуются определенным размером и массой.
Молекулы состоят из атомов, как из одинаковых, так и различных.
При физических явлениях молекулы сохраняются, при химических – разрушаются.
Химические реакции заключаются в образовании новых молекул из тех же самых атомов, из которых состояли исходные вещества.
атомно-
молекулярная
теория
Джон Дальтон
(1766-1844 гг.)
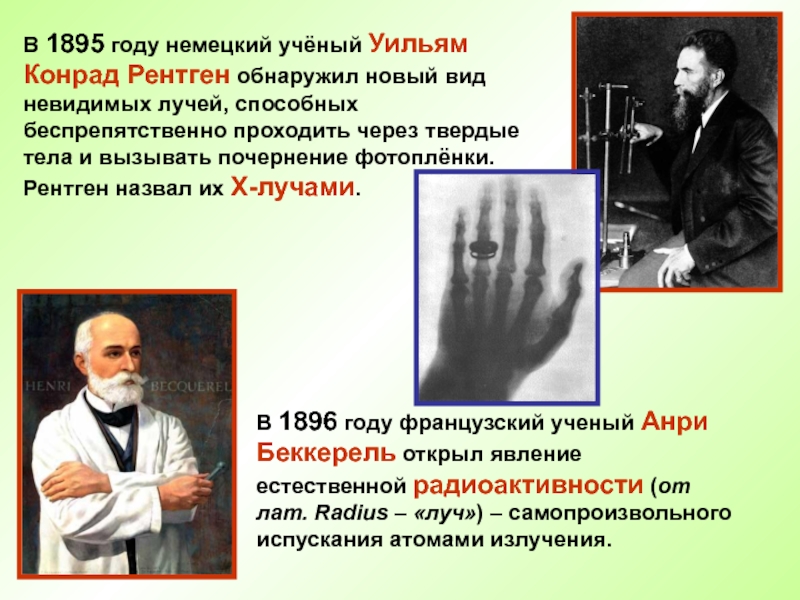
Слайд 5В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид
В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности (от лат. Radius – «луч») – самопроизвольного испускания атомами излучения.
Слайд 6В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие
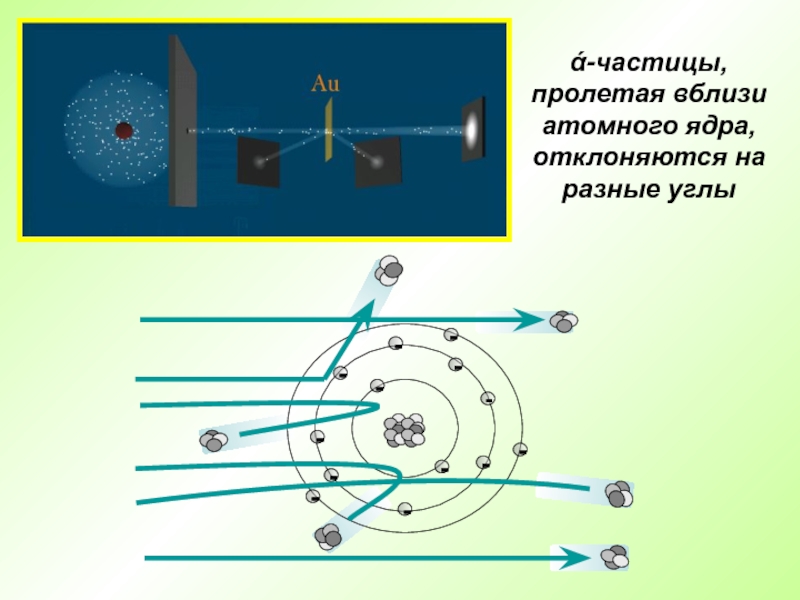
Слайд 7Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт Резерфорда:
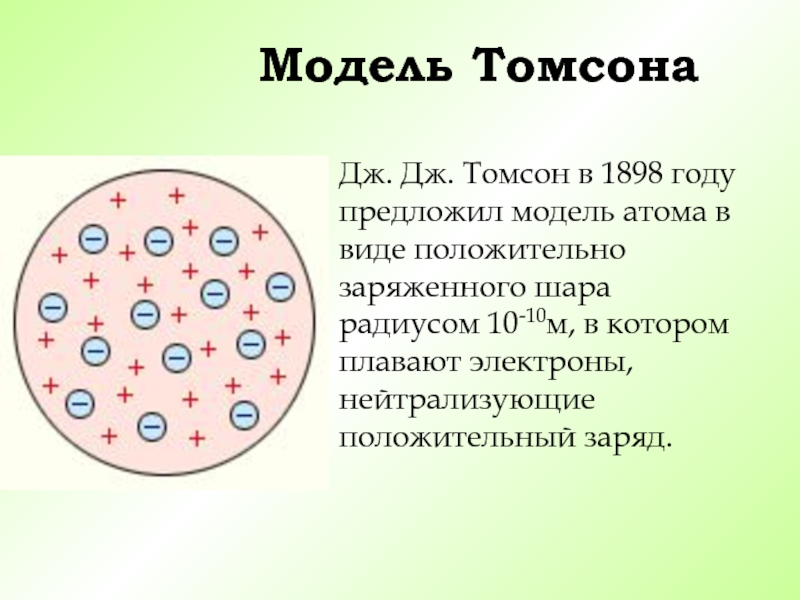
Слайд 9Модель Томсона
Дж. Дж. Томсон в 1898 году предложил модель атома в
Слайд 10Э. Резерфорд предложил планетарную модель атома: в центре находится положительно заряженное
Слайд 11Родители атома.
Демокрит
(460 до н. э. —
370 до н. э.)
Джозеф Джон
Томсон
(1856–1940 г)
Эрнест
Резерфорд
(1871–1937г)
Джеймс
Чедвик
(1891–1974г)
Атом Пудинг Планетарная Сложное
с изюмом модель строение ядра
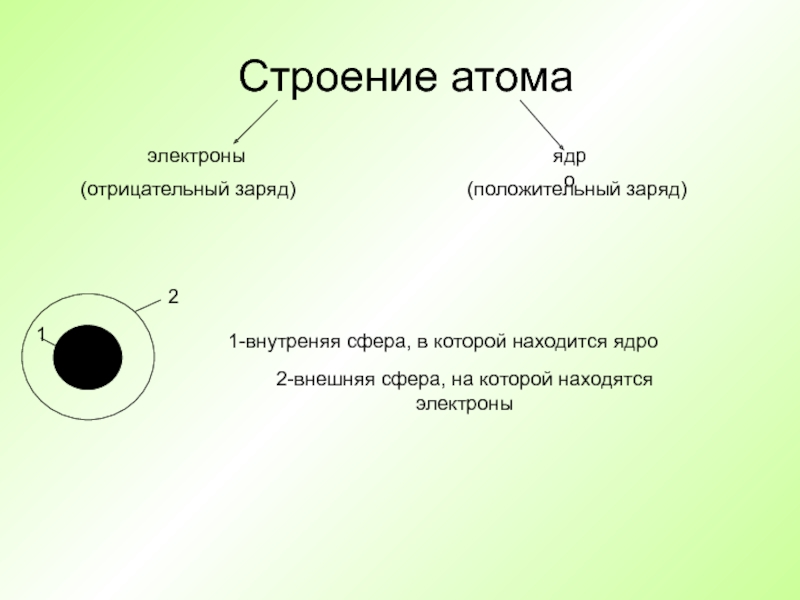
Слайд 13Строение атома
электроны
ядро
1-внутреняя сфера, в которой находится ядро
2-внешняя сфера, на которой находятся
(отрицательный заряд)
(положительный заряд)
Слайд 141. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов (нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Слайд 17Во атомах одного химического элемента число протонов Z всегда одинаково (равно
Химический элемент – это вид атомов с одинаковым зарядом ядра.
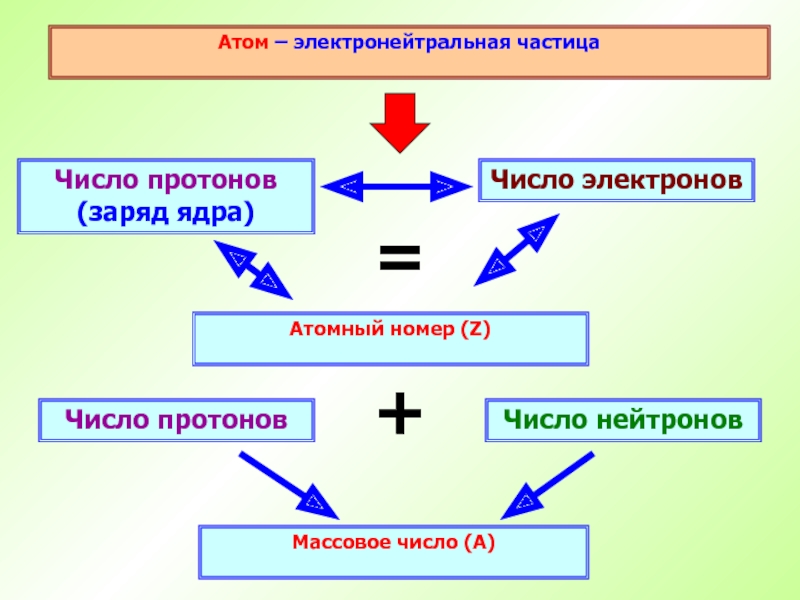
Слайд 18Атом – электронейтральная частица
Число протонов (заряд ядра)
Атомный номер (Z)
Число электронов
=
Число нейтронов
Число протонов
+
Массовое число (А)
Слайд 26Распределение электронов по энергетическим уровням
+
N=1
N=2
N=3
N=4
N=5
N=6
N=7
ЭНЕРГИЯ Е УВЕЛИЧИВАЕТСЯ
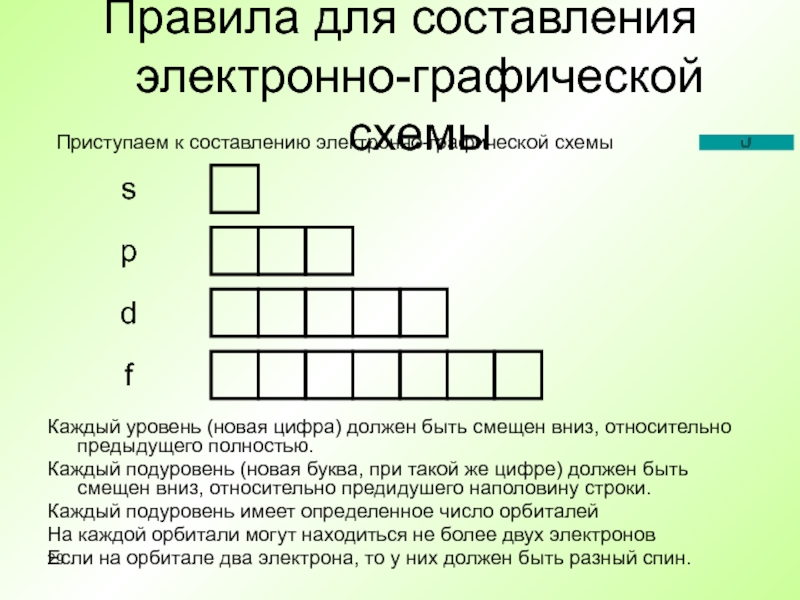
Слайд 29Правила для составления электронно-графической схемы
Каждый уровень (новая цифра) должен быть смещен
Каждый подуровень (новая буква, при такой же цифре) должен быть смещен вниз, относительно предидушего наполовину строки.
Каждый подуровень имеет определенное число орбиталей
На каждой орбитали могут находиться не более двух электронов
Если на орбитале два электрона, то у них должен быть разный спин.
s
p
d
f
Приступаем к составлению электронно-графической схемы
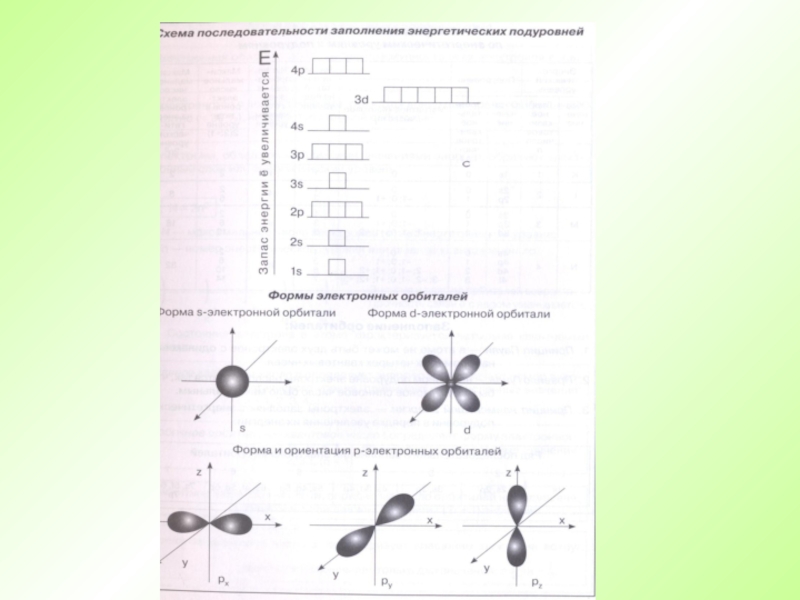
Слайд 31Порядок заполнения орбиталей электронами
VII – 7s5f6d7p 32
VI – 6s4f5d6p 32
V – 5s4d5p 18
IV –
III – 3s3p 8
II – 2s2p 8
I – 1s 2
Е
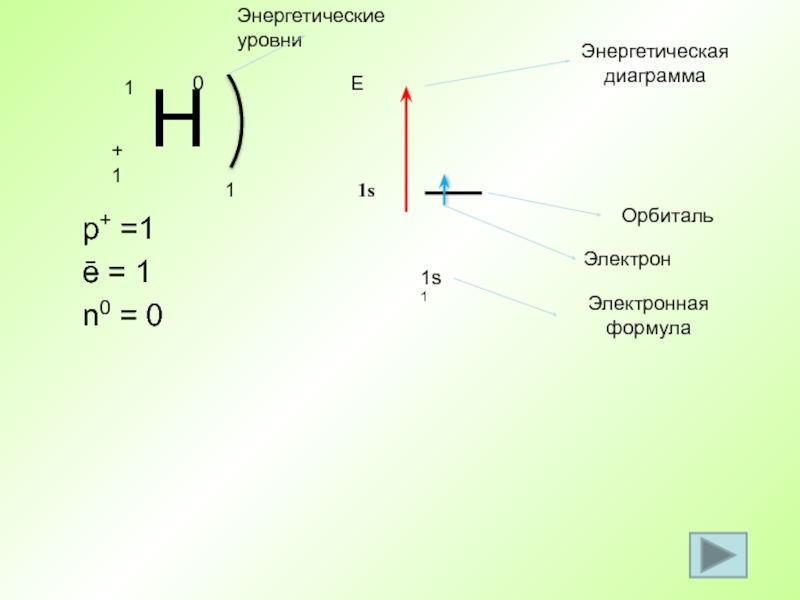
Слайд 32 p+ =1
ē = 1
n0 = 0
1
1s1
Е
1s
Энергетическая диаграмма
Орбиталь
Электрон
Электронная формула
Энергетические уровни
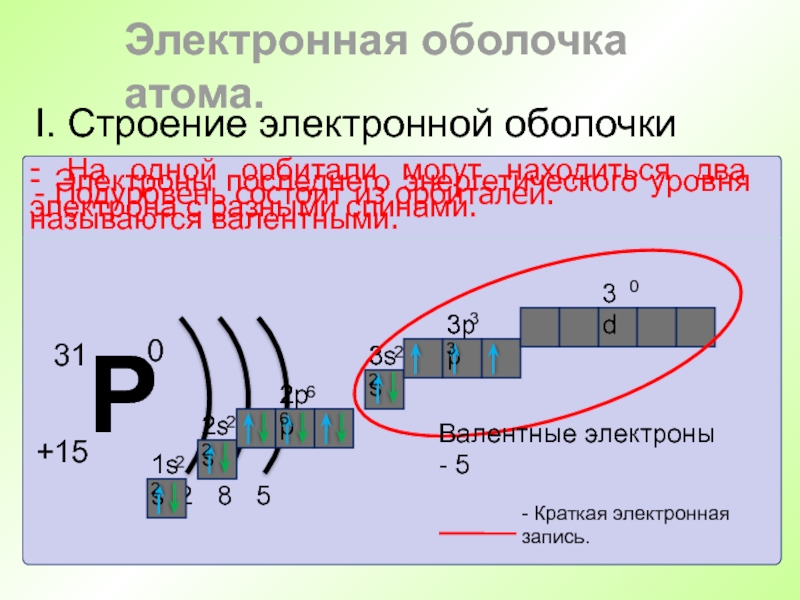
Слайд 41I. Строение электронной оболочки
Электронная оболочка атома.
- Энергетический уровень состоит из подуровней.
-
1s
2s
3s
2р
3р
3d
Слайд 42I. Строение электронной оболочки
- Подуровень состоит из орбиталей.
- На одной орбитали
2
2
6
2
3
0
1s2
2s2
2р6
3s2
3р3
- Краткая электронная запись.
- Электроны последнего энергетического уровня называются валентными.
Валентные электроны - 5
Электронная оболочка атома.
Слайд 45 Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По
Открытие Периодического закона
Слайд 46 В основу своей работы по классификации химических элементов Д.И. Менделеев положил
Открытие Периодического закона
Слайд 47
При переходе от лития к фтору происходит закономерное ослабление металлических
При переходе от фтора к следующему по значению атомной массы элементу натрию происходит скачок в изменении свойств (Nа повторяет свойства Li)
За Na следует Mg, который сходен с Ве - они проявляют металлические свойства. А1, следующий за Mg, напоминает В. Как близкие родственники, похожи Si и С; Р и N; S и О; С1 и F.
При переходе к следующему за С1 элементу К опять происходит скачок в изменении и химических свойств.
Что же было обнаружено?
Слайд 48
Если написать ряды один под другим так, чтобы под литием находился
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
Периодическая закон
Д.И. Менделеева
Слайд 49 Li Be B C
Na Mg Al Si P S Cl Ar
При таком расположении в вертикальные столбики
попадают элементы, сходные по своим свойствам.
Периодическая закон
Д.И. Менделеева
Слайд 50На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал
Первый вариант Периодической таблицы
Слайд 51
Уязвимым моментом периодического закона сразу после его открытия было объяснение причины
Периодическая таблица
Д.И. Менделеева
Ar
аргон
18
К
19
калий
39,102
39,948
Слайд 52 Только с открытием строения атомного ядра и установлением физического смысла порядкового
Свойства химических элементов и образуемых ими соединений находятся в периодической зависимости от величины заряда их атомных ядер.
Периодический закон
Д.И. Менделеева
Слайд 54 Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая
Периодическая таблица
химических элементов
Слайд 55Периодическая таблица
химических элементов
Периоды - горизонтальные ряды химических элементов, всего 7
Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл.
Слайд 56Периодическая таблица
химических элементов
Группы - вертикальные столбцы элементов с одинаковым числом электронов
Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов. Побочные подгруппы состоят из элементов только больших периодов.
Слайд 57 Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых
Окислительно-восстановительные
свойства
Слайд 58 Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в
Окислительные (способность принимать электроны), наоборот, - в главных подгруппах уменьшаются, в периодах - возрастают
Окислительно-восстановительные
свойства
Слайд 59 Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то
Электроотрицательность
Слайд 60 Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к.
Изменение радиуса атома в периоде
Слайд 61 В одной и той же группе с увеличением номера периода атомные
Изменение радиуса атома в группе
Слайд 62Свойства химических элементов, а также образованных ими веществ находятся в периодической
Современная формулировка Периодического закона