Лекция 6. Спектроскопические методы анализа.
Атомная спектроскопия
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спектроскопические методы анализа. Атомная спектроскопия презентация
Содержание
- 1. Спектроскопические методы анализа. Атомная спектроскопия
- 2. лекция6 Аналитическая химия 2. ФХМА Атомно –
- 3. лекция6 Аналитическая химия 2. ФХМА где Ne
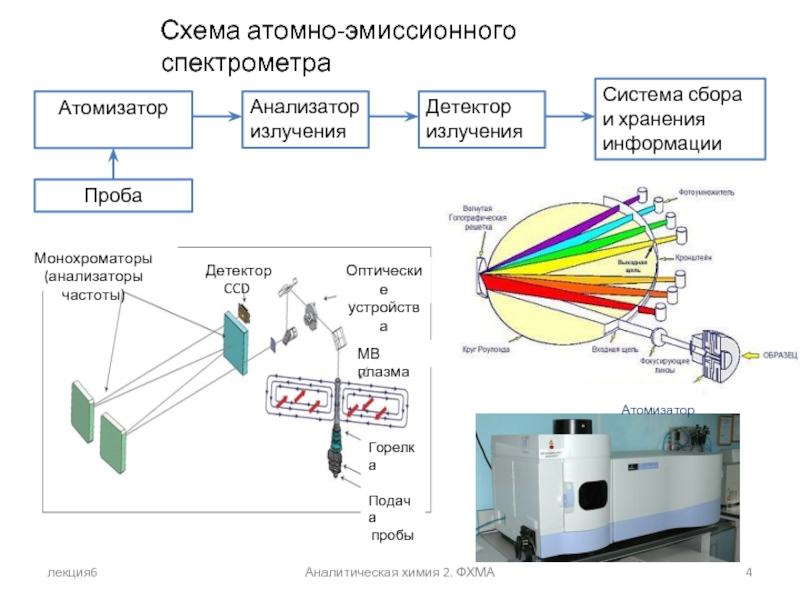
- 4. лекция6 Аналитическая химия 2. ФХМА Схема атомно-эмиссионного
- 5. лекция6 Аналитическая химия 2. ФХМА Пламя
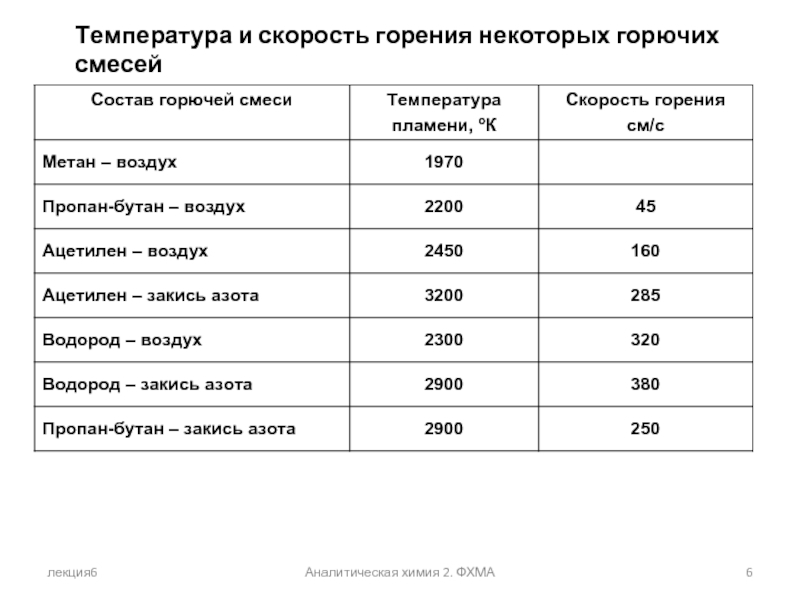
- 6. лекция6 Аналитическая химия 2. ФХМА Температура и скорость горения некоторых горючих смесей
- 7. лекция6 Аналитическая химия 2. ФХМА Электрическая дуга
- 8. лекция6 Аналитическая химия 2. ФХМА Электрическая искра
- 9. лекция6 Аналитическая химия 2. ФХМА ПЛАЗМА
- 10. Индуктивно-связанная плазма Температура газовой плазмы изменяется по
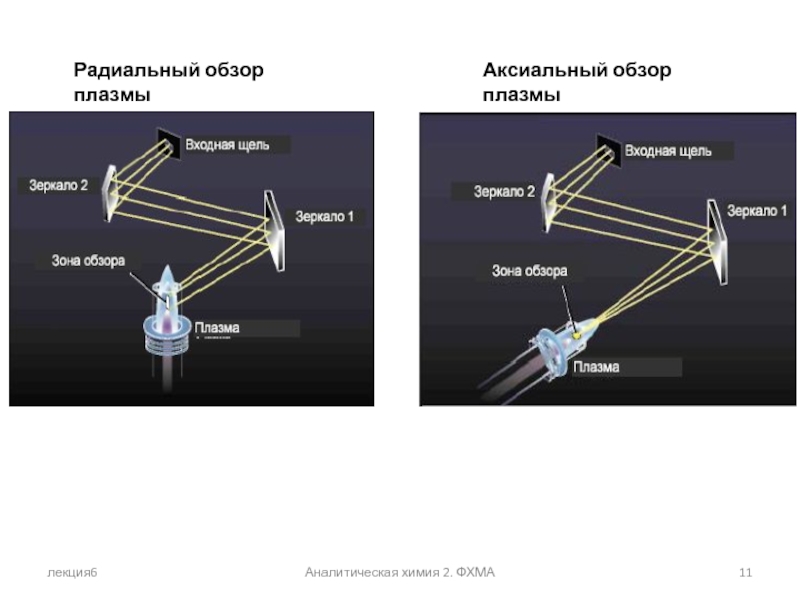
- 11. лекция6 Аналитическая химия 2. ФХМА Радиальный обзор плазмы Аксиальный обзор плазмы
- 12. лекция6 Аналитическая химия 2. ФХМА Схема процессов,
- 13. лекция6 Аналитическая химия 2. ФХМА Спектральные помехи
- 14. лекция6 Аналитическая химия 2. ФХМА Качественный анализ
- 15. лекция6 Аналитическая химия 2. ФХМА Концентрация 100ppb Концентрация 18ppb
- 16. лекция6 Аналитическая химия 2. ФХМА Метрологические характеристики АЭС
- 17. лекция6 Аналитическая химия 2. ФХМА Атомно-флуоресцентная спектроскопия
- 18. лекция6 Аналитическая химия 2. ФХМА Атомно-абсорбционная спектроскопия
- 19. лекция6 Аналитическая химия 2. ФХМА Закон Бугера-Ламберта-Бера
- 20. лекция6 Аналитическая химия 2. ФХМА Источники излучения
- 21. лекция6 Аналитическая химия 2. ФХМА Полихроматические источники
- 22. лекция6 Аналитическая химия 2. ФХМА Способы атомизации
- 23. лекция6 Аналитическая химия 2. ФХМА Методика на
- 24. лекция6 Аналитическая химия 2. ФХМА Сравнение метрологических характеристик различных способов атомизации
- 25. лекция6 Аналитическая химия 2. ФХМА Атомно-абсорбционный спектрометр
- 26. лекция6 Аналитическая химия 2. ФХМА Спектральные помехи
- 27. лекция6 Аналитическая химия 2. ФХМА Количественный анализ
Слайд 1Аналитическая химия II. Физические и физико-химические методы анализа
лекция6
Аналитическая химия 2.
Слайд 2лекция6
Аналитическая химия 2. ФХМА
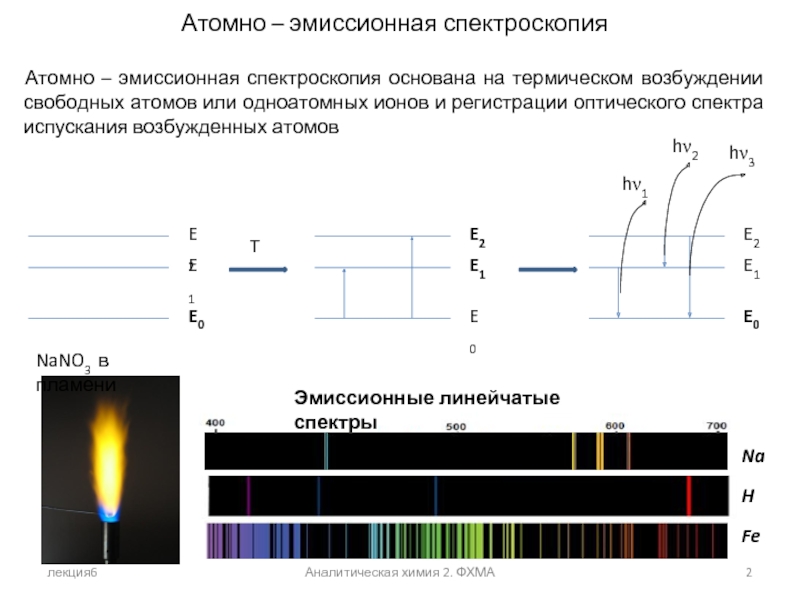
Атомно – эмиссионная спектроскопия
Атомно – эмиссионная спектроскопия основана
NaNO3 в пламени
Слайд 3лекция6
Аналитическая химия 2. ФХМА
где Ne и No – число возбужденных и
ge и go - статистические веса возбужденного и невозбужденного состояний,
k – постоянная Больцмана, Е – энергия возбуждения.
Уравнение Ломакина – Шайбе:
I=acb
Возбужденные и невозбужденные атомы находятся между собой в термодинамическом равновесии, которое описывается законом распределения Больцмана:
Слайд 5лекция6
Аналитическая химия 2. ФХМА
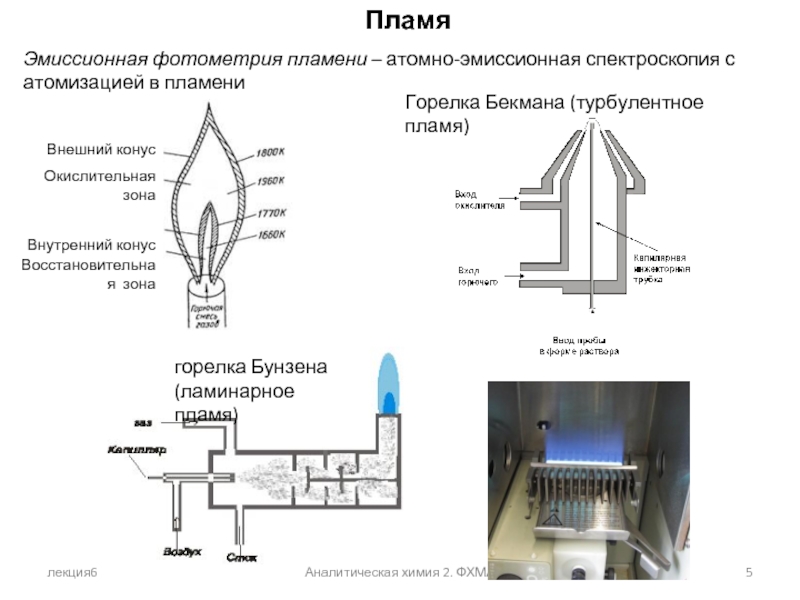
Пламя
Эмиссионная фотометрия пламени – атомно-эмиссионная спектроскопия с атомизацией
Горелка Бекмана (турбулентное пламя)
горелка Бунзена
(ламинарное пламя)
Слайд 7лекция6
Аналитическая химия 2. ФХМА
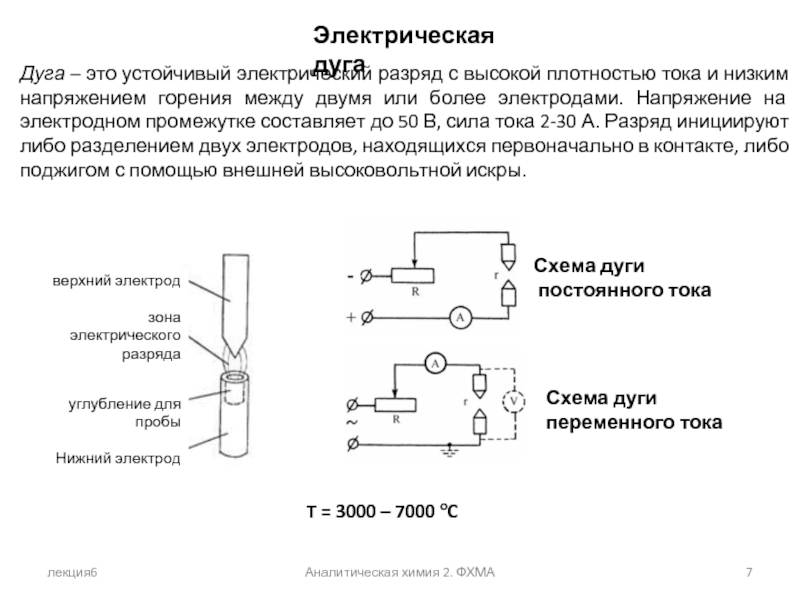
Электрическая дуга
T = 3000 – 7000 oC
Дуга –
Слайд 8лекция6
Аналитическая химия 2. ФХМА
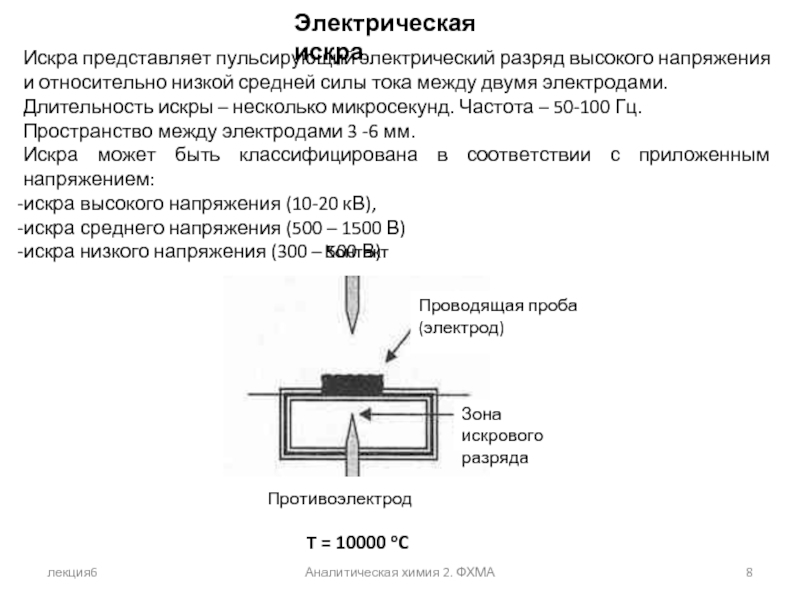
Электрическая искра
Искра представляет пульсирующий электрический разряд высокого напряжения
Длительность искры – несколько микросекунд. Частота – 50-100 Гц.
Пространство между электродами 3 -6 мм.
Искра может быть классифицирована в соответствии с приложенным напряжением:
искра высокого напряжения (10-20 кВ),
искра среднего напряжения (500 – 1500 В)
искра низкого напряжения (300 – 500 В)
T = 10000 oC
Слайд 9лекция6
Аналитическая химия 2. ФХМА
ПЛАЗМА
Плазма – это ионизированный газ, который макроскопически нейтрален,
В отличие от пламени для ионизации газа и поддержания плазмы необходим подвод внешней энергии в виде электрического поля. Плазма в свою очередь передает часть энергии пробе, что приводит к атомизации и возбуждению последней.
Плазму можно классифицировать в соответствии с типом электрического поля, используемого для создания и поддержания плазмы:
плазма постоянного тока (ППТ) образуется при наложении на электроды постоянного потенциала;
индуктивно-связанная плазма (ИСП - ICP) образуется при возбуждении высокочастотного поля в катушке;
микроволновая плазма (МП) образуется при наложении микроволнового поля на кювету.
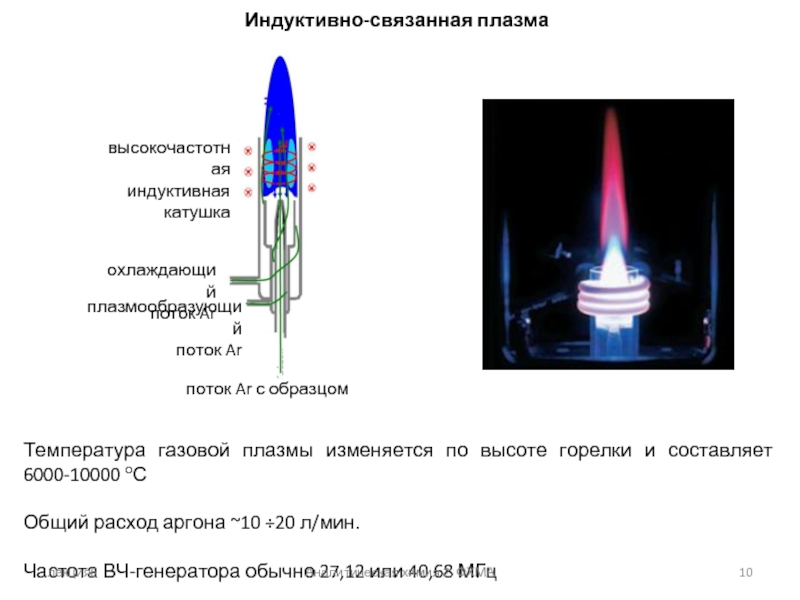
Слайд 10Индуктивно-связанная плазма
Температура газовой плазмы изменяется по высоте горелки и составляет 6000-10000
Общий расход аргона ~10 ÷20 л/мин.
Частота ВЧ-генератора обычно 27,12 или 40,68 МГц
лекция6
Аналитическая химия 2. ФХМА
Слайд 12лекция6
Аналитическая химия 2. ФХМА
Схема процессов, протекающих в атомизаторе
1 – испарение
2 –
3,5 – возбуждение
4,6 – ионизация
Физико-химические помехи
-Полнота испарения и атомизация пробы
-Ионизация: M = M++ e
-Изменение температуры плазмы
Слайд 13лекция6
Аналитическая химия 2. ФХМА
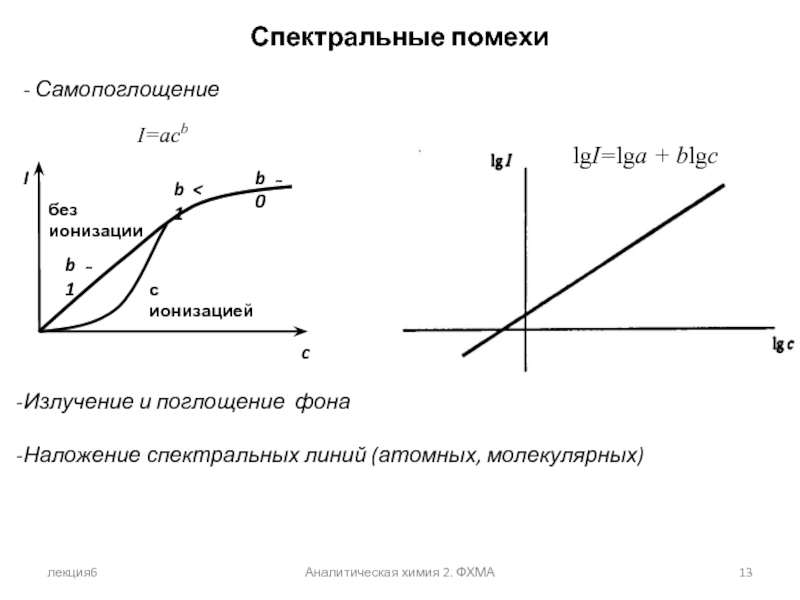
Спектральные помехи
- Самопоглощение
Излучение и поглощение фона
Наложение спектральных
I=acb
lgI=lga + blgc
с ионизацией
без ионизации
Слайд 14лекция6
Аналитическая химия 2. ФХМА
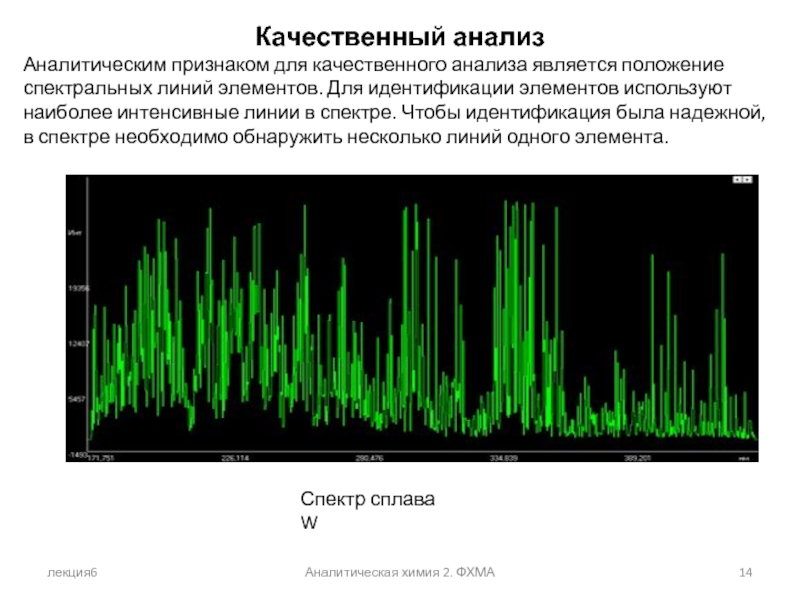
Качественный анализ
Аналитическим признаком для качественного анализа является положение
Спектр сплава W
Слайд 15лекция6
Аналитическая химия 2. ФХМА
Концентрация 100ppb
Концентрация 18ppb
Концентрация 40ppb
Идентификация
Идентификация
Идентификация
Интенсивность
Интенсивность
Интенсивность
определение Cd (сложная матрица - почва)
Выбор спектральной
для количественного анализа
Аналитическая линия определяемого элемента не должна перекрываться с интенсивными линиями других элементов, присутствующих в пробе
Аналитическая линия должна быть максимально интенсивной, но при этом она не должна перегружать детектор во всем диапазоне определяемых содержаний
Слайд 17лекция6
Аналитическая химия 2. ФХМА
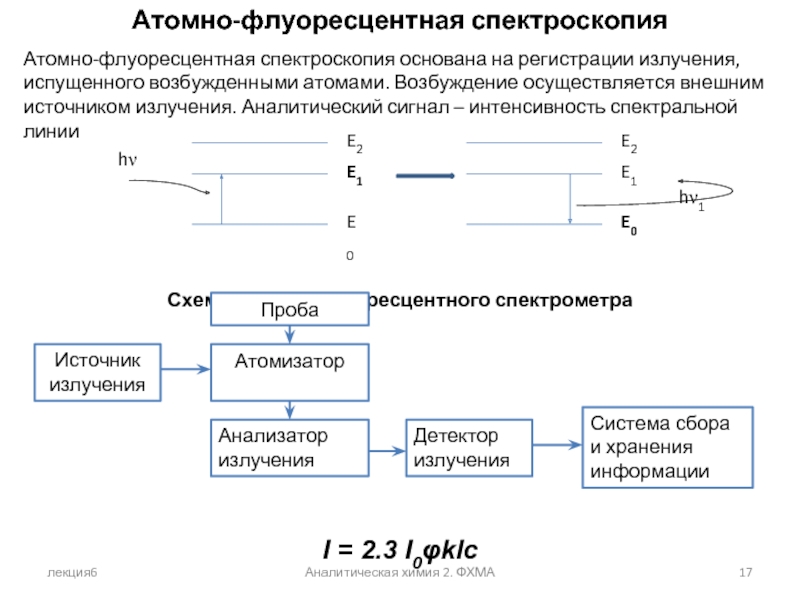
Атомно-флуоресцентная спектроскопия
Атомно-флуоресцентная спектроскопия основана на регистрации излучения, испущенного
Схема атомно-флуоресцентного спектрометра
I = 2.3 I0φklc
Слайд 18лекция6
Аналитическая химия 2. ФХМА
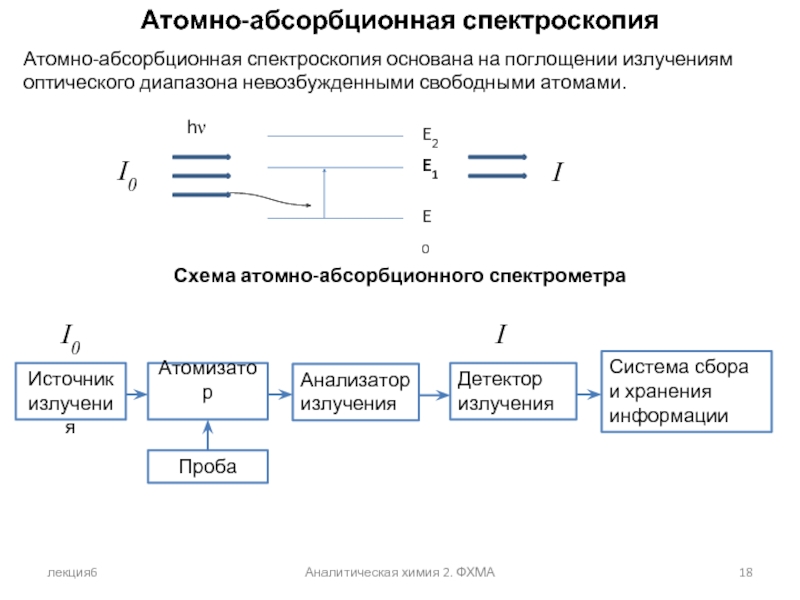
Атомно-абсорбционная спектроскопия
Атомно-абсорбционная спектроскопия основана на поглощении излучениям оптического
Схема атомно-абсорбционного спектрометра
I0
I
I0
I
Слайд 19лекция6
Аналитическая химия 2. ФХМА
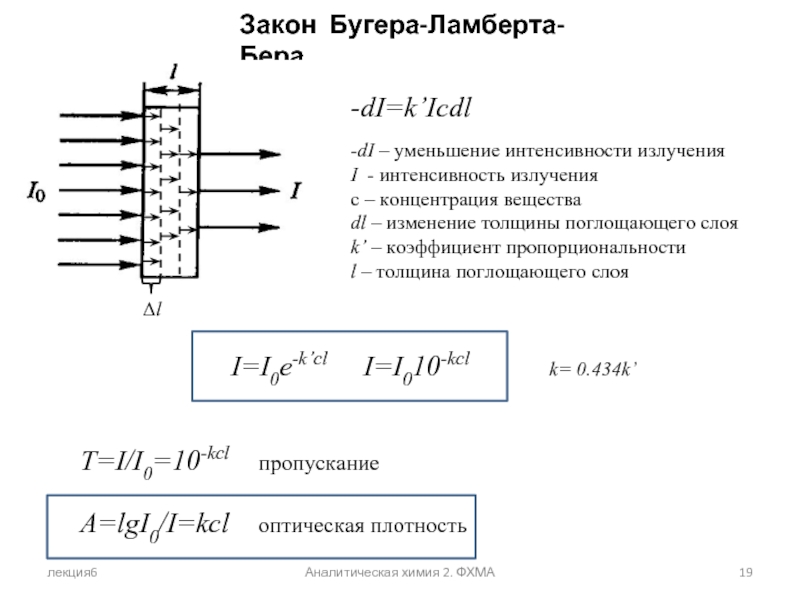
Закон Бугера-Ламберта-Бера
-dI=k’Icdl
-dI – уменьшение интенсивности излучения
I - интенсивность
с – концентрация вещества
dl – изменение толщины поглощающего слоя
k’ – коэффициент пропорциональности
l – толщина поглощающего слоя
I=I0e-k’cl I=I010-kcl k= 0.434k’
T=I/I0=10-kcl пропускание
A=lgI0/I=kcl оптическая плотность
Слайд 20лекция6
Аналитическая химия 2. ФХМА
Источники излучения
Монохроматические источники
-лампы с полым катодом (одноэлементные,
-безэлектродные разрядные лампы
As,Se,Te,P, Hg,Rb,Cs
-лазеры с перестраиваемой частотой
Слайд 21лекция6
Аналитическая химия 2. ФХМА
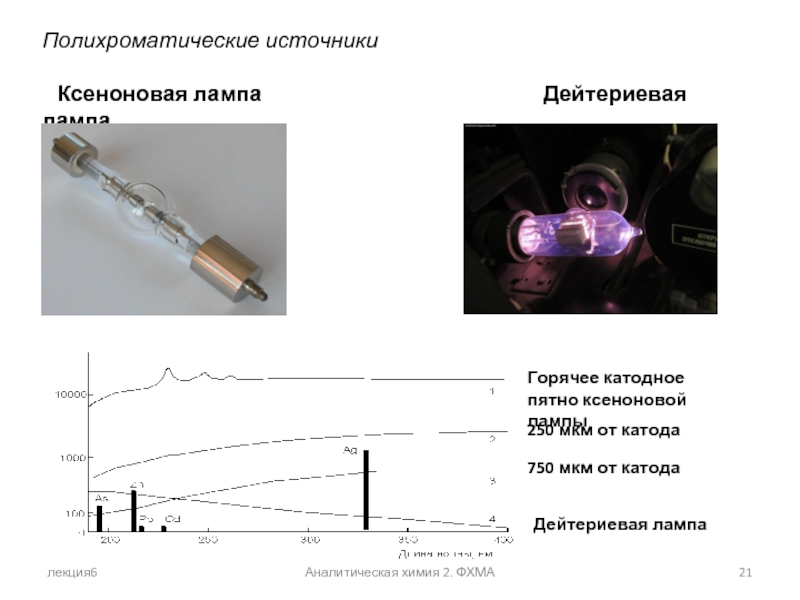
Полихроматические источники
Ксеноновая лампа
Слайд 22лекция6
Аналитическая химия 2. ФХМА
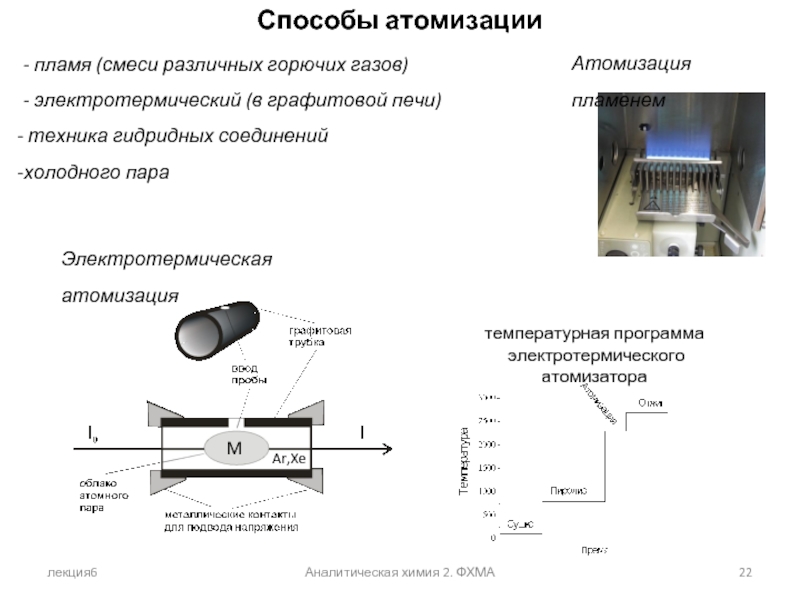
Способы атомизации
- пламя (смеси различных горючих газов)
- электротермический
техника гидридных соединений
холодного пара
Электротермическая атомизация
Атомизация пламенем
температурная программа
электротермического атомизатора
Слайд 23лекция6
Аналитическая химия 2. ФХМА
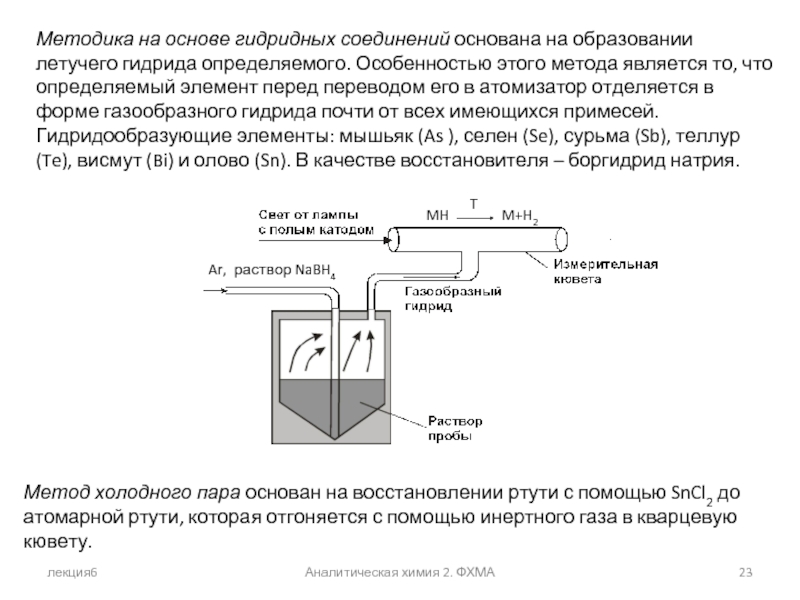
Методика на основе гидридных соединений основана на образовании
Метод холодного пара основан на восстановлении ртути с помощью SnCl2 до атомарной ртути, которая отгоняется с помощью инертного газа в кварцевую кювету.
Слайд 24лекция6
Аналитическая химия 2. ФХМА
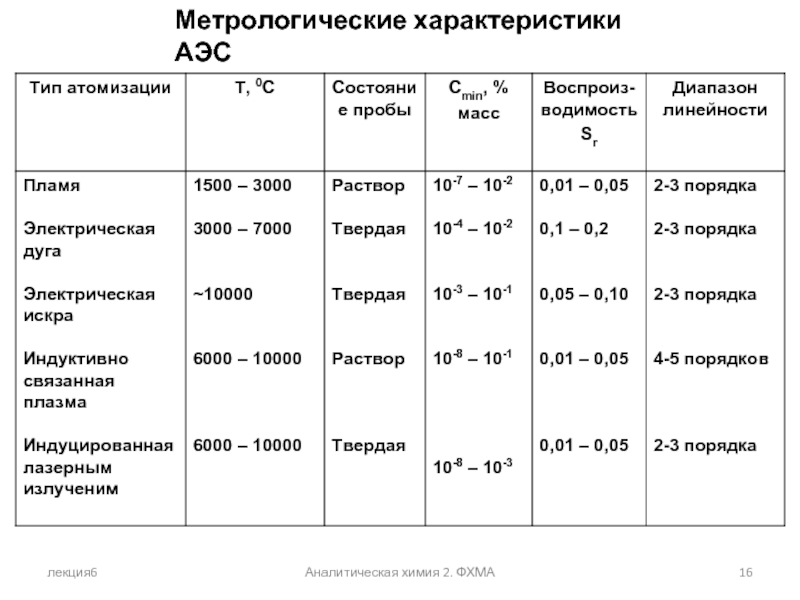
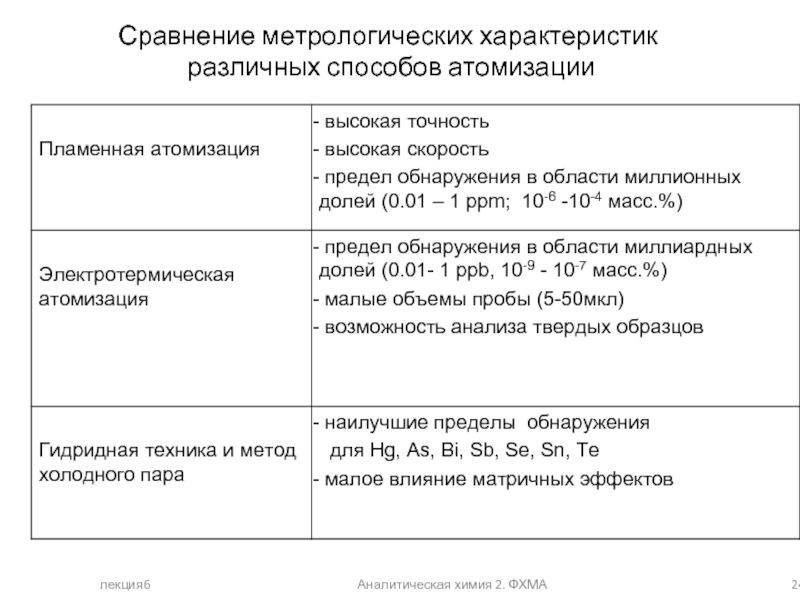
Сравнение метрологических характеристик
различных способов атомизации
Слайд 26лекция6
Аналитическая химия 2. ФХМА
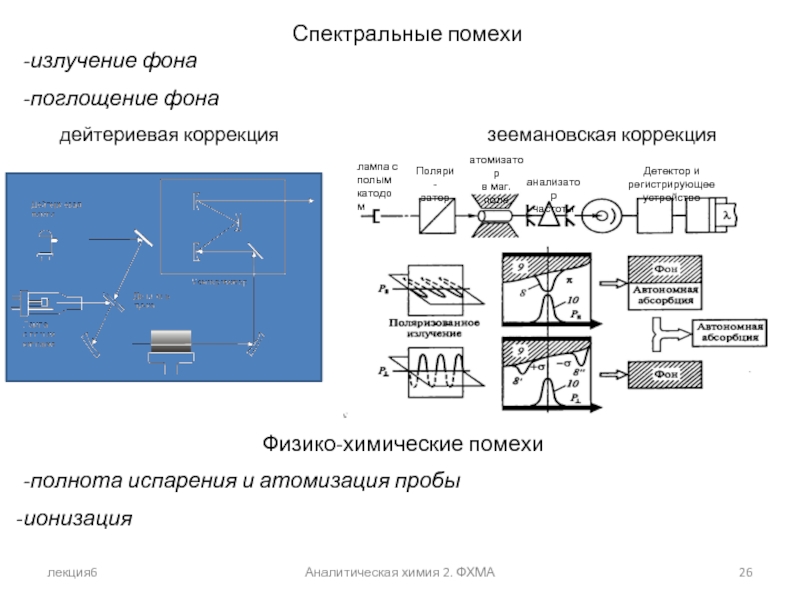
Спектральные помехи
-излучение фона
-поглощение фона
дейтериевая
Физико-химические помехи
-полнота испарения и атомизация пробы
ионизация
Слайд 27лекция6
Аналитическая химия 2. ФХМА
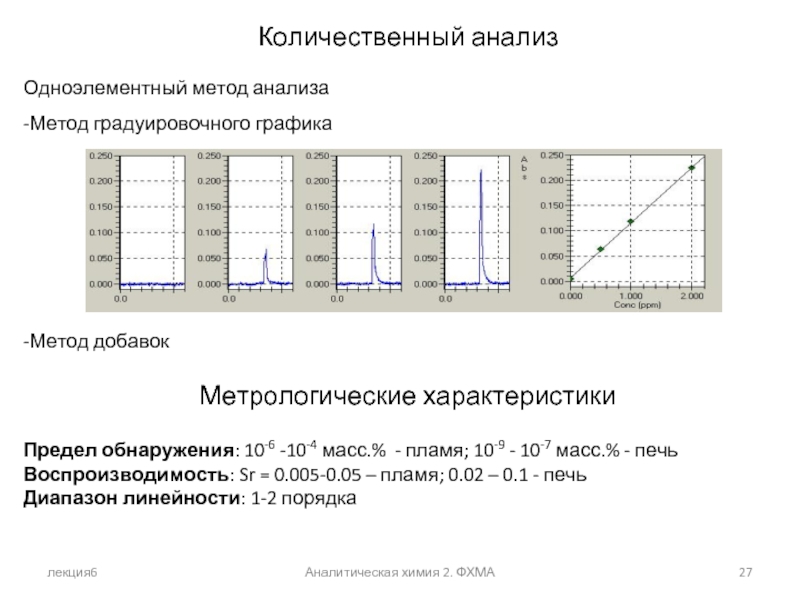
Количественный анализ
Одноэлементный метод анализа
-Метод градуировочного графика
-Метод добавок
Метрологические характеристики
Предел
Воспроизводимость: Sr = 0.005-0.05 – пламя; 0.02 – 0.1 - печь
Диапазон линейности: 1-2 порядка