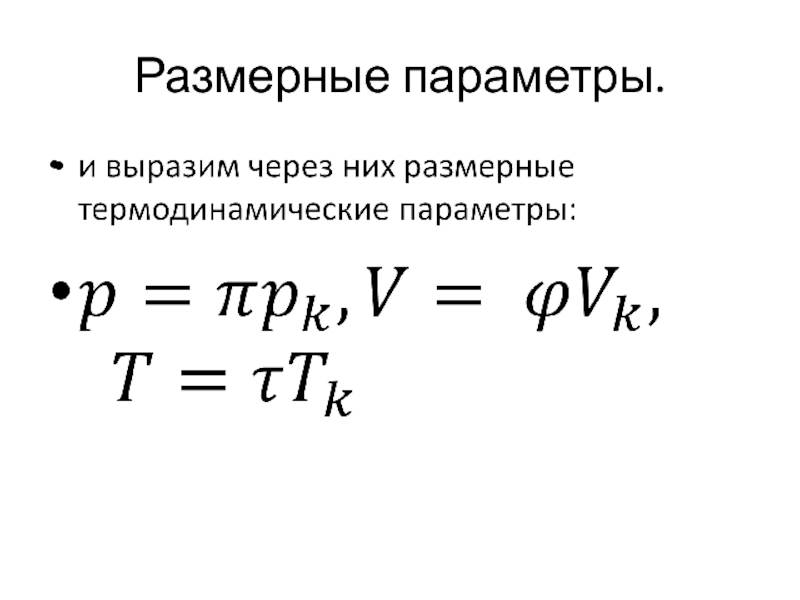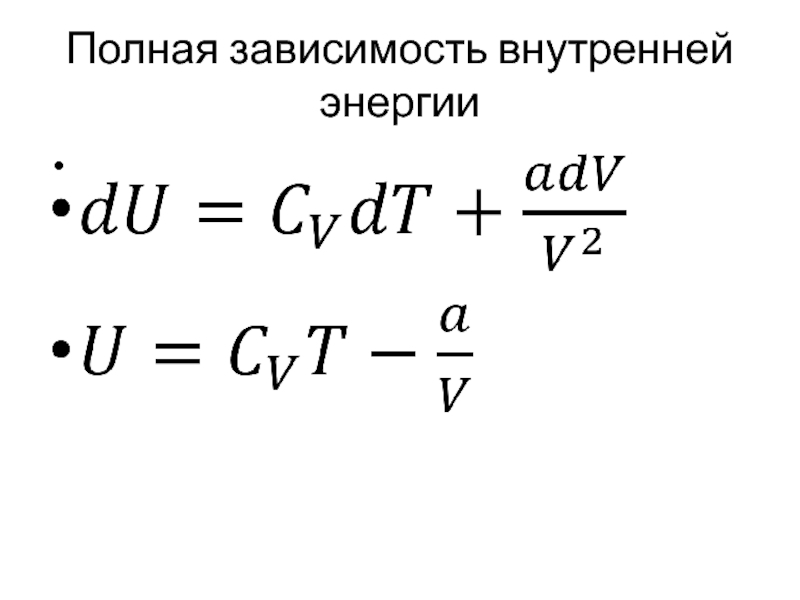- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реальные газы. Уравнение Ван-дер-Ваальса презентация
Содержание
- 1. Реальные газы. Уравнение Ван-дер-Ваальса
- 2. 5. Реальные газы.
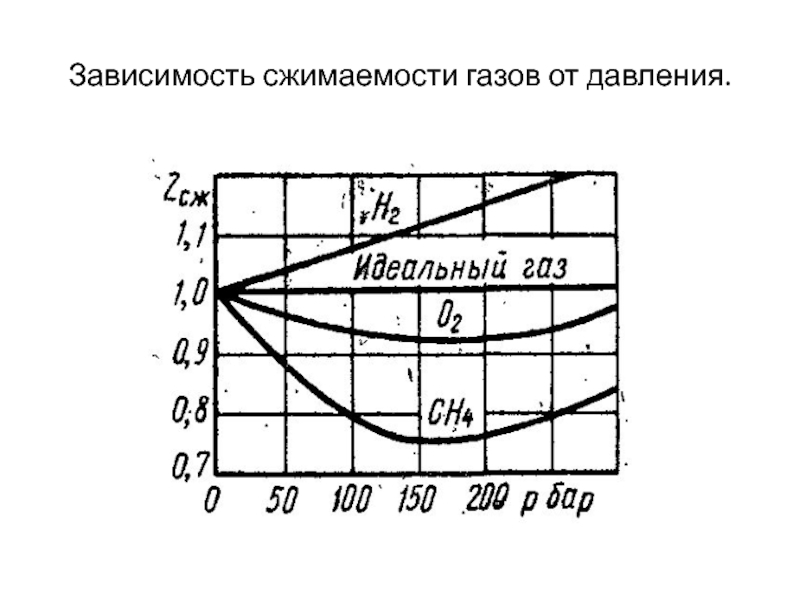
- 3. Зависимость сжимаемости газов от давления.
- 4. 5.2.Уравнение Ван-дер-Ваальса. Уравнение Менделеева-Клапейрона удовлетворительно описывает разряжённые
- 5. Собственный объём молекул.
- 6. Схема.
- 7. Силы взаимодействия.
- 8. Уравнение Ван-дер-Ваальса.
- 9. Уравнение Ван-дер-Ваальса для любого количества вещества.
- 10. Коэффициент сжимаемости.
- 11. Сжимаемость газов по Ван-дер-Ваальсу.
- 12. 5.3.Изотермы Ван-дер-Ваальса. Критические параметры.
- 13. Изотермы Вар-дер-Ваальса. Progr D: Progr E: Progr F: Progr G: Progr H:
- 14. Система уравнений для отыскания Критических параметров.
- 15. Преобразование системы.
- 16. Критический объём.
- 17. Критическая температура.
- 18. Критическое давление.
- 19. Безразмерные параметры.
- 20. Размерные параметры.
- 21. Уравнение Ван-дер-Ваальса с безразмерными параметрами.
- 22. Безразмерное уравнение Ван-дер-Ваальса.
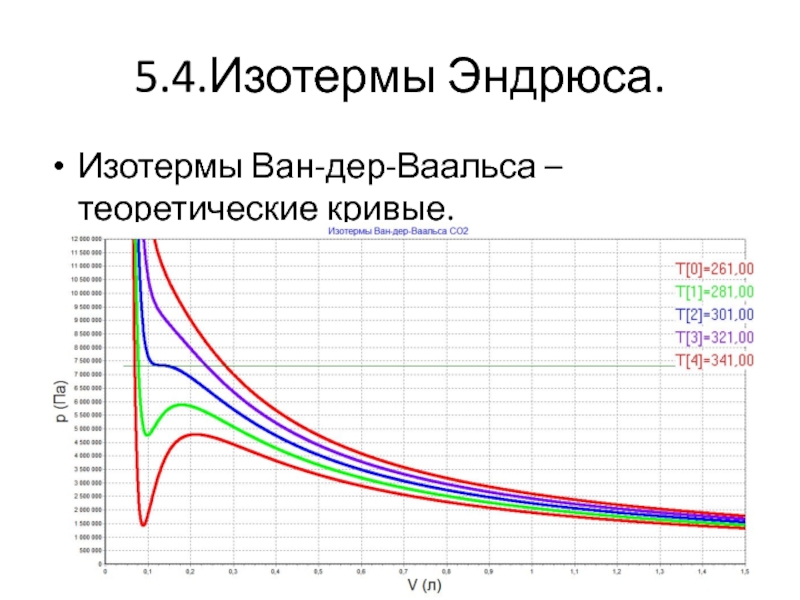
- 23. 5.4.Изотермы Эндрюса. Изотермы Ван-дер-Ваальса – теоретические кривые.
- 24. Эксперименты Марума. Экспериментальные изотермы выглядят иначе. Марум
- 25. Исследование Эндрюса. Английский химик Томас Эндрюс (1813
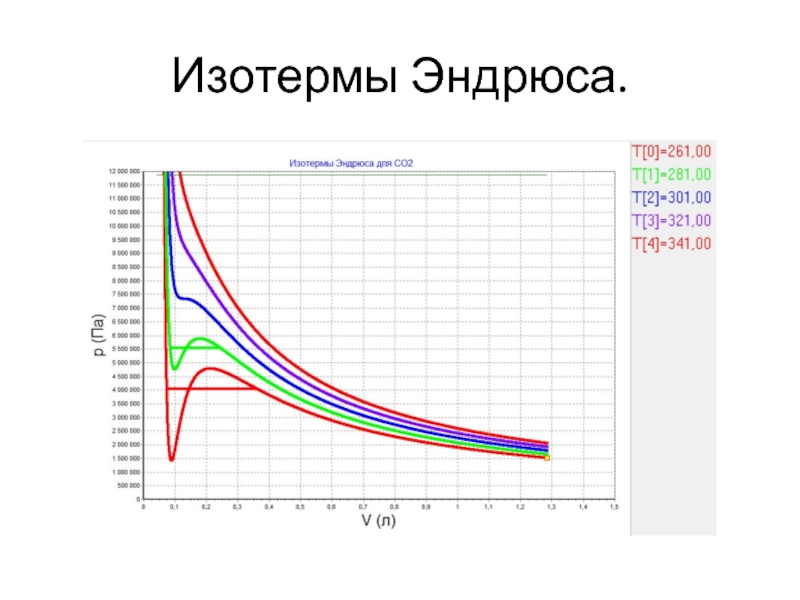
- 26. Изотермы Эндрюса.
- 27. Исследование изотерм Эндрюса. Progr D: Progr E: Progr F: Progr G: Progr H:
- 28. Правило Максвелла.
- 29. Условие сжижения газов. Чтоб сжидить газ его
- 30. Правило рычага. Обозначения.
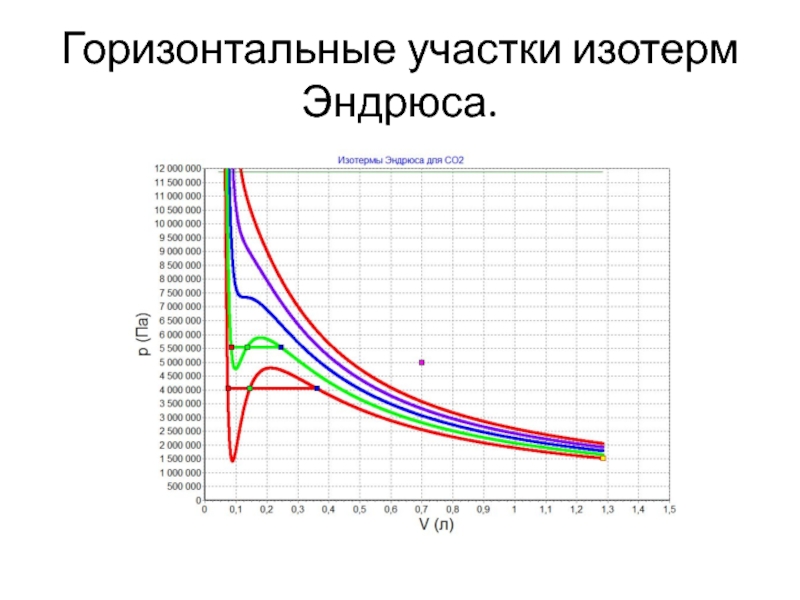
- 31. Горизонтальные участки изотерм Эндрюса.
- 32. Плотности жидкости и газа.
- 33. Правило рычага.
- 34. Отрезки на горизонтальном участке
- 35. Формулировка правила рычага. Таким образом, массы фаз,
- 36. 5.5. Внутренняя энергия газа Ван-дер-Ваальса.
- 37. Зависимость внутренней энергии от температуры.
- 38. Полная зависимость внутренней энергии
- 39. Функции двух переменных
- 40. 5.6.Эффект Джоуля-Томсона. Работы по сжижению газов. Опыты
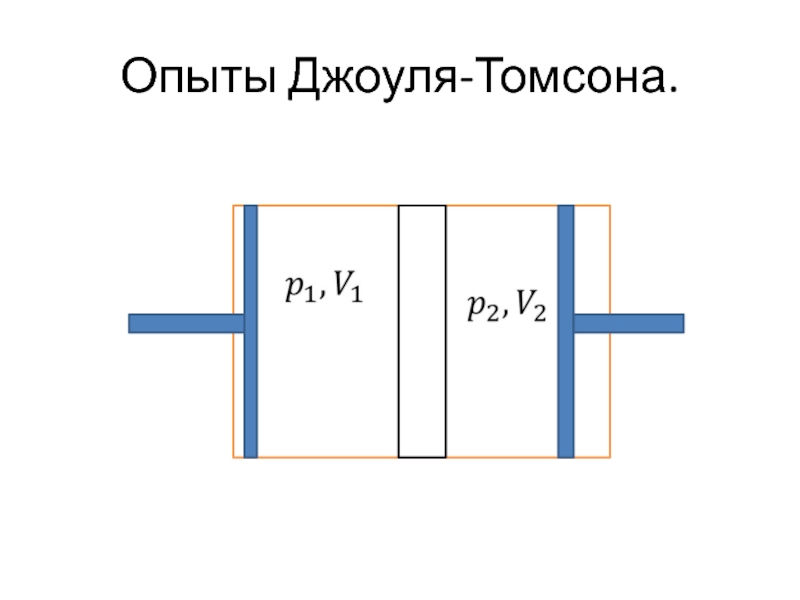
- 41. Опыты Джоуля-Томсона.
- 42. Определение эффекта Джоуля-Томсона. Эффектом Джоуля-Томсона называется явление изменения температуры газа при дросселировании.
- 43. Работа газа и над газом.
- 44. Изменение внутренней энергии.
- 45. Энтальпия.
- 46. Дифференциал энтальпии.
- 47. Производная температуры по давлению.
- 48. Теплоёмкость при постоянном давлении.
- 49. Естественные параметры. Определение. Естественными параметрами некоторой термодинамической
- 50. Для внутренней энергии.
- 51. Дифференциал внутренней энергии.
- 52. Преобразование первого начала термодинамики.
- 53. Дифференциал энтальпии в естественных параметрах.
- 54. Производная энтальпии по давлению
- 55. Формула эффекта Джоуля-Томсона.
- 56. Термодинамический потенциал Гиббса
- 57. Математическая формула дифференциала потенциала Гиббса.
- 58. Выражения для давления и энтропии.
- 59. Общая формула Эффекта Джоуля-Томсона.
- 60. Анализ формулы.
- 61. 5.7.Идеальный и реальный газы.
- 62. Газ Ван-дер-Ваальса
- 63. Производная от объёма по температуре.
- 64. Преобразование формулы.
- 65. Температура инверсии.
- 66. Положительный эффект.
- 67. Отрицательный эффект.
- 68. Отсутствие эффекта
- 69. Эффект Джоуля-Томсона для разряжённых газов.
Слайд 45.2.Уравнение Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона удовлетворительно описывает разряжённые газы.
Это значит, новое уравнение должно
для малых плотностей газов переходить в уравнение Менделеева-Клапейрона.
Уравнение Менделеева-Клапейрона должно быть просто модифицировано.
Уравнение Менделеева-Клапейрона должно быть просто модифицировано.
Слайд 24Эксперименты Марума.
Экспериментальные изотермы выглядят иначе.
Марум обнаружил возможность сжижения газов. При 7
Атм. Давление преставало изменяться.
Слайд 25Исследование Эндрюса.
Английский химик Томас Эндрюс (1813 – 1885) исследовал углекислый газ.
Заметил появление капелек жидкости, которые постепенно разрастались и заполнили весь объём под поршнем.
Слайд 29Условие сжижения газов.
Чтоб сжидить газ его нужно охладить до температуры ниже
критической.
Этим объясняется неудача многих экспериментаторов, старавшихся превратить в жидкость такие газы, как кислород, азот и т.п.
Этим объясняется неудача многих экспериментаторов, старавшихся превратить в жидкость такие газы, как кислород, азот и т.п.
Слайд 35Формулировка правила рычага.
Таким образом, массы фаз, жидкой и газообразной, обратно пропорциональны
величинам отрезков от текущей точки на горизонтальной части изотерм Эндрюса до концов горизонтального отрезка.
Это утверждение и носит название правило рычага, т.к. оно совпадает с условием равновесия рычага, на концах которого подвешены грузы.
Это утверждение и носит название правило рычага, т.к. оно совпадает с условием равновесия рычага, на концах которого подвешены грузы.
Слайд 405.6.Эффект Джоуля-Томсона.
Работы по сжижению газов.
Опыты Джоуля и Томсона по дросселированию.
Определение.
Дросселированием называется
процесс пропускания газа через какое-либо препятствие.
Слайд 42Определение эффекта Джоуля-Томсона.
Эффектом Джоуля-Томсона называется явление изменения температуры газа при дросселировании.
Слайд 49Естественные параметры.
Определение.
Естественными параметрами некоторой термодинамической функции состояния называются параметры, через дифференциалы
которых выражается дифференциал этой функции, исходя из первого начала термодинамики.