- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Распределение газовых молекул по скоростям и энергиям (Тема 2) презентация
Содержание
- 1. Распределение газовых молекул по скоростям и энергиям (Тема 2)
- 2. Тема 2. РАСПРЕДЕЛЕНИЕ ГАЗОВЫХ МОЛЕКУЛ ПО
- 4. 2.1. Скорости газовых молекул. Опыт Штерна
- 5. Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической
- 6. Получена хорошая формула для расчета среднеквадратичной скорости,
- 7. Например, при плотности азота, равной 1,25 кг/м3,
- 8. O. STERN Проверка того факта, что атомы
- 9. Опыт Штерна Схема установки О. Штерна
- 10. Платиновая нить А, покрытая снаружи серебром, располагается
- 11. Опыт Штерна
- 12. Пусть l – расстояние между D и,
- 13. Температура нити в опытах Штерна равнялась 1200°С,
- 14. Ещё в
- 15. 2.2. Вероятность события. Понятие о распределении молекул
- 16. Большое число сталкивающихся атомов и молекул обуславливает
- 17. Математическое определение вероятности: вероятность какого-либо
- 18. По определению Лапласа, вероятность - отношение числа благоприятных случаев к числу возможных случаев.
- 19. Определить распределение молекул по скоростям вовсе не
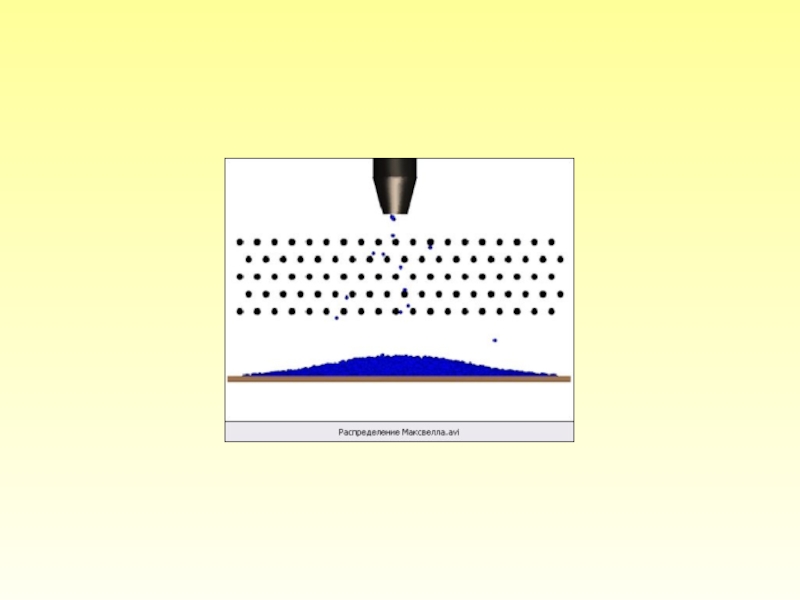
- 20. Итак, молекулы движутся хаотически. Среди них есть
- 22. Нам необходимо знать: сколько молекул обладает скоростями,
- 23. Мы будем искать число
- 24. Ясно так же, что Δn должно быть
- 25. И так,
- 31. Вывод формулы функции распределения молекул по скоростям
- 43. Этот шаровой слой складывается из тех параллелепипедов,
- 44. Отсюда следует закон Максвелла – распределение молекул
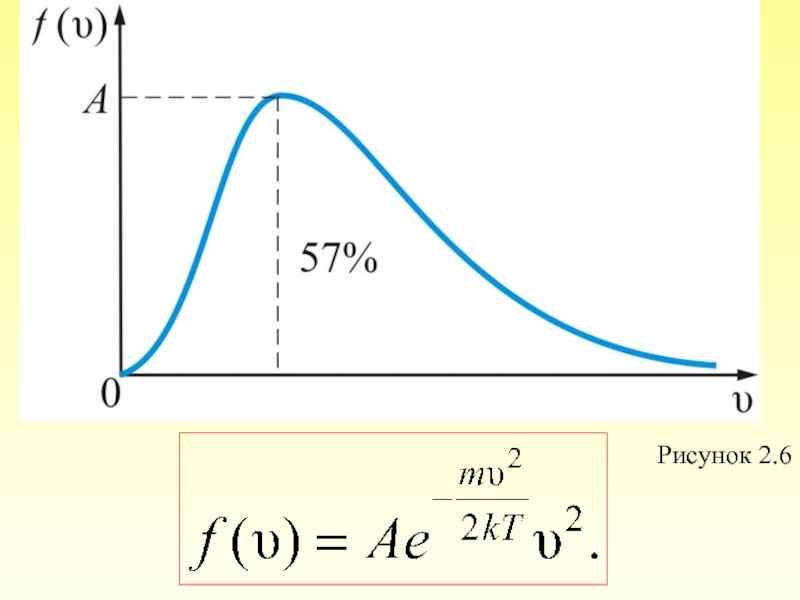
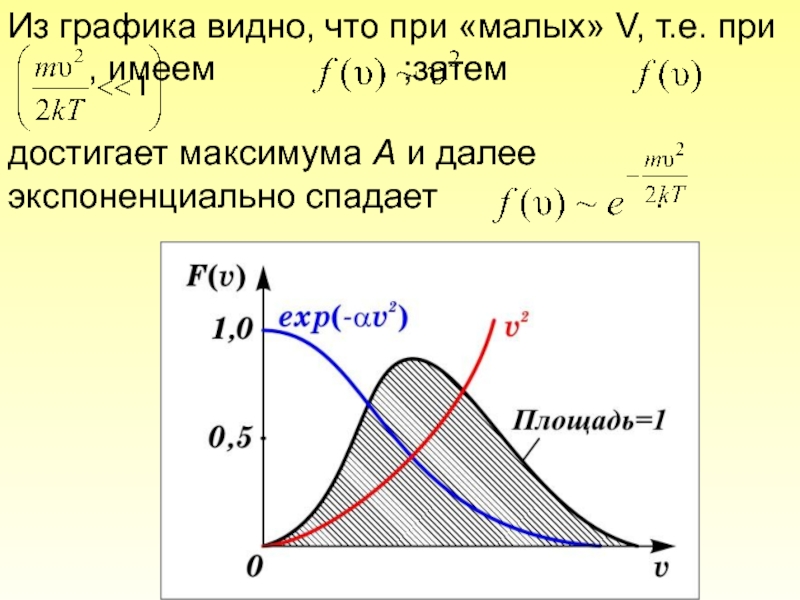
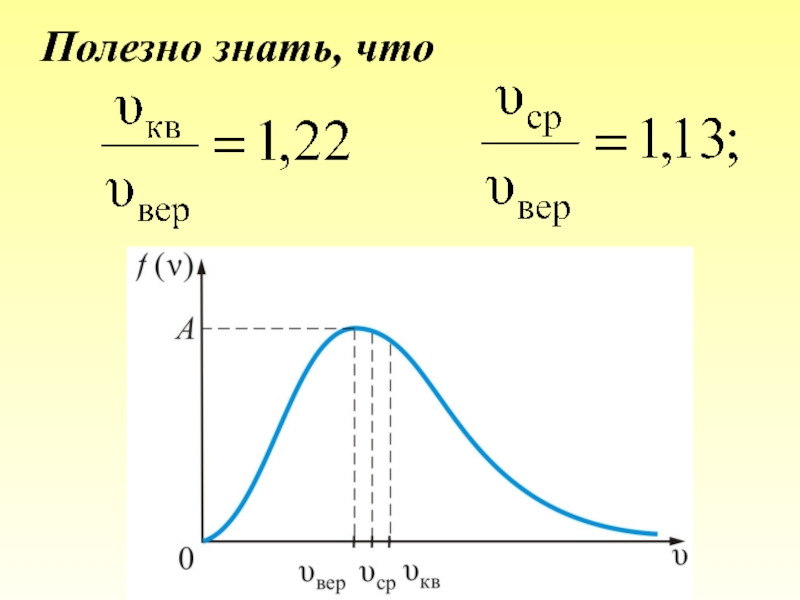
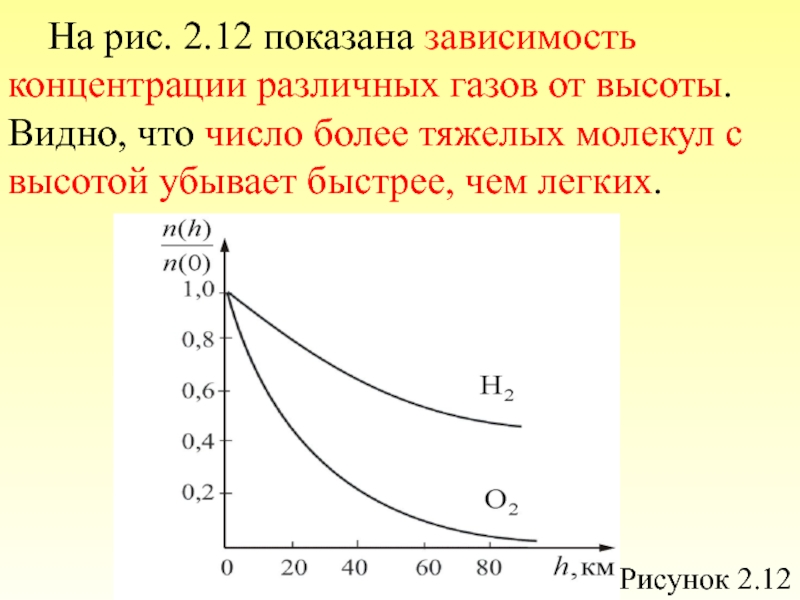
- 55. Из графика видно, что при «малых» V,
Слайд 2Тема 2. РАСПРЕДЕЛЕНИЕ ГАЗОВЫХ МОЛЕКУЛ ПО СКОРОСТЯМ И ЭНЕРГИЯМ
2.1.
2.2. Вероятность события. Понятие о распределении молекул газа по скоростям
2.3. Функция распределения Максвелла
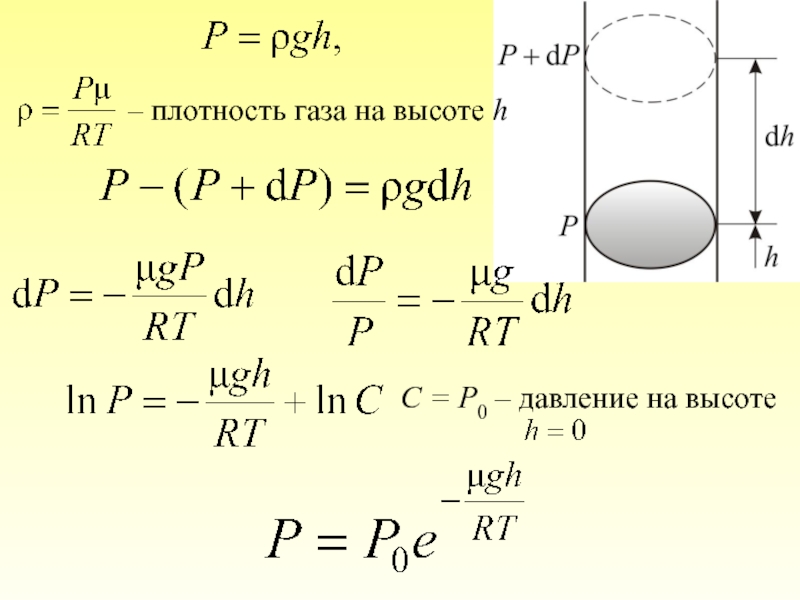
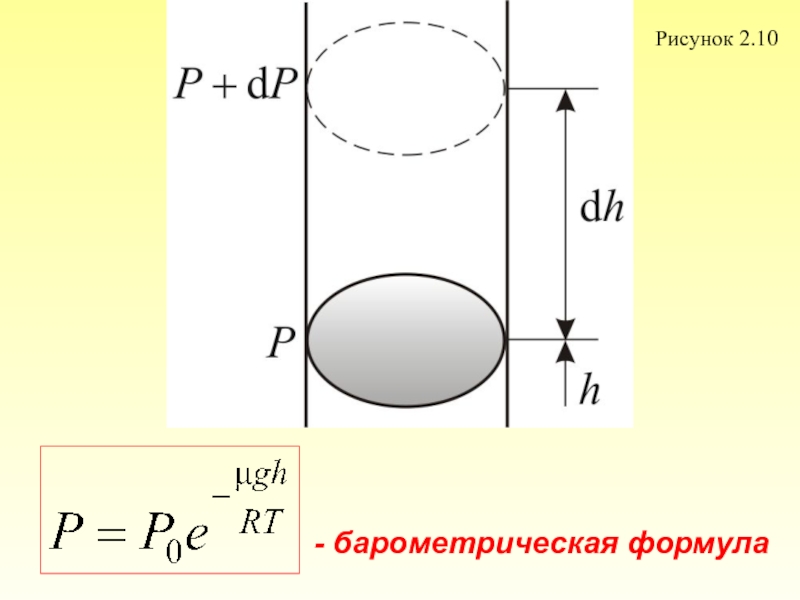
2.4. Барометрическая формула
2.5. Распределение Больцмана
2.6. Закон распределения Максвелла-Больцмана
2.7. Распределение Бозе-Эйнштейна, Ферми-Дирака
Слайд 42.1. Скорости газовых молекул. Опыт Штерна
В средине XIX века была
Слайд 5 Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической теории газов известно, что
Слайд 6 Получена хорошая формула для расчета среднеквадратичной скорости, но масса молекулы неизвестна.
Слайд 7 Например, при плотности азота, равной 1,25 кг/м3, при t = 0°
Слайд 8O. STERN
Проверка того факта, что атомы и молекулы идеальных газов в
Слайд 10 Платиновая нить А, покрытая снаружи серебром, располагается вдоль оси коаксиальных цилиндров
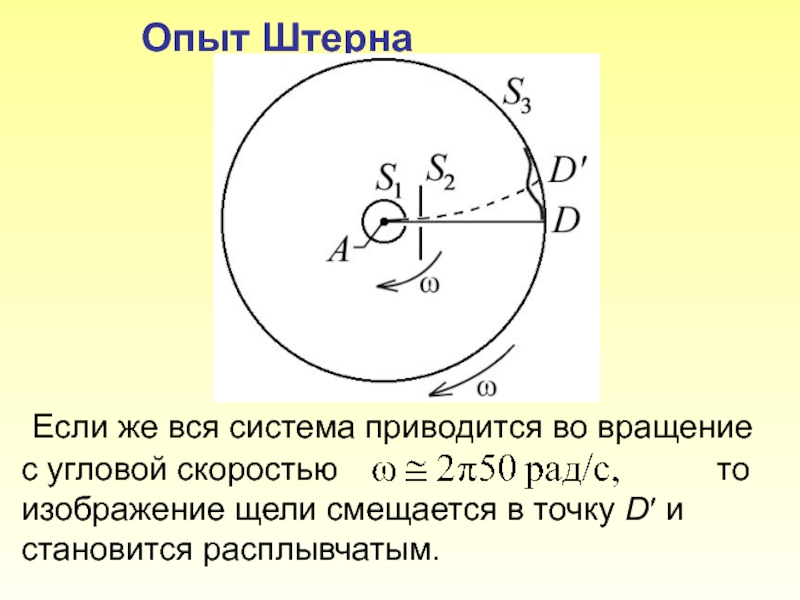
Слайд 11 Опыт Штерна Если же вся система приводится во вращение с
Слайд 12Пусть l – расстояние между D и, измеренное вдоль поверхности цилиндра
Слайд 13 Температура нити в опытах Штерна равнялась 1200°С, что соответствует среднеквадратичной скорости
Слайд 14 Ещё в XIX веке Дж. Максвелл утверждал, что молекулы, беспорядочно сталкиваясь
Таким образом, в этом опыте были не только измерены скорости газовых молекул, но и показано, что они имеют большой разброс по скоростям. Причина – в хаотичности теплового движения молекул.
Слайд 152.2. Вероятность события.
Понятие о распределении молекул газа по скоростям
С
Слайд 16 Большое число сталкивающихся атомов и молекул обуславливает важные закономерности в поведении
Слайд 17 Математическое определение вероятности: вероятность какого-либо события – это предел,
Слайд 18 По определению Лапласа, вероятность - отношение числа благоприятных случаев к
Слайд 19 Определить распределение молекул по скоростям вовсе не значит, что нужно определить
Слайд 20 Итак, молекулы движутся хаотически. Среди них есть и очень быстрые, и
Слайд 22 Нам необходимо знать: сколько молекул обладает скоростями, лежащими в интервале, включаю-щем
Так всегда ставятся статистические задачи.
Например: на переписи населения, когда указывается возраст 18 лет – это не значит, что 18 лет, 0 часов, 0 минут. Эта цифра свидетельствует, что возраст лежит в интервале от 18 до 19 лет.
Слайд 23 Мы будем искать число частиц (Δn) скорости которых
Слайд 24 Ясно так же, что Δn должно быть пропорционально концентрации молекул (n).
Слайд 25 И так,
Слайд 31 Вывод формулы функции распределения молекул по скоростям есть в учебнике Ю.И
Слайд 43 Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше. Объём
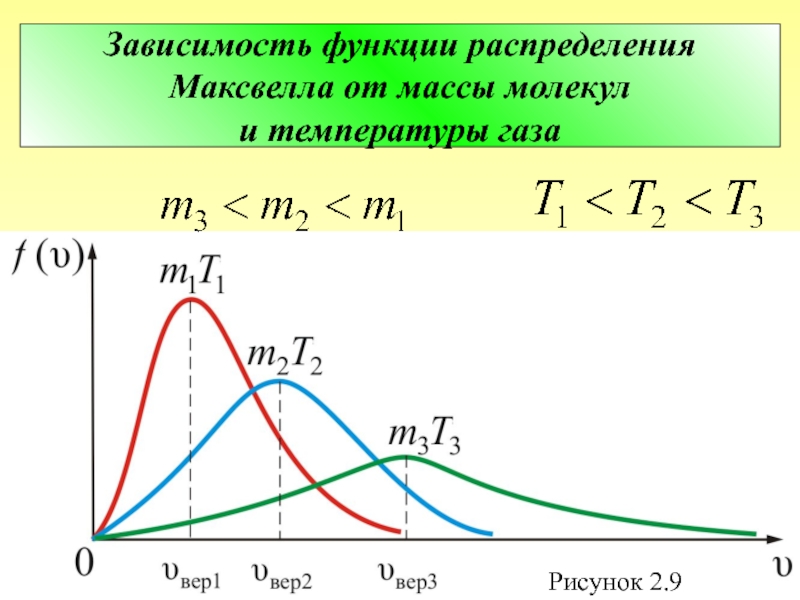
Слайд 44 Отсюда следует закон Максвелла – распределение молекул по абсолютным значениям скоростей: