средств
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств. (Лекция 7) презентация
Содержание
- 1. Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных средств. (Лекция 7)
- 2. План: 1. Элементный анализ. Анализ по
- 3. Метод Кьельдаля H2SO4 (конц.), t0 R-N
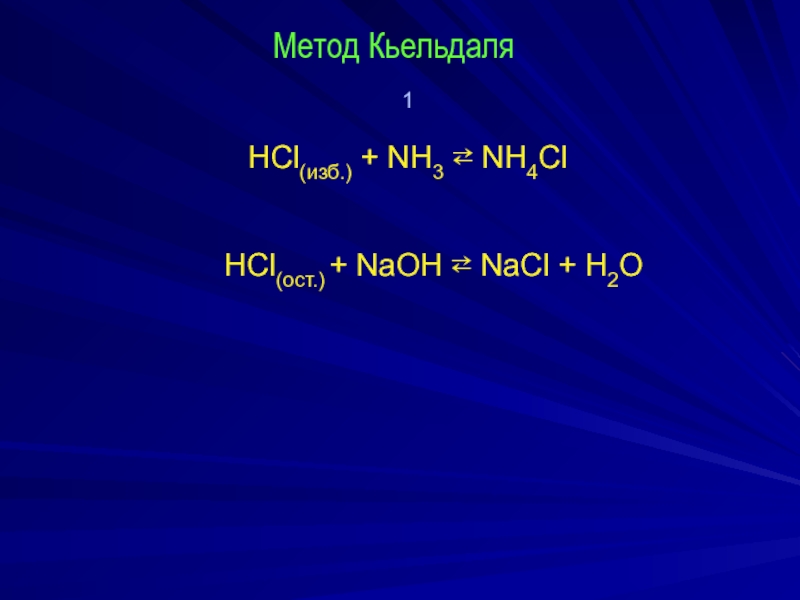
- 4. Метод Кьельдаля 1 HCl(изб.) +
- 5. Метод Кьельдаля 2 НВО2
- 6. NO3- и NO2- определяют после
- 7. Определение серы проводят путем сжигания
- 8. Галогены Хлор-, бромсодержащие органические вещества после
- 9. Определение фунциональных групп органических соединений Вещества, содержащие
- 10. Прямая алкалиметрия Полипротонные кислоты титруют в
- 11. Органические оксикарбоновые кислоты: Глюконовая
- 12. Соли слабых неорганических и органических
- 13. Прямая ацидиметрия щелочи (NaOH, KOH, Ba(OH)2);
- 14. Способы обратного титрования кислот и оснований Определение
- 15. Способ заместительного кислотно-основного титрования Определение оксида ртути(II)
Слайд 1Применение метода кислотно-основного титрования в количественном анализе химических веществ и лекарственных
Слайд 2План:
1. Элементный анализ. Анализ по функциональным группам.
2. Способы прямого титрования
кислот и оснований.
3. Способы обратного титрования кислот и оснований.
4. Способы заместительного титрования.
3. Способы обратного титрования кислот и оснований.
4. Способы заместительного титрования.
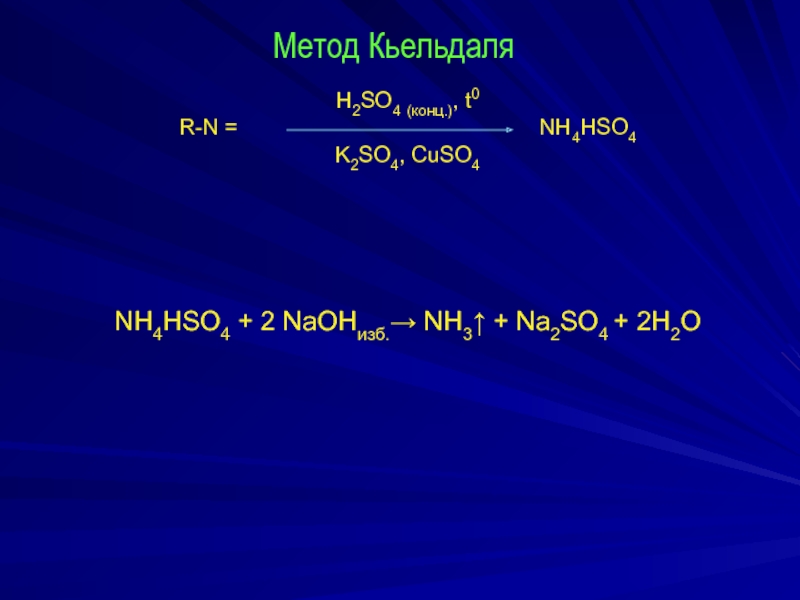
Слайд 3Метод Кьельдаля
H2SO4 (конц.), t0
R-N =
NH4HSO4
K2SO4, CuSO4
NH4HSO4 + 2 NaOHизб.→ NH3↑ + Na2SO4 + 2H2O
K2SO4, CuSO4
NH4HSO4 + 2 NaOHизб.→ NH3↑ + Na2SO4 + 2H2O
Слайд 5Метод Кьельдаля
2
НВО2 + NH3 ⇄ NH4+ + BO2-
рКа Н3ВО3 =
9,24 рКb ВО2- = 4,76
ВО2- + Н3О+ ⇄ НВО2 + Н2О
ВО2- + Н3О+ ⇄ НВО2 + Н2О
Слайд 6NO3- и NO2-
определяют после их восстановления сплавом Арнда
(60% Сu, 40% Mg) в слабокислой или нейтральной среде или сплавом Деварда (50% Сu, 45% Al, 5% Zn) в щелочной среде
3 NO3- + 8 Al + 5 OH- + 18 H2O ⇄ 3 NH3+ 8 [Al(OH)4]-
3 NO3- + 8 Al + 5 OH- + 18 H2O ⇄ 3 NH3+ 8 [Al(OH)4]-
Слайд 7Определение серы
проводят путем сжигания органического соединения в токе кислорода (по
методу Шенигера)
Образующийся при этом диоксид и триоксид серы поглощают раствором Н2О2.
SO2(газ) + H2O2 → H2SO4
Образующийся при этом диоксид и триоксид серы поглощают раствором Н2О2.
SO2(газ) + H2O2 → H2SO4
Слайд 8 Галогены
Хлор-, бромсодержащие органические вещества
после разрушения образуют кислоты:
R-Cl
разрушение HCl(газ)
R-Br разрушение HBr(газ)
HCl(газ) + H2O → Cl- + H3O+
H3O+ титруют NaOH
Ковалентно связанный иод определяют окислительно-восстановительным методом
R-Br разрушение HBr(газ)
HCl(газ) + H2O → Cl- + H3O+
H3O+ титруют NaOH
Ковалентно связанный иод определяют окислительно-восстановительным методом
Слайд 9Определение фунциональных групп органических соединений
Вещества, содержащие карбоксильную (- СООН), сульфогруппу
(- SО3Н), обладающие кислотными свойствами (Ка=10 -5 - 10-8), определяют прямым титрованием с индикатором фенолфталеином.
Алифатические амины имеют Кв~10-5 и их можно титровать кислотой (прямое титрование ).
Ароматические амины (анилин, пиридин и его производные) являются слабыми основаниями с Кв~10-10. Их титруют НClO4 в среде безводной СН3СООН.
Алифатические амины имеют Кв~10-5 и их можно титровать кислотой (прямое титрование ).
Ароматические амины (анилин, пиридин и его производные) являются слабыми основаниями с Кв~10-10. Их титруют НClO4 в среде безводной СН3СООН.
Слайд 10Прямая алкалиметрия
Полипротонные кислоты титруют в соответствии с величинами их Кт.
Щавелевая кислота – H2C2O4 (Ка1=5,6∙10-2, Ка2=5,4∙10-5),
фосфорная – H3PO4 (Ка1=7,1∙10-3, Ка2=6,2∙10-8, Ка3=5,0∙10-13),
мышьяковая H3AsO4 (Ка1=5,6∙10-3, Ка2=1,7∙10-7, Ка3=2,95∙10-12)
титруются как двухпротонные.
Слайд 11
Органические оксикарбоновые кислоты:
Глюконовая (Ка =1,4∙ 10-4) титруется как одноосновная:
CH2OH(CHOH)4COOH +
OH- ⇄ CH2OH(CHOH)4COO- + H2O
Винная (Ка1=1,3∙10-3, Ка2=3,0∙10-5) титруется как двухосновная:
HOOC-(CHOH)2-COOH + 2 OH- ⇄ -OOC-(CHOH)2-COO- +2 H2O
Лимонная (Ка1=7,4∙10-4, Ка2=2,2∙10-5, Ка3=4,0∙10-7, Ка4=1∙10-16) титруется как трехосновная
Винная (Ка1=1,3∙10-3, Ка2=3,0∙10-5) титруется как двухосновная:
HOOC-(CHOH)2-COOH + 2 OH- ⇄ -OOC-(CHOH)2-COO- +2 H2O
Лимонная (Ка1=7,4∙10-4, Ка2=2,2∙10-5, Ка3=4,0∙10-7, Ка4=1∙10-16) титруется как трехосновная
Слайд 12 Соли слабых неорганических и органических азотистых оснований
гидразина-сульфат N2H4
. H2SO4
[H3N-NH3]2+∙SO42- + 2 OH- ⇄ H2N-NH2 + SO42- + 2 H2O
пиридиний перхлорат [C5H6NH]+ClO4-
[H3N-NH3]2+∙SO42- + 2 OH- ⇄ H2N-NH2 + SO42- + 2 H2O
пиридиний перхлорат [C5H6NH]+ClO4-
Слайд 13Прямая ацидиметрия
щелочи (NaOH, KOH, Ba(OH)2);
органические основания с Кв
≥ 5·10-7 (метиламин – CH3NH2, триметиламин – (CH3)3N и др.):
дифенилгуанидин
три-(оксиметил)-аминометан
гексаметилентетрамин (уротропин)
соли слабых и очень слабых кислот (натрия карбонат, натрия гидрокарбонат, натрия дигидрофосфат, натрия гидрофосфат, натрия тетраборат и др.);
анионные основания (натрия салицилат, натрия бензоат и др.)
дифенилгуанидин
три-(оксиметил)-аминометан
гексаметилентетрамин (уротропин)
соли слабых и очень слабых кислот (натрия карбонат, натрия гидрокарбонат, натрия дигидрофосфат, натрия гидрофосфат, натрия тетраборат и др.);
анионные основания (натрия салицилат, натрия бензоат и др.)
Слайд 14Способы обратного титрования кислот и оснований
Определение раствора аммиака
NH3·H2O +
HСl(изб.) ⇄ NH4Cl + 2 H2O
HCl(ост.) + NaOH ⇄ NaCl + H2O
Определение фосфатов магния, кальция и других трудно растворимых солей
Ca3(PO4)2 + 6 HCl(изб.) ⇄ 2 H3PO4 + 3CaCl2
Определение ртути(II) амидохлорида
HgNH2Cl + 4 KI + 2 HCl(изб.) ⇄ K2[HgI4] + NH4Cl + 2 KCl
Определение формальдегида в формалине
6 HCOH + 4 NH4+ + 4OH- ⇄ (CH2)6N4 + 10 H2O
HCl(ост.) + NaOH ⇄ NaCl + H2O
Определение фосфатов магния, кальция и других трудно растворимых солей
Ca3(PO4)2 + 6 HCl(изб.) ⇄ 2 H3PO4 + 3CaCl2
Определение ртути(II) амидохлорида
HgNH2Cl + 4 KI + 2 HCl(изб.) ⇄ K2[HgI4] + NH4Cl + 2 KCl
Определение формальдегида в формалине
6 HCOH + 4 NH4+ + 4OH- ⇄ (CH2)6N4 + 10 H2O
Слайд 15Способ заместительного кислотно-основного титрования
Определение оксида ртути(II)
HgO + 4 I- + H2O
⇄ [HgI4]2- + 2 OH-
OH- + H3O+ ⇄ 2 H2O
OH- + H3O+ ⇄ 2 H2O









![Соли слабых неорганических и органических азотистых оснований гидразина-сульфат N2H4 . H2SO4 [H3N-NH3]2+∙SO42- + 2](/img/tmb/3/253792/83dcb81aea4cc902e0f57c9c5a76437f-800x.jpg)


![Способ заместительного кислотно-основного титрованияОпределение оксида ртути(II)HgO + 4 I- + H2O ⇄ [HgI4]2- + 2](/img/tmb/3/253792/b157d3cc5048053564025acaf0eaebc8-800x.jpg)





