- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Приложения химической термодинамики. Термодинамика фазовых равновесий презентация
Содержание
- 1. Приложения химической термодинамики. Термодинамика фазовых равновесий
- 2. Фазовые равновесия в одно- и многокомпонентных системах
- 3. Система называется гетерогенной, если она состоит
- 4. Если вещество содержится одновременно в разных
- 5. Гетерогенные системы классифицируют по числу компонентов (одно-
- 6. Диаграммы, отражающие фазовый состав системы, называют фазовыми
- 7. 3) Правило фаз Гиббса:
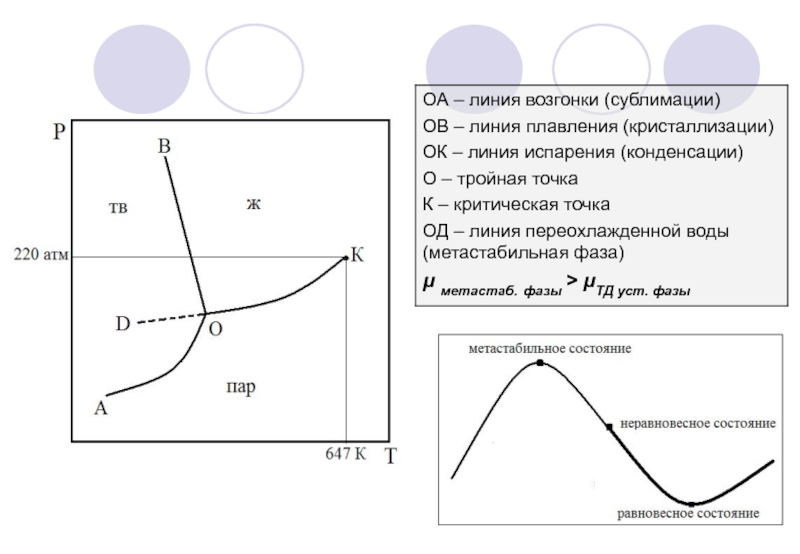
- 8. Однокомпонентные системы. Уравнение Клаузиуса-Клапейрона
- 9. Модельная Р-Т-диаграмма однокомпонентной системы (диаграмма воды)
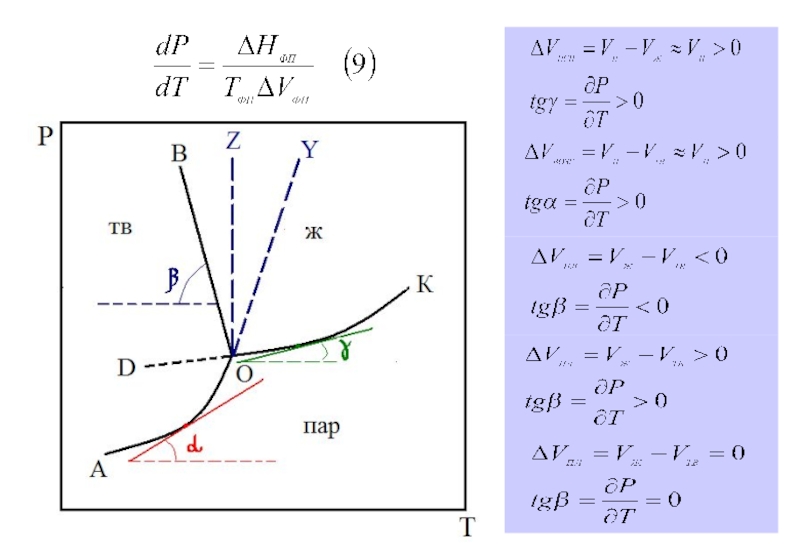
- 12. Вывод и анализ уравнения Клаузиуса-Клапейрона
- 14. Интегрирование уравнения Клаузиуса-Клапейрона
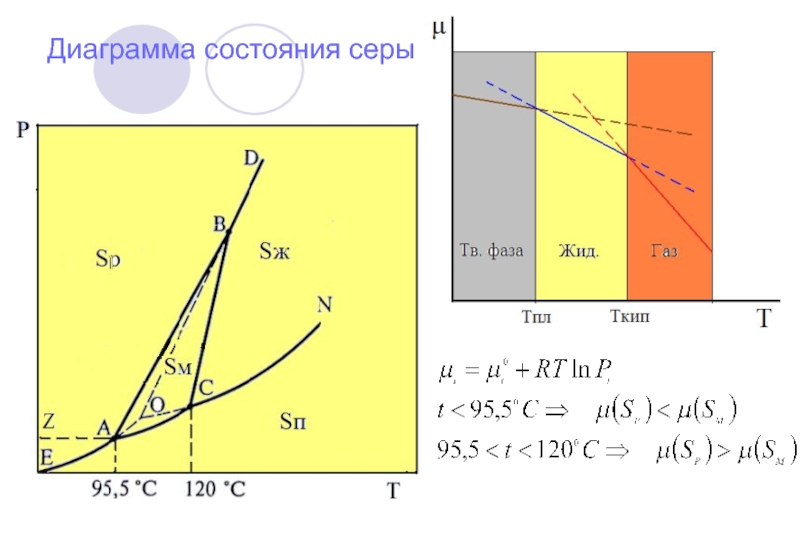
- 16. Диаграмма состояния серы
Слайд 3
Система называется гетерогенной, если она состоит из двух или более фаз.
Фаза
Слайд 4
Если вещество содержится одновременно в разных фазах и происходит его переход
Условие равновесия фаз:
Слайд 5Гетерогенные системы классифицируют по числу компонентов (одно- и многокомпонентные).
Компонентами (составляющими веществами)
Число независимых компонентов (К) – минимальное число компонентов, необходимое для образования каждой из фаз данной системы.
I=K, если между компонентами системы отсутствуют химические взаимодействия.
K = I – r , r – число уравнений, связывающих концентрации компонентов системы.
Слайд 6Диаграммы, отражающие фазовый состав системы, называют фазовыми диаграммами или диаграммами состояния
1) Принцип непрерывности: при непрерывном изменении параметров состояния системы свойства системы в пределах фазы также меняются плавно и непрерывно. При появлении новой фазы или исчезновении старых свойства системы меняются скачкообразно.
2) Принцип геометрического соответствия: на диаграмме состояния каждому фазовому состоянию системы соответствует свой геометрический образ (плоскость, линия, точка).
Слайд 7
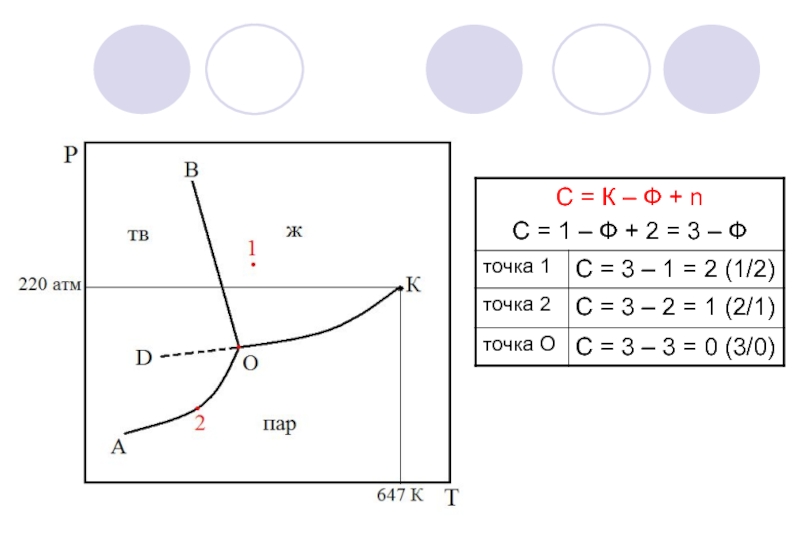
3) Правило фаз Гиббса:
С – число степеней свободы или вариантность системы – это число параметров состояния системы, которые можно одновременно изменить без изменения её фазового состава;
К – число независимых компонентов системы;
Ф – число фаз в данной точке системы;
n – число параметров состояния, характеризующих систему.