- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предмет электрохимии презентация
Содержание
- 1. Предмет электрохимии
- 2. Предмет электрохимии Превращение химической энергии в электрическую
- 3. Электропроводность растворов Удельная электропроводимость Молярная электрическая проводимость Закон Кольрауша Кондуктометрическое титрование
- 4. Проводники электрического тока Первого рода: все
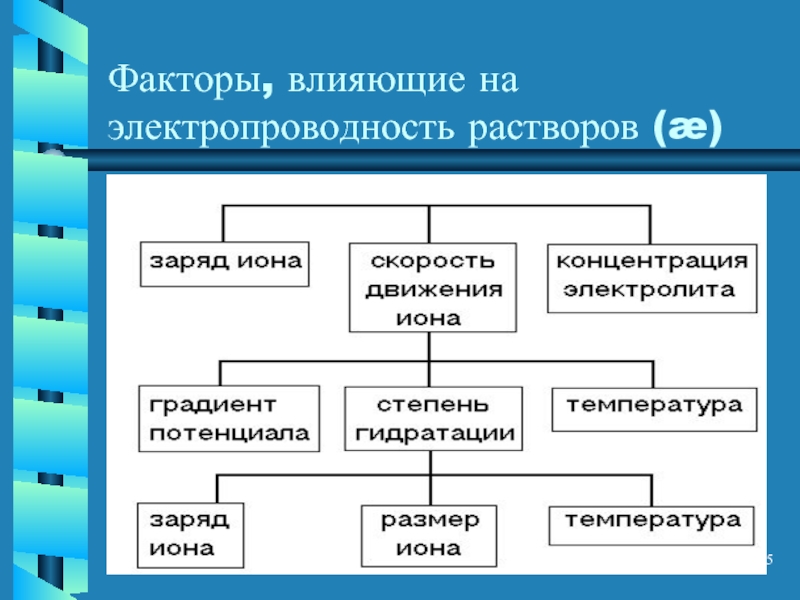
- 5. Факторы, влияющие на электропроводность растворов (æ)
- 6. Заряд иона Чем больше заряд иона и
- 7. Градиент потенциала (напряженность, Е) При небольшой напряженности
- 8. Электрофоретический эффект Торможение носителей поля за счет
- 10. Релаксационный эффект Торможение носителей в связи с
- 12. Температура При увеличении температуры скорость движения ионов
- 13. Степень гидратации Чем больше гидратация иона, тем
- 14. Заряд и размер иона Чем больше заряд
- 15. Температура Чем выше температура, тем меньше степень
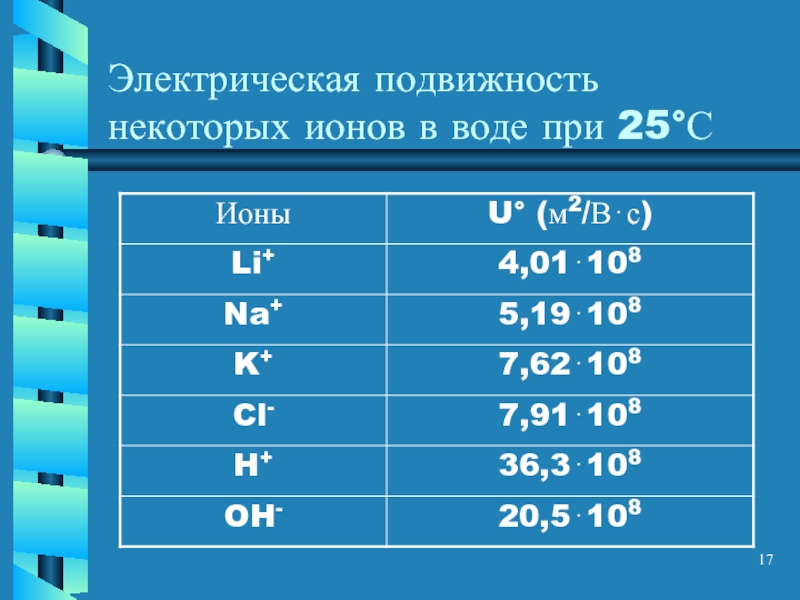
- 16. Электрическая подвижность (U°) Скорость движения иона в
- 17. Электрическая подвижность некоторых ионов в воде при 25°С
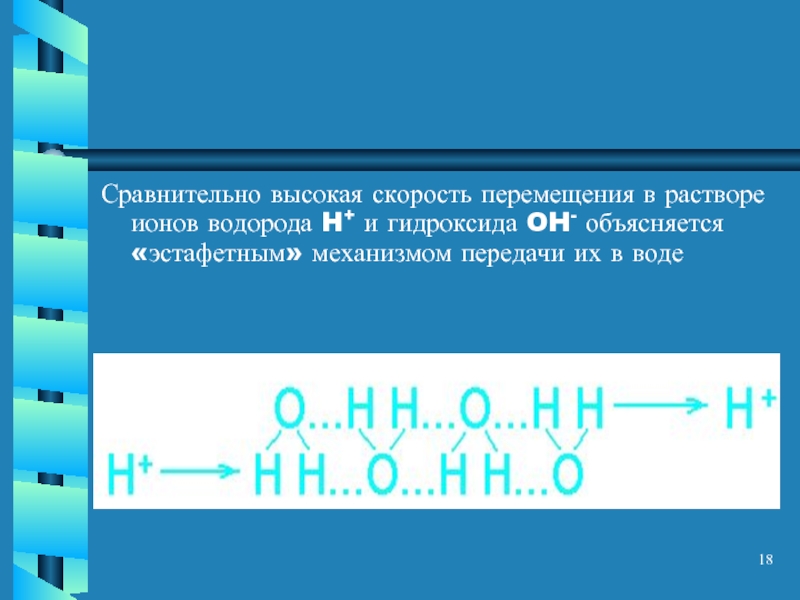
- 18. Сравнительно высокая скорость перемещения в растворе ионов
- 19. Электропроводность Величина обратная сопротивлению проводника тока 1
- 20. Удельная электропроводность(æ) Электропроводность электролита, помещенного между двумя
- 21. Зависимость удельной электропроводности от концентрации раствора Слабые электролиты Сильные электролиты
- 22. Молярная электропроводность (λ) Электропроводность раствора электролита, содержащего
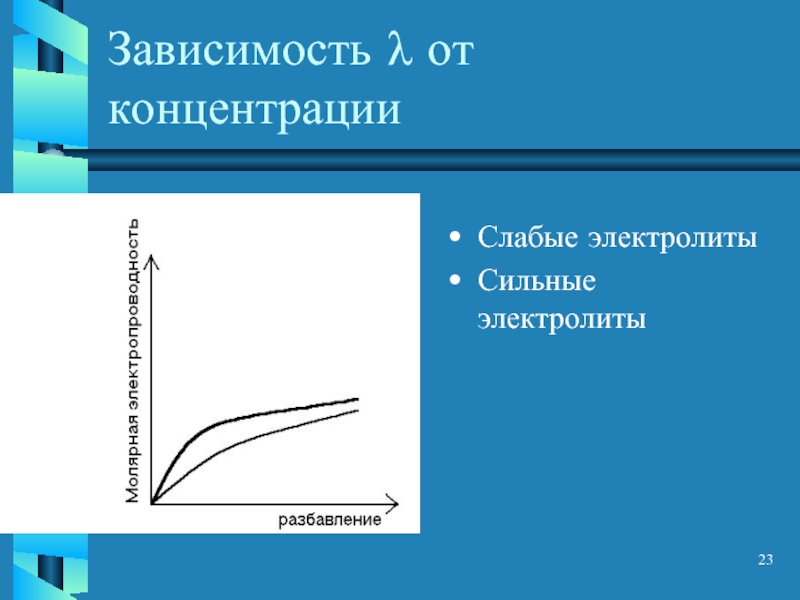
- 23. Зависимость λ от концентрации Слабые электролиты Сильные электролиты
- 24. Связь удельной и молярной электропроводности
- 25. Закон Кольрауша При бесконечном разведении раствора
- 26. Математическое выражение закона λ∞ = lК +
- 27. Практическое значение электропроводности Кондуктометрия – метод анализа,
- 28. Кондуктометрия = λ∞ ⋅ α λ =
- 29. Ионное произведение воды [H+] = C ⋅
- 30. Кондуктометрическое титрование Метод анализа, в котором точка
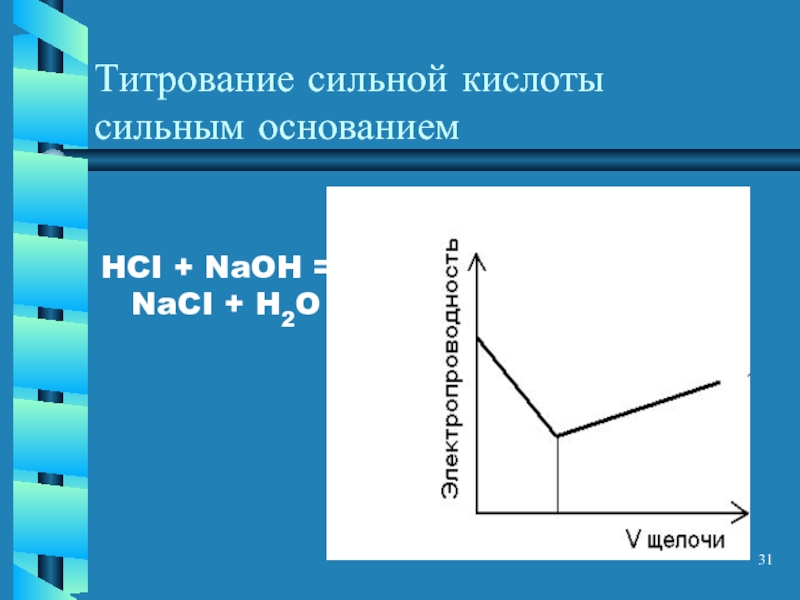
- 31. Титрование сильной кислоты сильным основанием HCI + NaOH = NaCI + H2O
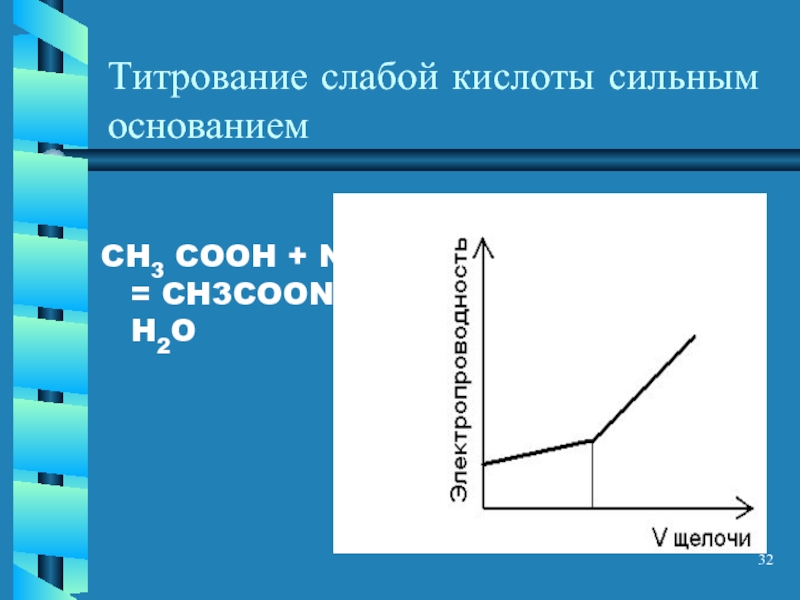
- 32. Титрование слабой кислоты сильным основанием CH3 COOH + NaOH = CH3COONa + H2O
- 33. Зависимость L тканей от частоты переменного тока
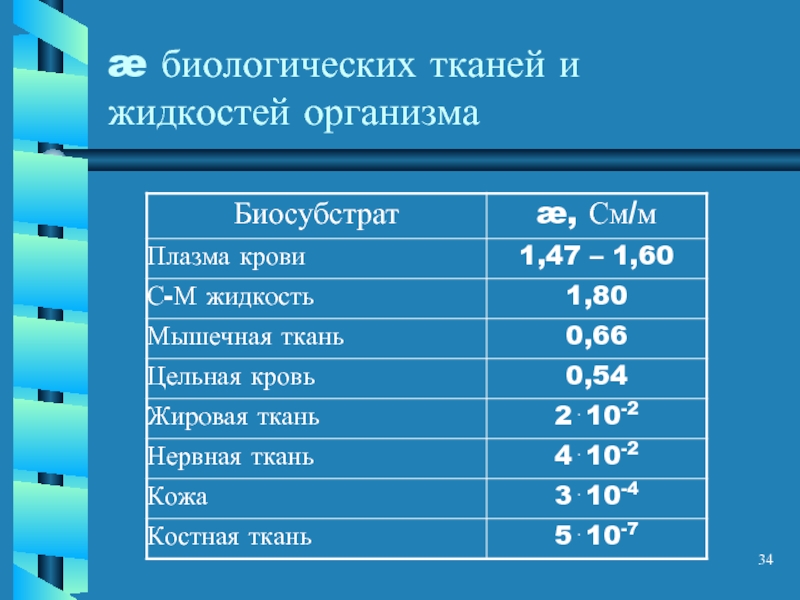
- 34. æ биологических тканей и жидкостей организма
- 35. Значение электропроводности в медицине Использование в диагностике:
Слайд 2Предмет электрохимии
Превращение химической энергии в электрическую
Особенности свойств растворов электролитов
Электропроводность растворов
Процессы электролиза
Работа
Электрохимическая коррозия металлов
Слайд 3Электропроводность растворов
Удельная электропроводимость
Молярная электрическая проводимость
Закон Кольрауша
Кондуктометрическое титрование
Слайд 4Проводники электрического тока
Первого рода:
все металлы, их сплавы, графит
Электронная проводимость
При повышении
Второго рода:
растворы и расплавы электролитов (жидкости и ткани организма)
Ионная проводимость
При повышении температуры электропроводность возрастает
Слайд 6Заряд иона
Чем больше заряд иона и чем больше скорость его перемещения,
Электропроводность металлов в миллион раз > электропроводности растворов
Слайд 7Градиент потенциала (напряженность, Е)
При небольшой напряженности электрического поля æ постоянна
Начиная с
æ достигает максимума при Е = 106 В/см
Для слабых электролитов это объясняется увеличением α,
для сильных – ослаблением релаксационного и электрофоретического эффектов
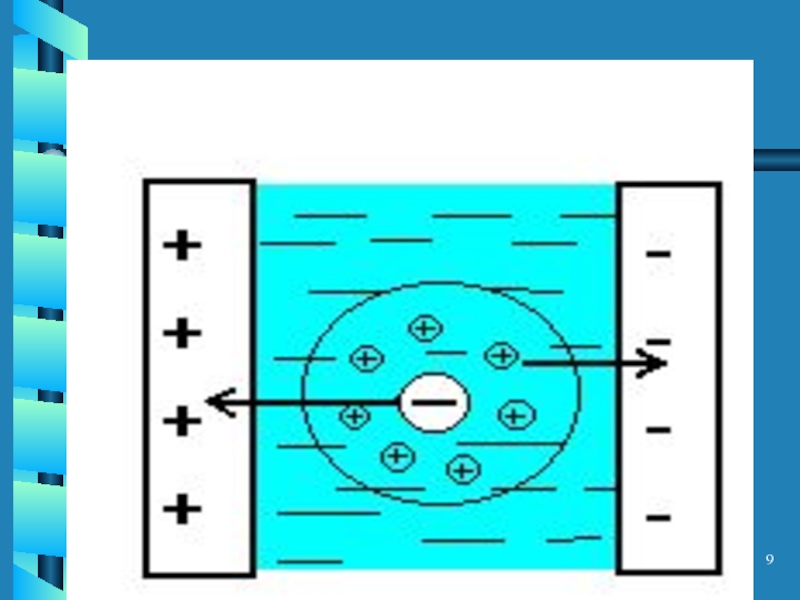
Слайд 8Электрофоретический эффект
Торможение носителей поля за счет того, что ионы противоположного знака
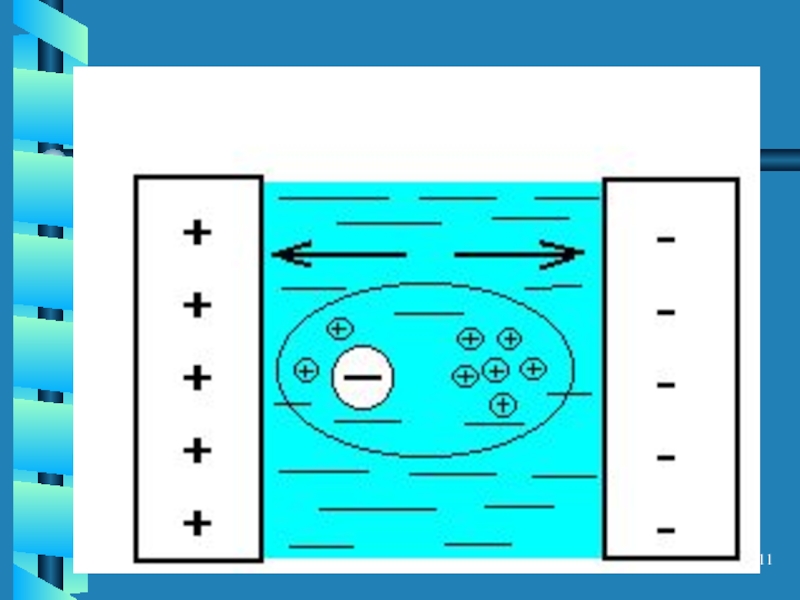
Слайд 10Релаксационный эффект
Торможение носителей в связи с тем, что ионы при движении
Слайд 12Температура
При увеличении температуры скорость движения ионов возрастает
Температура усиливает тепловое движение и
Увеличение температуры на 1°С увеличивает скорость движения ионов ≈ на 2%
Слайд 13Степень гидратации
Чем больше гидратация иона, тем меньше его скорость
Ион в растворе
Слайд 14Заряд и размер иона
Чем больше заряд иона, тем больше степень гидратации
Чем
Скорость движения ионов
K+ > Ba2+ > Mg2+ > Na+
Слайд 15Температура
Чем выше температура, тем меньше степень гидратации
Частичная дегидратация ионов в результате
Слайд 16Электрическая подвижность (U°)
Скорость движения иона в растворе при бесконечном разведении и
Слайд 18Сравнительно высокая скорость перемещения в растворе ионов водорода H+ и гидроксида
Слайд 19Электропроводность
Величина обратная сопротивлению проводника тока
1
L = ------- (Ом-1)
R
l
R = ρ ------
1 S
L = --- ⋅ -----
ρ l
R – сопротивление
L – электропровод
ность
– удельное сопротивление
1
--- – удельная
ρ электропровод
ность (æ - каппа)
Единицы измерения
Ом-1⋅м-1 или См/м
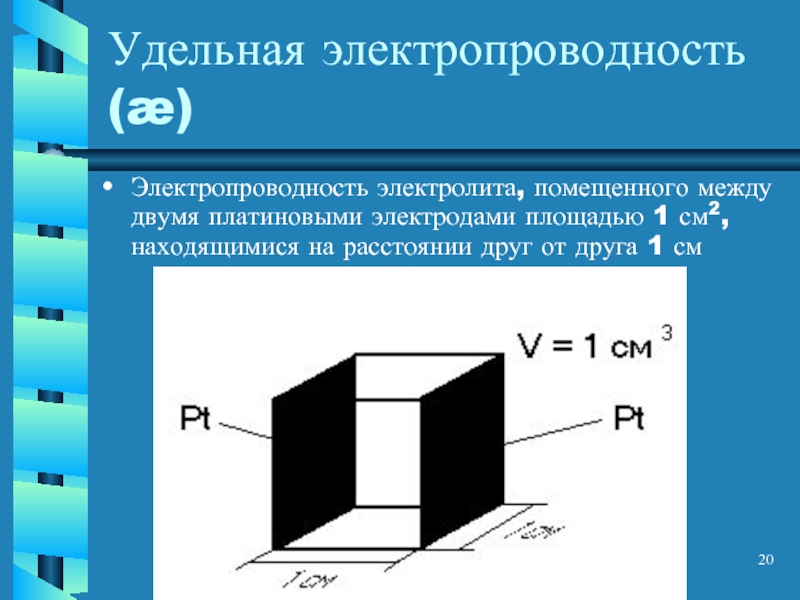
Слайд 20Удельная электропроводность(æ)
Электропроводность электролита, помещенного между двумя платиновыми электродами площадью 1 см2,
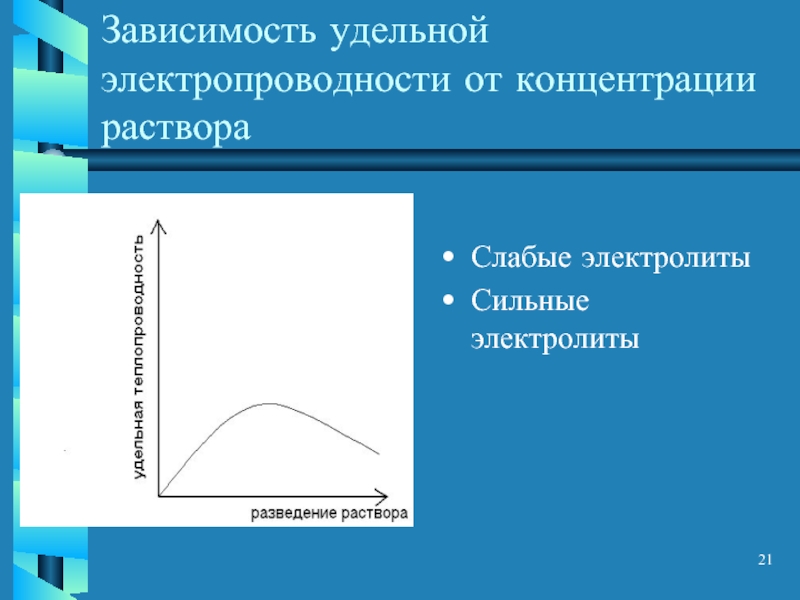
Слайд 21Зависимость удельной электропроводности от концентрации раствора
Слабые электролиты
Сильные электролиты
Слайд 22Молярная электропроводность (λ)
Электропроводность раствора электролита, содержащего 1 моль эквивалента электролита, помещенного
Единицы измерения:
(См⋅м2)/моль или (Ом-1⋅м2) /моль
Слайд 24Связь удельной и молярной электропроводности
1000⋅æ
= æ⋅1000⋅V(л) =
С
æ
λ = ----------- (м)
1000⋅С
Слайд 25Закон Кольрауша
При бесконечном разведении раствора электролита катионы и анионы проводят электрический
Слайд 26Математическое выражение закона
λ∞ = lК + lА ,
lА = U°А ⋅ F
Предельная молярная электропроводность (λ∞, электропроводность при бесконечном разведении) равна сумме предельных подвижностей катиона и аниона
Слайд 27Практическое значение электропроводности
Кондуктометрия – метод анализа, основанный на определении электропроводности жидких
Измерение степени и константы диссоциации слабых электролитов
Концентрации кислот или щелочей (кондуктометрическое титрование)
Растворимости труднорастворимых солей сильных электролитов
Ионного произведения воды
Слайд 28Кондуктометрия
= λ∞ ⋅ α
λ
= -----
λ∞
λ∞ = lК + lА
α2⋅С
КД
1 - α
Для труднораствори мой соли
= λ∞
1000 ⋅ æ
λ∞ = ---------------
С
1000 ⋅ æ
С = ----------------
λ∞
Слайд 29Ионное произведение воды
[H+] = C ⋅ α
1000
C = --------- = 55,5
18
λ
= ----- ; λ = æ ⋅ V
λ∞
55,5 ⋅ 5,5 ⋅ 10-8 ⋅ 18
[H+] = ------------------------------- = 1 ⋅ 10-7
489
[H+][OH-] = 10-7 ⋅ 10-7 = 10-14
Слайд 30Кондуктометрическое титрование
Метод анализа, в котором точка эквивалентности определяется по изменению электропроводности
Подвижность ионов H+ и OH- значительно выше, чем других катионов и анионов
При равных концентрациях электропроводность растворов сильных кислот или сильных оснований > электропроводности их солей
При равных концентрациях электропроводность раствора слабой кислоты < электропроводности раствора ее соли
Слайд 33Зависимость L тканей от частоты переменного тока
В норме:
С увеличением частоты переменного
При патологии (воспаление, отёк):
Зависимость от частоты отличается от нормы
При гибели клетки электропроводность не зависит от частоты переменного тока




















![Ионное произведение воды[H+] = C ⋅ α 1000C = --------- = 55,5 моль/л 18 λ= ----- ;](/img/tmb/2/188215/5946c4b955ddf74a4d4e93e3637749e5-800x.jpg)