- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Поверхностное натяжение. Поверхности раздела фаз презентация
Содержание
- 1. Поверхностное натяжение. Поверхности раздела фаз
- 2. Поверхности раздела фаз – слой, толщиной от
- 3. 1. Поверхность раздела фаз и ее количественные
- 4. 1. Поверхность раздела фаз и ее количественные
- 5. 1. Поверхность раздела фаз и ее количественные
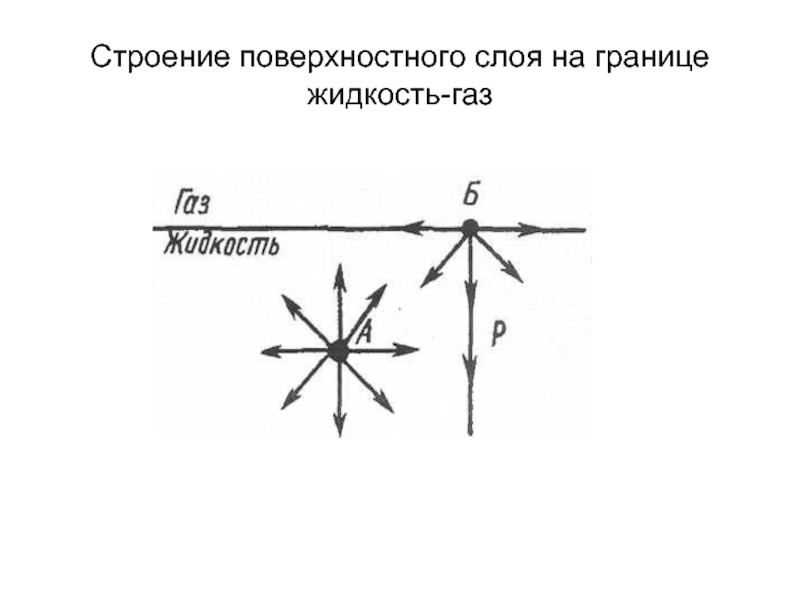
- 6. Строение поверхностного слоя на границе жидкость-газ
- 7. 1. Поверхность раздела фаз и ее количественные
- 8. 1. Поверхность раздела фаз и ее количественные
- 9. 1. Поверхность раздела фаз и ее количественные
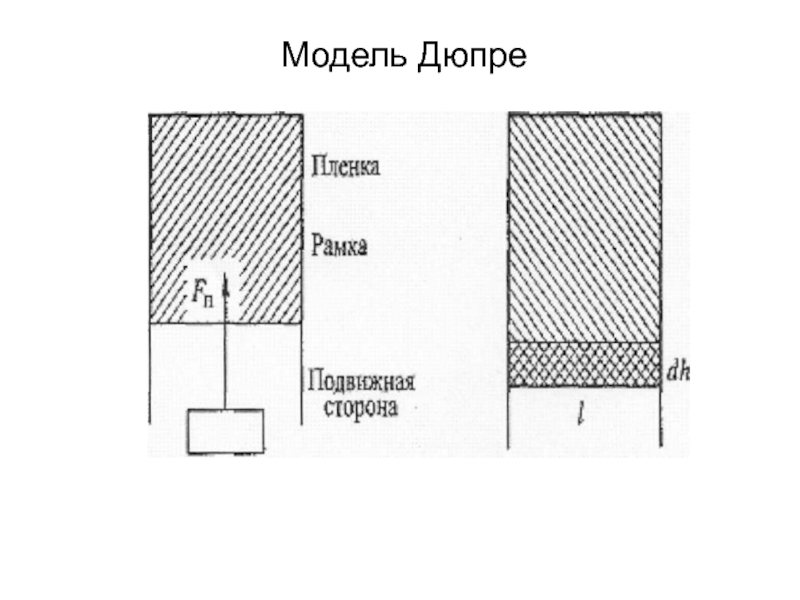
- 10. Модель Дюпре
- 11. 1. Поверхность раздела фаз и ее количественные
- 12. 1. Поверхность раздела фаз и ее количественные
- 13. 1. Поверхность раздела фаз и ее количественные
- 14. 1. Поверхность раздела фаз и ее количественные
- 15. 2. Зависимость поверхностного натяжения от температуры, природы
- 16. 2. Зависимость поверхностного натяжения от температуры, природы
- 17. 2. Зависимость поверхностного натяжения от температуры, природы
- 18. 2. Зависимость поверхностного натяжения от температуры, природы
- 19. 2. Зависимость поверхностного натяжения от температуры, природы
- 20. 2. Зависимость поверхностного натяжения от температуры, природы
- 21. 2. Зависимость поверхностного натяжения от температуры, природы
- 22. Зависимость поверхностного натяжения от разности полярностей фаз в системе жидкость-жидкость
- 23. 2. Зависимость поверхностного натяжения от температуры, природы
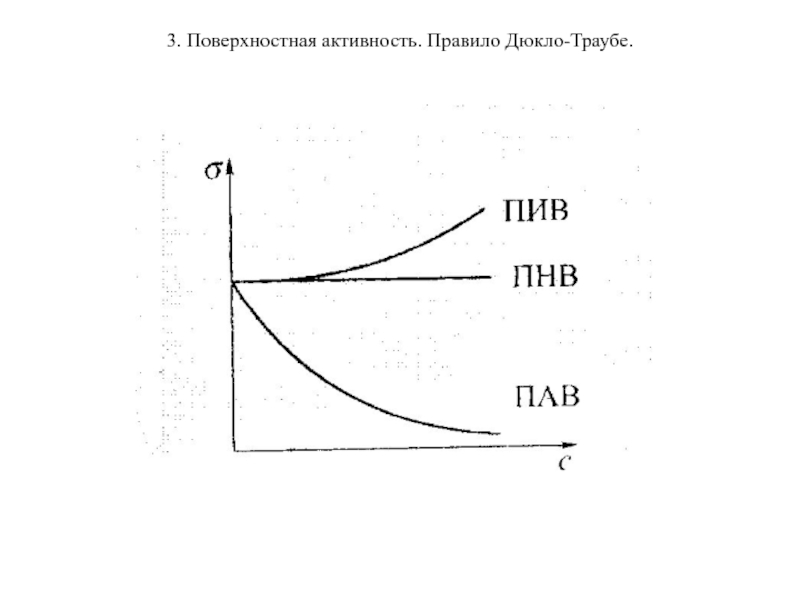
- 24. 3. Поверхностная активность. Правило Дюкло-Траубе. Способность растворенных
- 25. 3. Поверхностная активность. Правило Дюкло-Траубе Для водных
- 26. 3. Поверхностная активность. Правило Дюкло-Траубе. ПНВ, поверхностно
- 27. 3. Поверхностная активность. Правило Дюкло-Траубе.
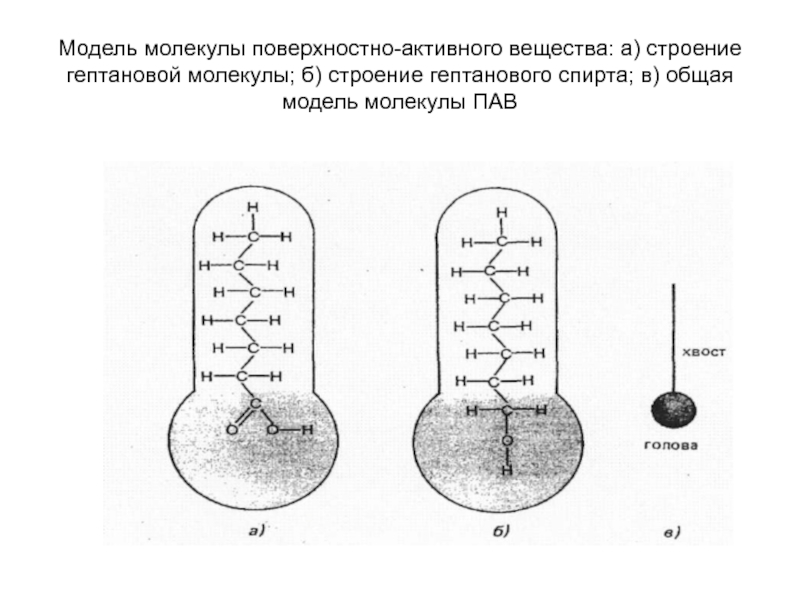
- 28. Модель молекулы поверхностно-активного вещества: а) строение гептановой
- 29. 3. Поверхностная активность. Правило Дюкло-Траубе. К ПАВ
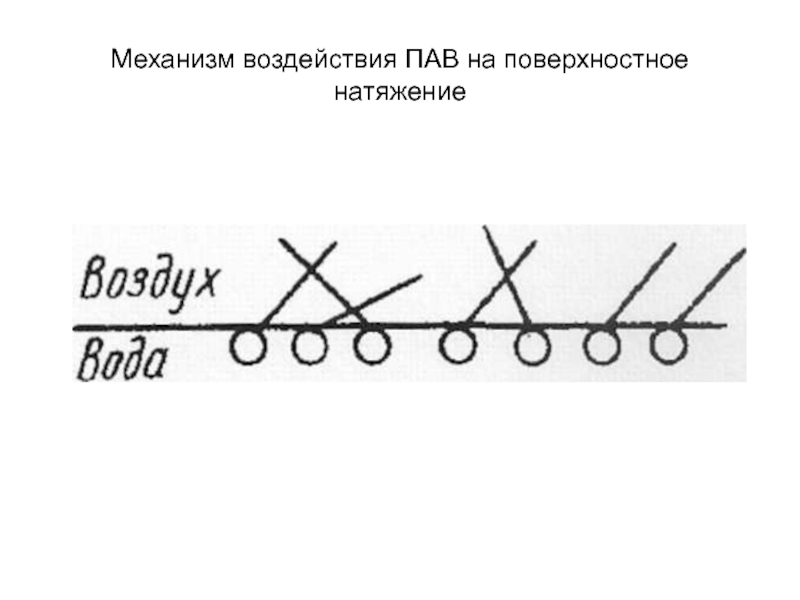
- 30. 3. Поверхностная активность. Правило Дюкло-Траубе. Механизм воздействия
- 31. Механизм воздействия ПАВ на поверхностное натяжение
- 32. 3. Поверхностная активность. Правило Дюкло-Траубе. Механизм воздействия
- 33. 3. Поверхностная активность. Правило Дюкло-Траубе. Правило
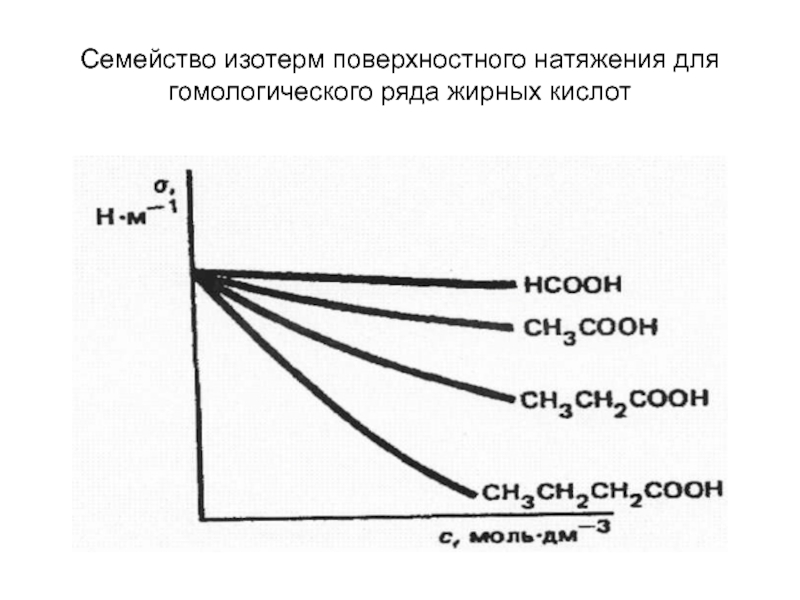
- 34. Семейство изотерм поверхностного натяжения для гомологического ряда жирных кислот
- 35. 4. Смачивание Смачивание - разновидность
- 36. Иммерсионное смачивание. Количественной характеристикой смачивания является теплота
- 37. 4. Смачивание Контактное смачивание. В этом варианте
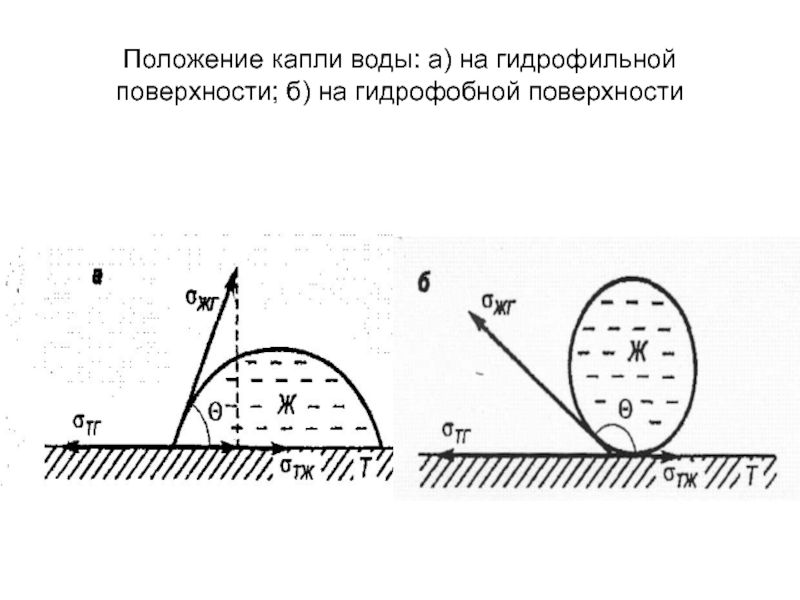
- 38. Положение капли воды: а) на гидрофильной поверхности; б) на гидрофобной поверхности
- 39. Количественной мерой процесса смачивания может служить угол,
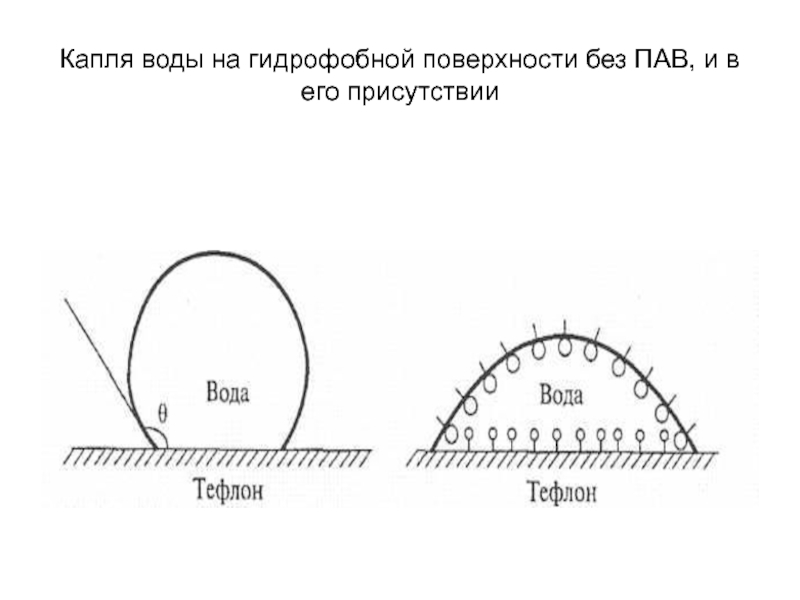
- 40. Капля воды на гидрофобной поверхности без ПАВ, и в его присутствии
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 1. Поверхностное натяжение
1. Поверхность раздела фаз
2. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных веществ.
3. Поверхностная активность. Правило Дюкло- Траубе.
4. Смачивание: иммерсионное, контактное. Количественные характеристики смачивания.
Слайд 2Поверхности раздела фаз – слой, толщиной от одного до нескольких молекулярных
1. Поверхность раздела фаз и ее количественные характеристики
Слайд 31. Поверхность раздела фаз и ее количественные характеристики
Поверхность раздела фаз характеризуется
Удельная поверхность фазы Sуд
Свободная поверхностная энергия Gs
Поверхностное натяжение σ
Слайд 41. Поверхность раздела фаз и ее количественные характеристики
Удельная поверхность фазы Sуд
Sуд = S / V или Sуд = S / m
[м2/м3 = 1/м или м2/кг]
Она зависит от кривизны поверхности и дисперсности фаз.
Слайд 51. Поверхность раздела фаз и ее количественные характеристики
2. Свободная поверхностная энергия.
Каждая молекула на поверхности раздела фаз обладает большей энергий по сравнению с «глубинными» молекулами.
Слайд 71. Поверхность раздела фаз и ее количественные характеристики
Работа против внутреннего давления,
Слайд 81. Поверхность раздела фаз и ее количественные характеристики
3. Поверхностное натяжение σ:
σ — коэффициент пропорциональности, назван поверхностным натяжением. Его физический смысл: при S = 1м2 , σ =Gs, это энергия переноса молекул из объема тела на поверхность. Энергетической единицей σ является Дж/м2
Слайд 91. Поверхность раздела фаз и ее количественные характеристики
Поверхностное натяжение σ: силовое
В данном случае исходят из модели Дюпре, которая представляет собой проволочную рамку с мыльной пленкой.
Слайд 111. Поверхность раздела фаз и ее количественные характеристики
Нижняя сторона рамки подвижная,
σ = Fп/2l [σ] = Н/м = Дж/м2
Слайд 121. Поверхность раздела фаз и ее количественные характеристики
На практике поверхностное натяжение
Слайд 131. Поверхность раздела фаз и ее количественные характеристики
Поверхностные явления - процессы,
Физические, связанные с изменением формы поверхностей раздела фаз dσ = 0, следовательно dGs = dS. К ним относят капиллярные явления, смачивание, прилипание и т.д.
Химические, связанные с изменением химического состава поверхностного слоя dS = 0, следовательно dGs = dσ. К ним относят сорбционные явления.
Слайд 141. Поверхность раздела фаз и ее количественные характеристики
Значение поверхностных явлений для
Многие процессы фарм. технологии - испарение, сублимация и конденсация, адсорбция, гетерогенный катализ, химические реакции на границе раздела фаз протекают на границе раздела фаз.
Большинство лекарственных форм являются дисперсными системами с большой поверхностью: порошки, таблетки, эмульсии, суспензии, мази и т. д. Вопросы рациональной технологии, стабилизации, хранения, повышения эффективности терапевтического действия лекарств неразрывно связаны исследованиями поверхностных явлений.
Слайд 152. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
Поверхностное натяжение (и поверхностная энергия) зависит от:
температуры
природы граничащих сред
концентрации растворенных веществ
Слайд 162. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
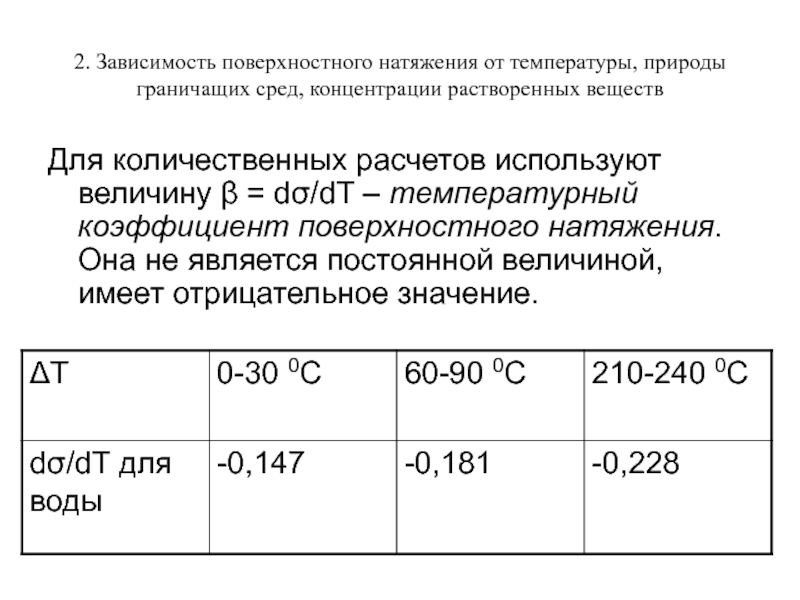
1. Влияние температуры на поверхностное натяжение. С повышением температуры поверхностное натяжение уменьшается, т.к. среднее расстояние между молекулами увеличивается и потому ослабляются силы, действующие между молекулами. Температура, при которой поверхностное натяжение обращается в ноль, называется критической. При этом исчезает различие между двумя агрегатными состояниями вещества. При температурах, далеких от критической, как показали эксперименты, зависимость близка к линейной.
Слайд 172. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
Для количественных расчетов используют величину β = dσ/dT – температурный коэффициент поверхностного натяжения. Она не является постоянной величиной, имеет отрицательное значение.
Слайд 182. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
Для упрощенных вычислений обычно используют среднее значение β на достаточно широком интервале. Вдали от критической температуры для многих однокомпонентных неассоциированных жидкостей зависимость имеет вид:
σ = σ0 + β(Т – Т0), где σ и σ0 – поверхностное натяжение при температуре Т и Т0 соответственно.
Слайд 192. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
2. Влияние на поверхностное натяжение природы фазообразующих веществ.
Термином «полярность» П обозначают интенсивность молекулярных сил сцепления вещества, которая в основном определяется моментом диполя, поляризуемостью и диэлектрической проницаемостью вещества.
Зависимость поверхностного натяжения от полярности жидкой фазы в системе жидкость – газ определяется природой жидкости.
Слайд 202. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
П
1
2
Поверхностное натяжение
1- жидкости неорганической природы и органические жидкости с симметричными
молекулами (ртуть, вода, бензол, тетрахлорид углерода);
2 – органические жидкости с асимметричными
молекулами (спирты, амины, кетоны).
Слайд 212. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
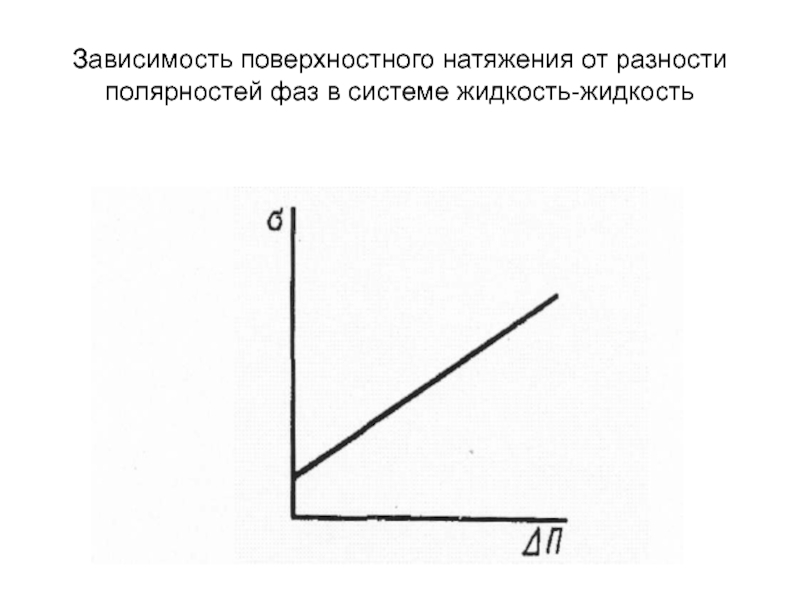
П. А. Ребиндером было показано, что поверхностное натяжение в системах жидкость - газ и жидкость - жидкость определяется главным образом разностью полярностей фаз. Этот вывод обычно формулируют в виде известного правила Ребиндера:
Чем больше разность полярностей ΔП фаз, тем больше поверхностное натяжение на их границе раздела.
Слайд 22Зависимость поверхностного натяжения от разности полярностей фаз в системе жидкость-жидкость
Слайд 232. Зависимость поверхностного натяжения от температуры, природы граничащих сред, концентрации растворенных
3. Влияние концентрации на поверхностное натяжение (многокомпонентные системы).
Поверхностное натяжение растворов, как правило, отличается от σ чистого растворителя.
Зависимость поверхностного натяжения раствора от концентрации растворенного вещества при условии Т=const называют изотермой поверхностного натяжения.
Слайд 243. Поверхностная активность. Правило Дюкло-Траубе.
Способность растворенных веществ изменять поверхностное натяжение растворителя
Мерой поверхностной активности является g = dσ/dc. Знак производной dσ/dc указывает на характер зависимости σ от с.
Слайд 253. Поверхностная активность. Правило Дюкло-Траубе
Для водных растворов различают три основных типа
ПАВ – поверхностно активные вещества – снижают σ. Для них характерно отрицательное значение dσ/dc<0. К ним относят амфифильные органические молекулы.
Слайд 263. Поверхностная активность. Правило Дюкло-Траубе.
ПНВ, поверхностно неактивные вещества – не влияют
ПИВ, поверхностно инактивные вещества – повышают σ. dσ/dc>0. К ним относят сильные электролиты.
Слайд 28Модель молекулы поверхностно-активного вещества: а) строение гептановой молекулы; б) строение гептанового
Слайд 293. Поверхностная активность. Правило Дюкло-Траубе.
К ПАВ относят органические соединения с несимметричным
Слайд 303. Поверхностная активность. Правило Дюкло-Траубе.
Механизм воздействия ПАВ на поверхностное натяжение воды.
Полярные
Слайд 323. Поверхностная активность. Правило Дюкло-Траубе.
Механизм воздействия ПИВ на поверхностное натяжение воды.
Введение
Слайд 333. Поверхностная активность. Правило Дюкло-Траубе.
Правило Дюкло-Траубе:
поверхностная активность вещества одного
Слайд 354. Смачивание
Смачивание - разновидность адгезии, относящаяся к взаимодействию типа
иммерсионное смачивание, имеющее место при полном погружении твердого тела в жидкость; в таком случае в смачивании участвуют две фазы: жидкость и твердое тело;
контактное смачивание, протекает с участием трех фаз: твердой, жидкой, газообразной (например, капля жидкости на твердой поверхности)