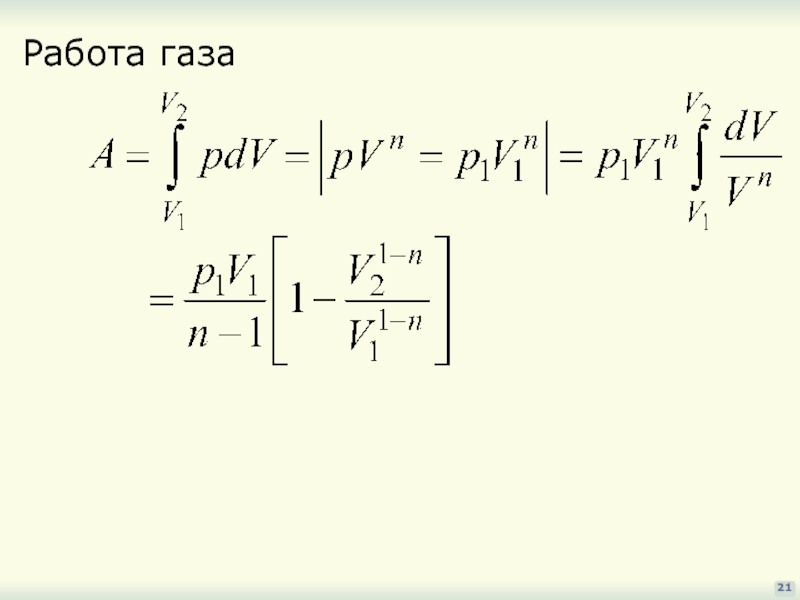- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Первое начало термодинамики презентация
Содержание
- 1. Первое начало термодинамики
- 2. §§ Внутренняя энергия газа 02 В модели
- 3. §§ Работа и теплота 03 Вычислим работу
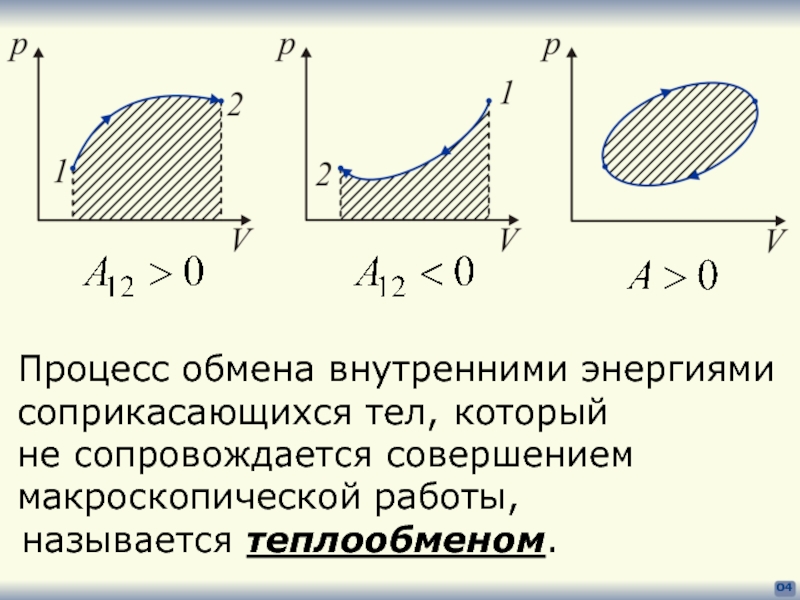
- 4. 04 Процесс обмена внутренними энергиями соприкасающихся тел,
- 5. §§ Первое начало 05 Термодинамическая система называется
- 6. 06 Пусть системой α совершена работа
- 8. §§ Теплоемкость 08 Теплоемкость вещества – физическая
- 9. 09 Удельная теплоемкость: Молярная теплоемкость: Из первого начала найдем молярную теплоемкость газа
- 10. 10 1) V = const 2) p = const рассмотрим уравнение М–К:
- 11. 11 Для идеального газа справедливо
- 12. §§ Изотермический процесс 12 Это бесконечно медленный
- 13. 13 1-е начало термодинамики т.е. вся переданная
- 15. 15 1-е начало термодинамики т.е. работа совершается
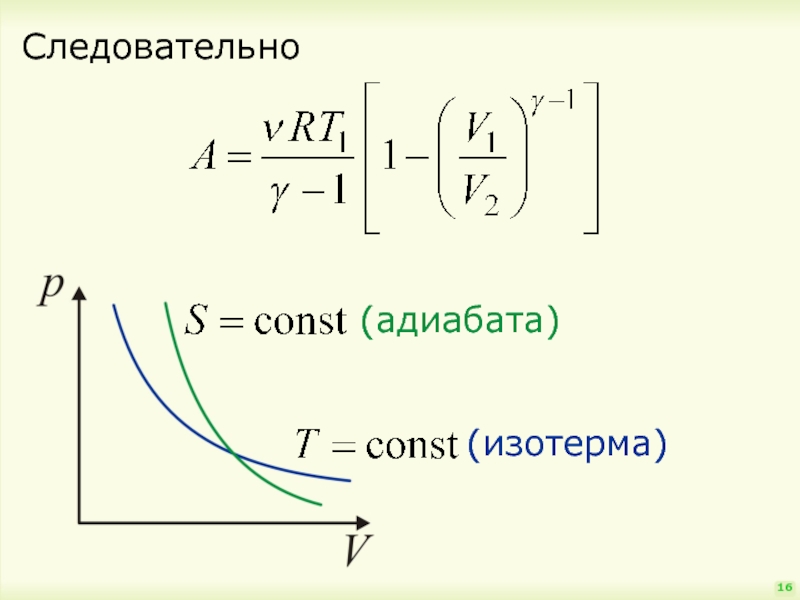
- 16. Следовательно 16
- 17. §§ Политропические процессы 17 Процесс, в котором
- 18. 18 сделаем замену R = Cp–CV и выразим dT
- 19. 19 Интегрируя, получаем или – уравнение политропы
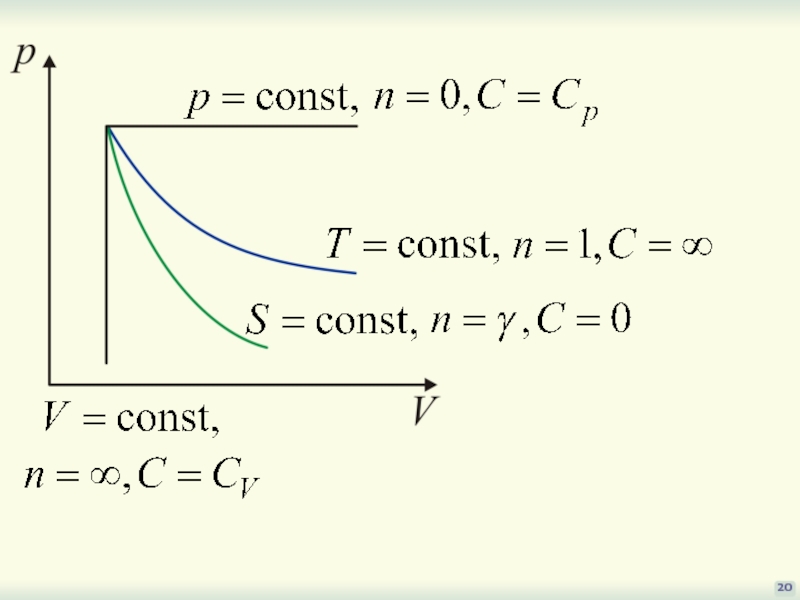
- 20. 20
- 21. 21 Работа газа
Слайд 2§§ Внутренняя энергия газа
02
В модели идеального газа силами
взаимодействия молекул пренебрегают
Внутренняя энергия
энергий теплового движения молекул:
Внутренняя энергия не зависит от
способа перевода системы в данное
состояние
(функция состояния)
Слайд 3§§ Работа и теплота
03
Вычислим работу газа при расширении
p – давление газа
F
на поршень со стороны газа
элементарная работа
– работа газа при расширении
от V1 до V2
Слайд 404
Процесс обмена внутренними энергиями
соприкасающихся тел,
не сопровождается совершением
макроскопической работы,
называется теплообменом.
Слайд 5§§ Первое начало
05
Термодинамическая система называется
изолированной,
всякий обмен энергией между ней
и внешней средой
Для изолированной системы выполняется
закон сохранения и превращения
энергии
– полная энергия не изменяется
при любых процессах, происходящих
в этой системе.
Слайд 606
Пусть системой α совершена
работа A, тогда
Рассмотрим контакт систем
в адиабатической
неподвижная
теплопроводящая
перегородка
или
Обозначим
– убыль энергии системы β
(количество
теплоты, полученное системой α)
Слайд 7
на приращение ее внутренней энергии
ΔU = U2 – U1
07
Получаем математическую формулировку
I-го начала термодинамики
Теплота Q, полученная системой,
и совершение работы A
Слайд 8§§ Теплоемкость
08
Теплоемкость вещества –
физическая величина, равная
количеству теплоты,
для нагревания вещества на 1 K
Различают теплоемкость вещества
при постоянном давлении Cp
и постоянном объеме CV.
Слайд 909
Удельная теплоемкость:
Молярная теплоемкость:
Из первого начала
найдем молярную теплоемкость газа
Слайд 12§§ Изотермический процесс
12
Это бесконечно медленный процесс,
т.к. в системе должно установиться
термодинамическое равновесие
Закон
Изменение внутренней энергии
Слайд 1313
1-е начало термодинамики
т.е. вся переданная рабочему телу
теплота идет на совершение
работы
Работа газа при изотермическом
расширении:
Слайд 14
не происходил обмен энергией
с окружающей средой или он был бы
несущественным
§§ Адиабатический процесс
(S = const, S – энтропия)
Это – очень быстрый процесс,
Уравнение Пуассона:
14
следовательно
Слайд 1515
1-е начало термодинамики
т.е. работа совершается за счет убыли
энергии системы
Работа газа при
процессе:
Слайд 17§§ Политропические процессы
17
Процесс, в котором теплоемкость
остается постоянной величиной,
называется политропическим
(политропным).
Рассмотренные процессы
– частные случаи политропного процесса
Получим его общее уравнение: