- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы молекулярно-кинетической теории презентация
Содержание
- 1. Основы молекулярно-кинетической теории
- 2. Основы молекулярно-кинетической теории Молекулярно-кинетическая теория (МКТ)
- 3. В основе МКТ строения вещества лежат три
- 4. Первое положение МКТ Молекула – наименьшая устойчивая
- 5. Второе положение МКТ Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении
- 6. Третье положение МКТ Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются
- 7. Основные понятия МКТ Моль - количество вещества,
- 8. Основные понятия МКТ Количеством вещества ν называется
- 9. Явления переноса В термодинамических системах возникают особые
- 10. Явления переноса 1.Теплопроводность – это процесс переноса
- 11. λ –теплопроводность (лямбда) (коэффициент теплопроводности )
- 12. Тепловое сопротивление и изоляция тепловое сопротивление, способность
- 13. Явления переноса 2.Диффузия – это обусловленное тепловым
- 14. Коэффициент диффузии ( jm —
- 15. Диффузия и осмос В том случае,
- 16. Диффузия и осмос Иначе говоря, осмос
- 19. Явления переноса 3.Внутреннее трение (вязкость) возникает вследствие
- 20. Вязкость жидкости В реальной жидкости вследствие взаимного притяжения и движения молекул место внутреннее трение
- 21. Вязкость жидкости Оно проявляется как сила сопротивления
- 22. Вязкость жидкости Сила внутреннего трения Fв возникающая
- 23. Коэффициент вязкости η есть величина, численно равная
- 24. Вязкость жидкостей измеряют путем наблюдения за их
- 26. Измерение коэффициента вязкости исследуемой жидкости вискозиметром Оствальда
- 27. Идеальным газом называется газ, в котором молекулы
- 28. Основное параметры газа уравнение Менделеева-Клапейрона Р -
- 29. ГАЗОВЫЕ ЗАКОНЫ Изобарный процесс Закон Гей- Люссака:
- 30. ГАЗОВЫЕ ЗАКОНЫ Изохорный процесс Закон Шарля:
- 31. ГАЗОВЫЕ ЗАКОНЫ Изотермический процесс Закон Бойля-Мариотта: для
- 32. Молекулярные явления в жидкостях Молекулярное строение жидкостей
- 33. Молекулярное строение жидкостей Молекулы жидкости
- 35. Поверхностное натяжение
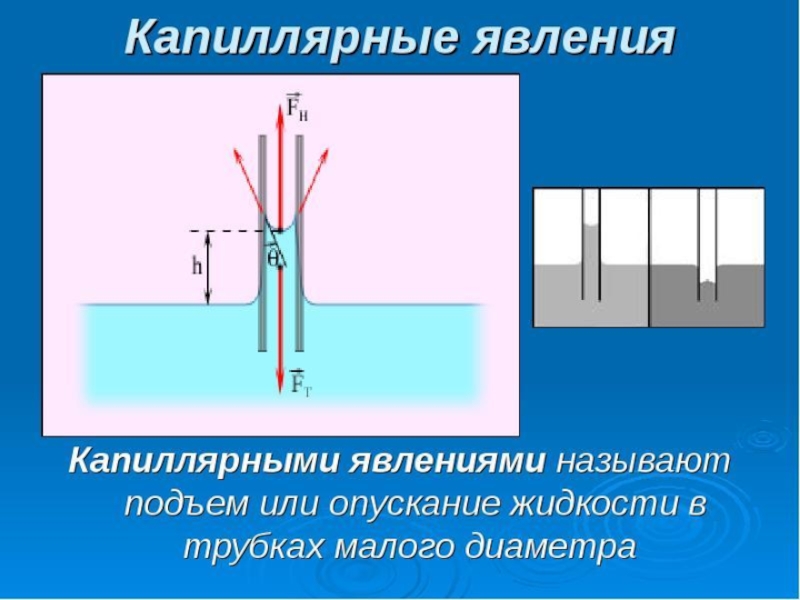
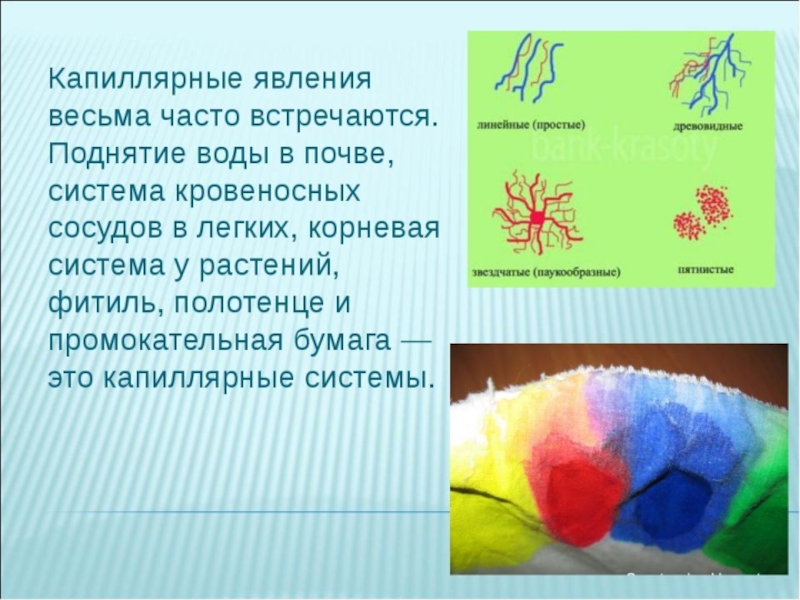
- 37. Капиллярные явления
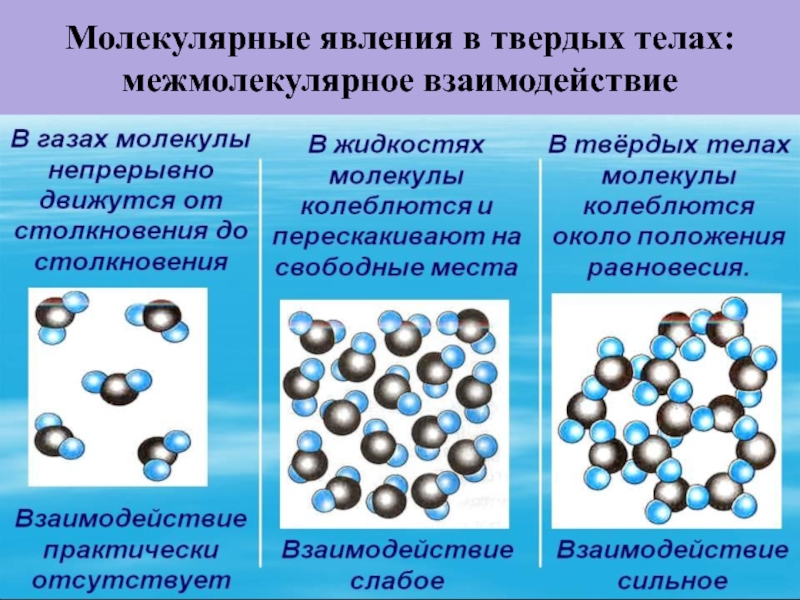
- 39. Молекулярные явления в твердых телах: межмолекулярное взаимодействие
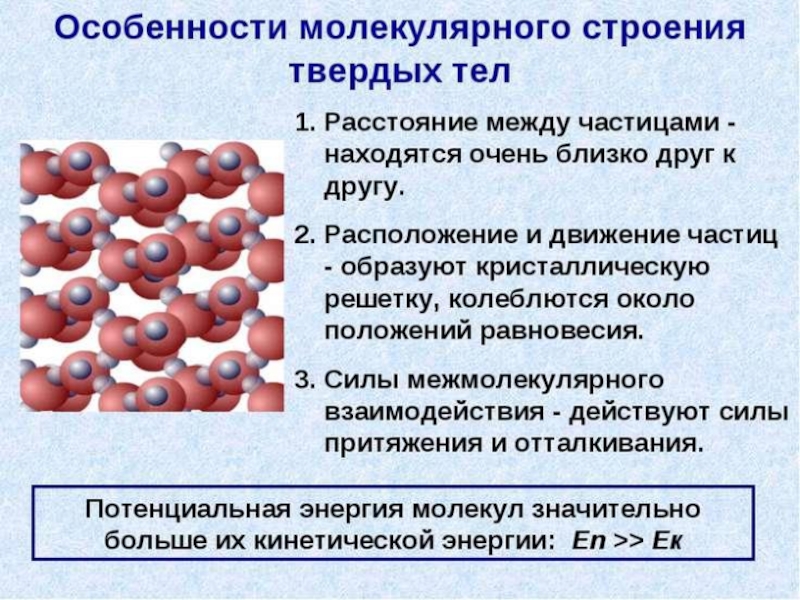
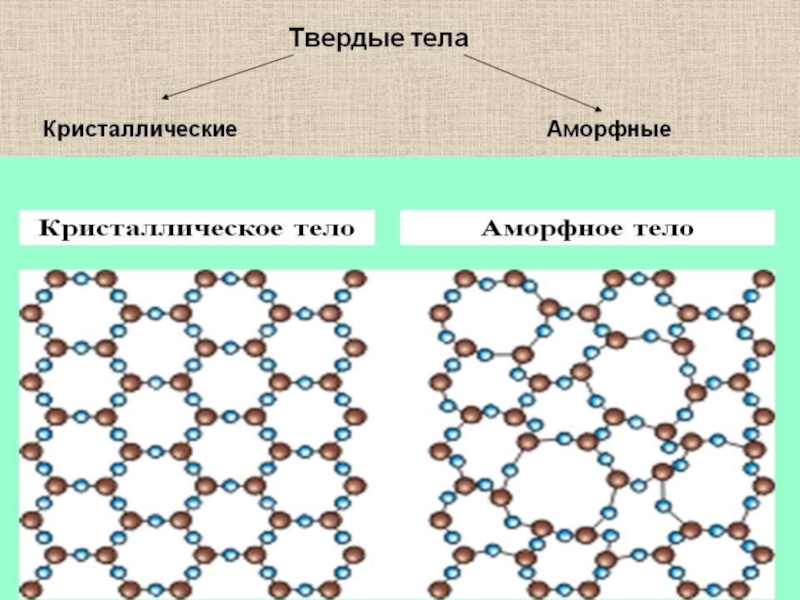
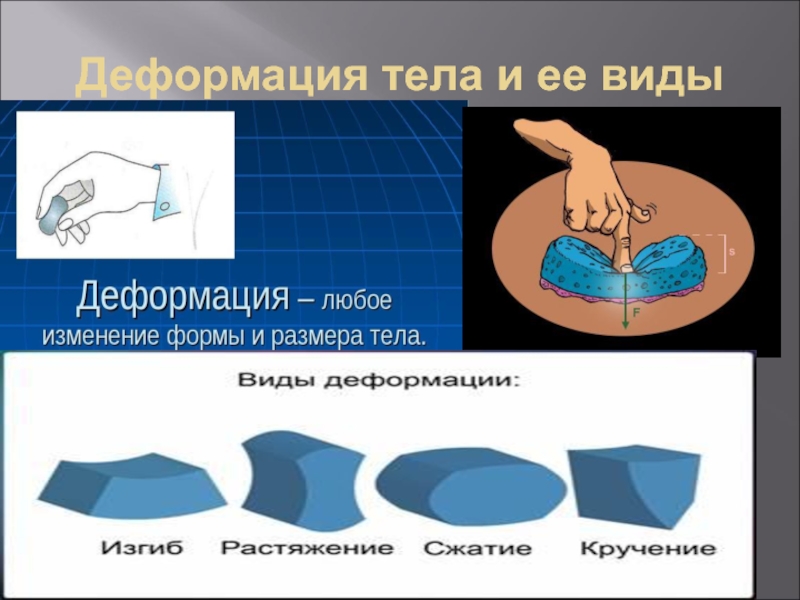
- 42. Механические свойства твердых тел
- 43. Деформация тела и ее виды
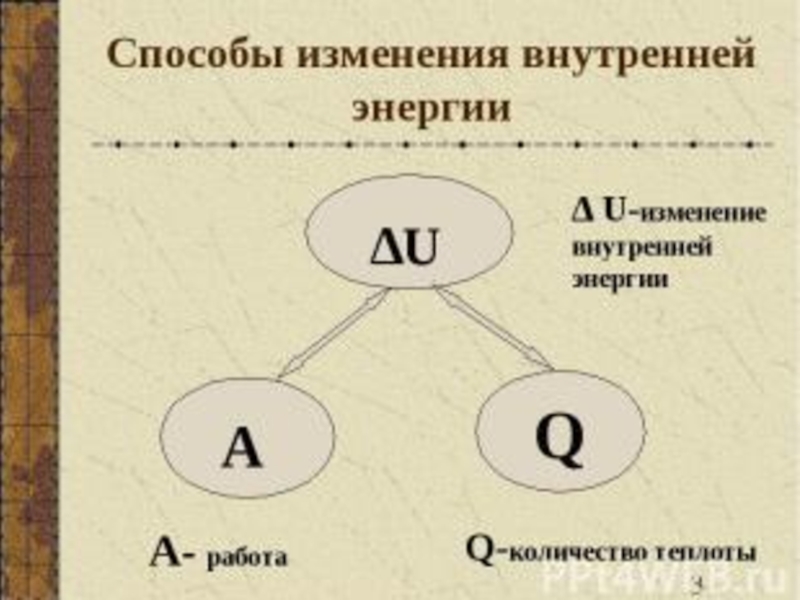
- 44. Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы между телами
- 49. Вечный двигатель первого рода -устройство, способное бесконечно
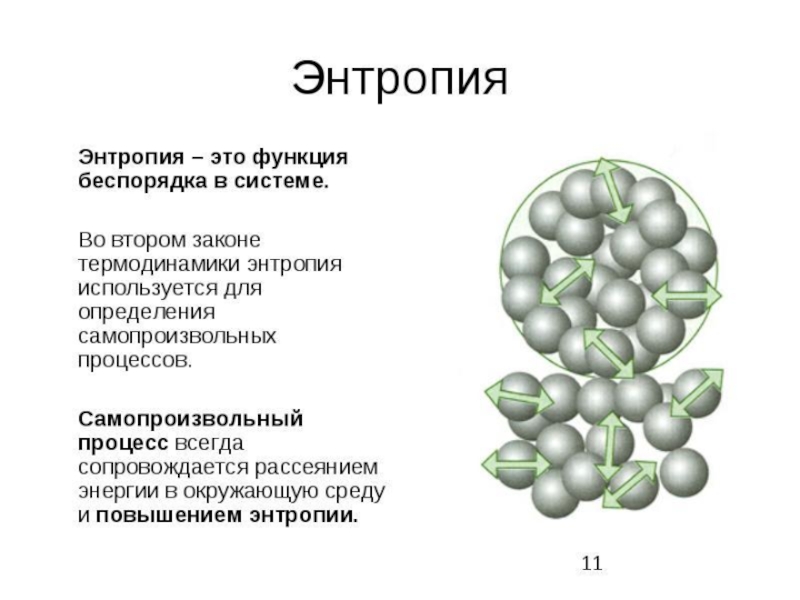
- 52. Энтропия замкнутой системы, т.е. системы, которая не
- 55. Применение второго закона к биологическим системам в
- 56. Илья Романович Пригожин (25 января(25 января 1917(25
- 58. Что такое синергетика Древнее понятие «синергия» означает
- 59. Сущность второго закона термодинамики Замкнутая (или изолированная)
- 60. законы физики, справедливы только для замкнутых систем!!!
- 61. Нестабильный период системы Нестабильность (кризис) возникает тогда,
- 62. Нестабильный период В этом случае система находится
- 63. Основные положения синергетики синергетическая система может находиться
- 64. Основные положения синергетики однако, ими можно эффективно
- 65. Основные положения синергетики Неустойчивость - путь к
- 66. Постулат И.Р. Пригожина состоит в том, что
Слайд 2Основы
молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые
Слайд 3В основе МКТ строения вещества лежат три положения:
Вещество состоит из
В состав этих частиц входят более мелкие элементарные частицы
Первое положение
Слайд 4Первое положение МКТ
Молекула – наименьшая устойчивая частица данного вещества.
Молекула обладает
Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества
Атом – это наименьшая частица данного химического элемента.
Слайд 5Второе положение МКТ
Частицы, из которых состоит вещество, находятся в непрерывном хаотическом
Слайд 6Третье положение МКТ
Частицы вещества взаимодействуют друг с другом – притягиваются и
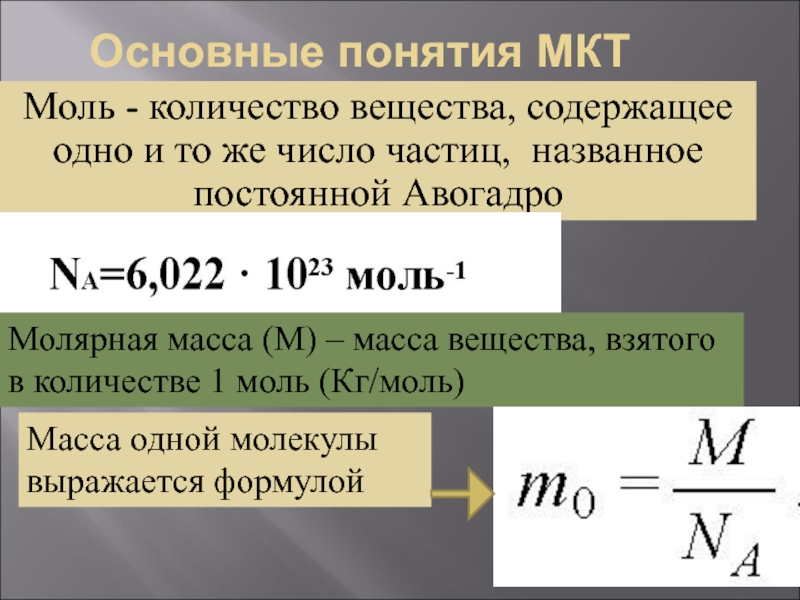
Слайд 7Основные понятия МКТ
Моль - количество вещества, содержащее одно и то же
Молярная масса (М) – масса вещества, взятого в количестве 1 моль (Кг/моль)
Масса одной молекулы выражается формулой
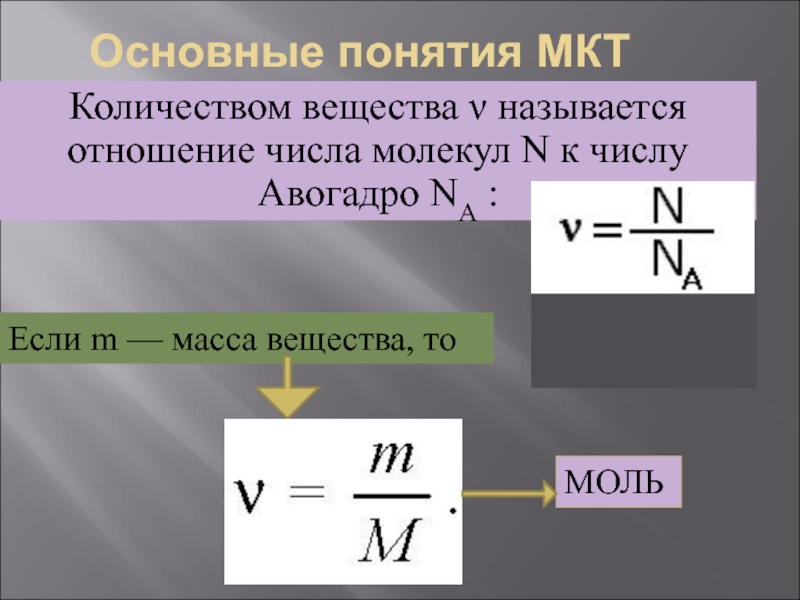
Слайд 8Основные понятия МКТ
Количеством вещества ν называется отношение числа молекул N к
Если m — масса вещества, то
МОЛЬ
Слайд 9Явления переноса
В термодинамических системах возникают особые необратимые процессы, называемые явлениями переноса,
диффузия,
теплопроводность
внутреннее трение (вязкость)
Слайд 10Явления переноса
1.Теплопроводность – это процесс переноса тепловой энергии, обусловленный хаотическим движением
Перенос энергии в форме теплоты подчиняется закону Фурье:
(48.1)
jE - плотность теплового потока
λ –теплопроводность
- градиент температуры
Слайд 11λ –теплопроводность (лямбда) (коэффициент теплопроводности )
(48.1)
отражает свойство вещества проводить
Слайд 12Тепловое сопротивление и изоляция
тепловое сопротивление, способность тела
(его поверхности или какого-либо
Тепловое сопротивление –величина обратная коэффициенту теплопередачи
м²К/вт
Слайд 13Явления переноса
2.Диффузия – это обусловленное тепловым движением молекул проникновение одних веществ
Явление диффузии для химически однородного газа подчиняется закону Фука:
(
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx — градиент плотности
Слайд 14Коэффициент диффузии
(
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx —
Коэффициент диффузии позволяет провести оценку количества вещества, прошедшего через единицу площади (квадратный метр) за единицу времени (секунду).
Единица измерения м²/с
Коэффициент диффузии определяется свойствами среды и типом диффундирующих частиц
Слайд 15Диффузия и осмос
В том случае, если диффундирующие вещества встречают на
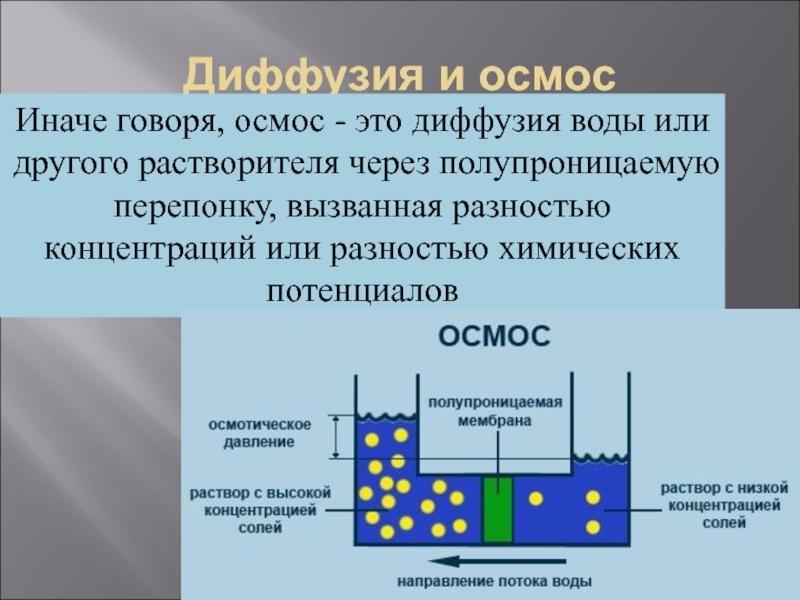
Слайд 16Диффузия и осмос
Иначе говоря, осмос - это диффузия воды или
Слайд 19Явления переноса
3.Внутреннее трение (вязкость) возникает вследствие переноса импульса молекул между слоями
сила
(
η - динамическая вязкость
dv/dx - градиент скорости,
S - площадь, на которую действует сила F
Слайд 20Вязкость жидкости
В реальной жидкости вследствие взаимного притяжения и движения молекул место
Слайд 21Вязкость жидкости
Оно проявляется как сила сопротивления при помешивании жидкости, вызывает замедление
Слайд 22Вязкость жидкости
Сила внутреннего трения Fв возникающая в плоскости соприкосновения двух, скользящих
Слайд 23Коэффициент вязкости η есть величина, численно равная силе трения, возникающей между
Единица измерения коэффициента вязкости:
Слайд 24Вязкость жидкостей измеряют путем наблюдения за их течением в тонких трубках.
Слайд 26Измерение коэффициента вязкости исследуемой жидкости вискозиметром Оствальда осуществляется путем сравнения с
Слайд 27Идеальным газом называется газ, в котором молекулы движутся свободно и взаимодействуют
Модель идеального газа удовлетворительно описывает достаточно разреженные газы
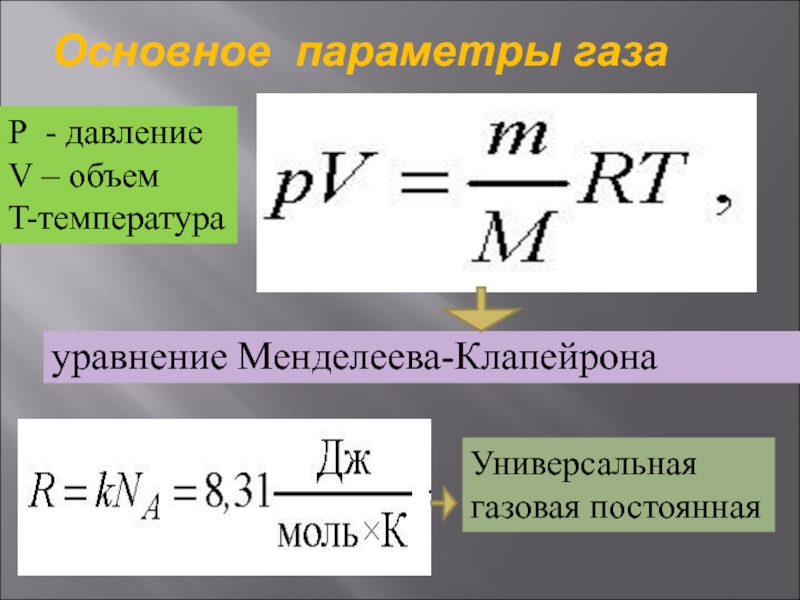
Слайд 28Основное параметры газа
уравнение Менделеева-Клапейрона
Р - давление
V – объем
T-температура
Универсальная газовая постоянная
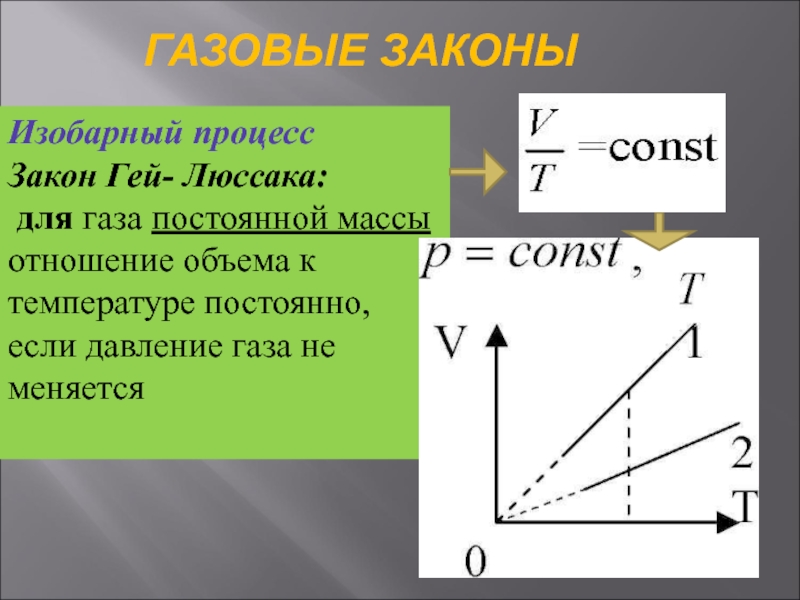
Слайд 29ГАЗОВЫЕ ЗАКОНЫ
Изобарный процесс
Закон Гей- Люссака:
для газа постоянной массы
отношение объема к
температуре
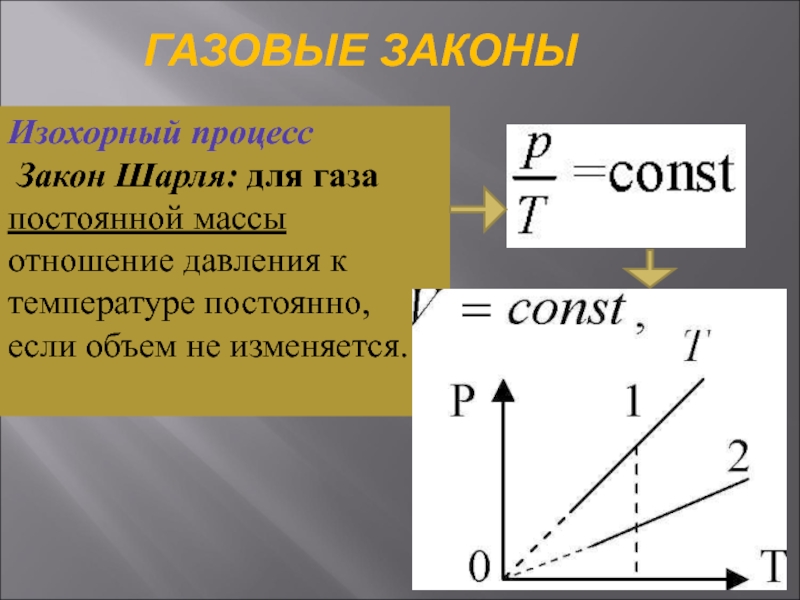
Слайд 30ГАЗОВЫЕ ЗАКОНЫ
Изохорный процесс
Закон Шарля: для газа постоянной массы отношение давления
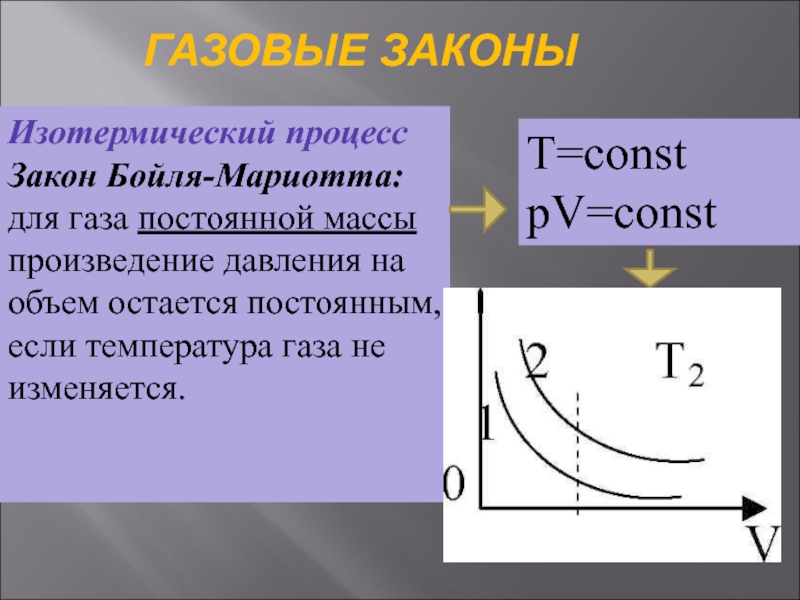
Слайд 31ГАЗОВЫЕ ЗАКОНЫ
Изотермический процесс Закон Бойля-Мариотта: для газа постоянной массы произведение давления
Т=const
pV=const
Слайд 33
Молекулярное строение жидкостей
Молекулы жидкости расположены близко друг к другу
притяжение между
Жидкости текучи; их трудно сжать.
Слайд 44Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы
Слайд 49Вечный двигатель первого рода
-устройство, способное бесконечно совершать работу-устройство, способное бесконечно совершать
Невозможность осуществления вечного двигателя первого рода постулируется в термодинамике как первое начало термодинамики.
Слайд 52Энтропия замкнутой системы, т.е. системы, которая не обменивается с окружением ни
Слайд 55Применение второго закона к биологическим системам в его классической формулировке приводит,
Однако увеличение энтропии в необратимых самопроизвольных процессах происходит в изолированных системах, а биологические системы являются открытыми
Слайд 56Илья Романович Пригожин
(25 января(25 января 1917(25 января 1917, Москва(25 января 1917,
Слайд 58Что такое синергетика
Древнее понятие «синергия» означает объединение человеческой и божественной энергии.
Слайд 59Сущность второго закона термодинамики
Замкнутая (или изолированная) система (где отсутствуют обменные процессы
Слайд 60законы физики, справедливы только для замкнутых систем!!!
Систем вероятностного типа способны обмениваться
Данный стабильный период развития системы продолжается до тех пор, пока внутренние и внешние причины дестабилизации не будут угрожать ей разрушением
Слайд 61Нестабильный период системы
Нестабильность (кризис) возникает тогда, когда система утрачивает свою продуктивность
При этом система перестает обеспечивать самонастройку, и как бы сама усиливает «раскачку», переходя в режим благоприятный для работы радикальных природных механизмов, способных обеспечить приспособительную перестройку
Слайд 62Нестабильный период
В этом случае система находится в состоянии кризиса – нестабильности.
Идея нестабильности системы кладет конец претензиям на абсолютный контроль над какой либо сферой реальности, любым возможным мечтаниям об абсолютном контролируемом обществе
Реальность вообще не контролируема в смысле, который был провозглашен прежней наукой!!!
Слайд 63Основные положения синергетики
синергетическая система может находиться в разные моменты времени в
Слайд 64Основные положения синергетики
однако, ими можно эффективно управлять при помощи слабых резонансных
сложноорганизованным системам нельзя навязывать пути развития,
Слайд 65Основные положения синергетики
Неустойчивость - путь к выживанию, самообновлению, развитию и согласованию
жесткая устойчивая система уязвима перед внешними воздействиями
Хаос является конструктивным механизмом самоорганизации сложных систем
Слайд 66Постулат И.Р. Пригожина состоит в том, что общее изменение энтропии dS
dS = deS + diS.
Для изолированных систем deS = 0, и мы приходим к классической формулировке второго закона:
dS = diS = 0.