Презентации к лекционному курсу
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные понятия твердотельной электроники презентация
Содержание
- 1. Основные понятия твердотельной электроники
- 2. Целью дисциплины является – изучение физических основ
- 3. Компете́нция (от лат. competere — соответствовать, подходить) — способность применять знания, умения,
- 4. Первым электронным переключающим прибором был вакуумный диод, запатентованный в 1904 году англичанином Д.А. Флемингом
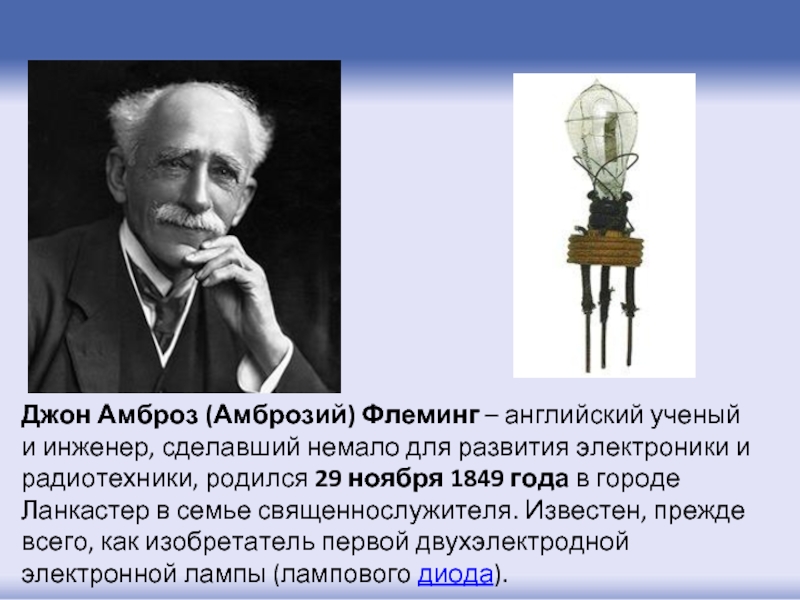
- 5. Джон Амброз (Амброзий) Флеминг – английский ученый и
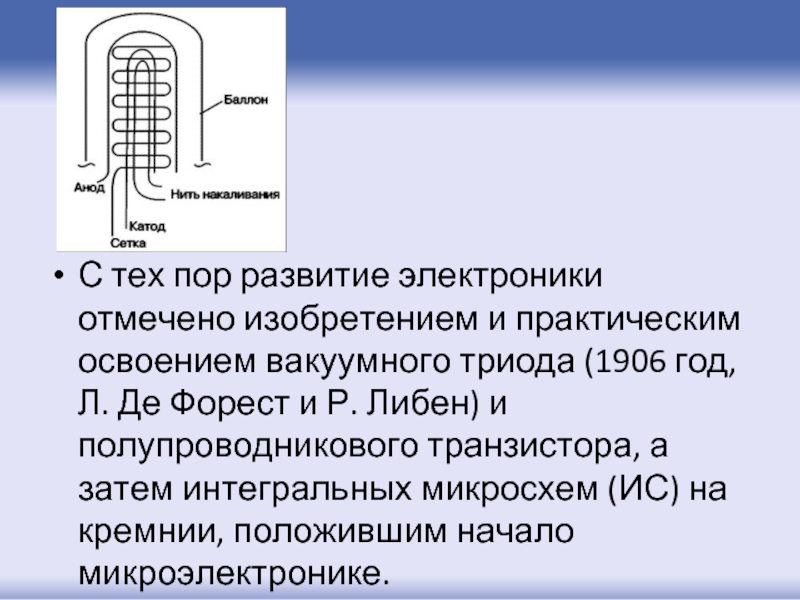
- 6. С тех пор развитие электроники отмечено изобретением
- 7. Ли де Фо́рест (англ. Lee De Forest; 26.08.1873 — 30.06.1961 США;
- 8. Р. Либен (Robert von Liben) (5.09.1878 –20.02.1913 in Vienna) – австрийский физик.
- 9. Создание первого транзистора 1947 год
- 11. Создание Первой микросхемы с 5 транзисторами
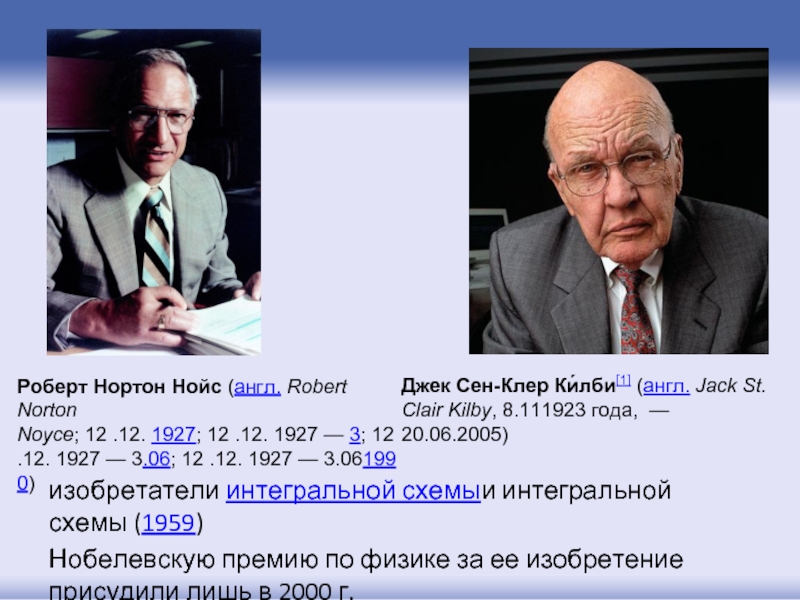
- 12. изобретатели интегральной схемыи интегральной схемы (1959) Нобелевскую премию по физике
- 13. Создание Первой коммерческой ИС с поликремниевым затвором 1968 г.
- 14. Сама возможность существования твердого состояния вещества обусловлена
- 15. Выделяют несколько видов связи: Силы Ван-дер-Ваальса; Ковалентная; Ионная (полярная); Металлическая; Водородная
- 16. Кристаллы – это вещества, в которых составляющие
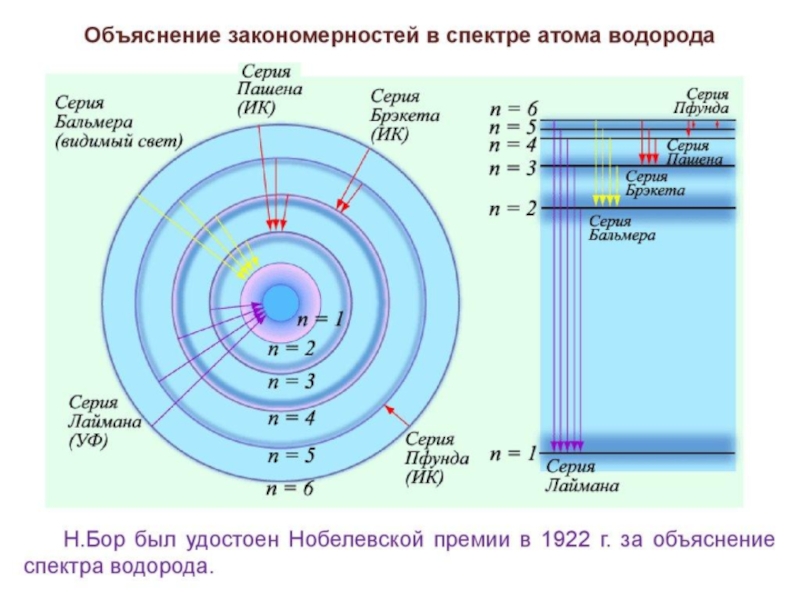
- 21. Движение электронов в атоме Все окружающие
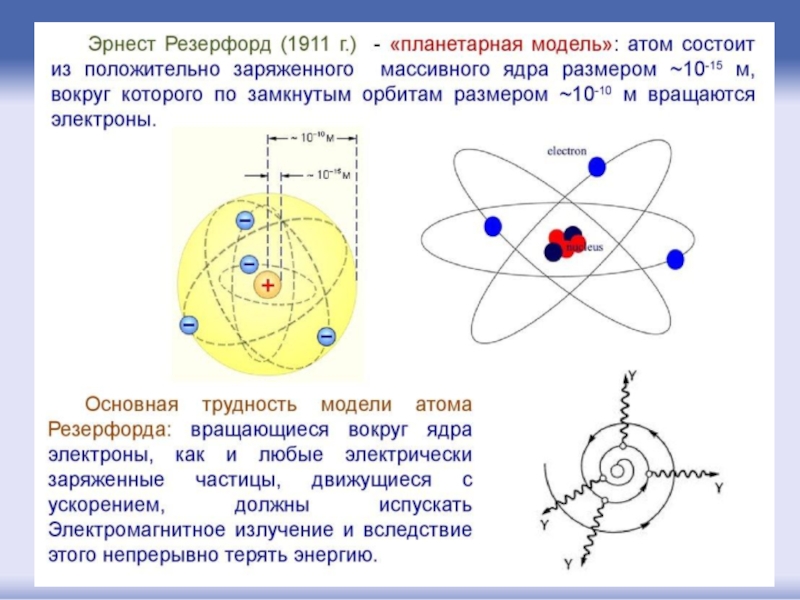
- 24. 30.08.1871, Спринг Грув - 19.10.1937, Кембридж) –
- 29. Постулаты Бора Нильс Хе́нрик Дави́д Бор (дат. Niels
- 31. Каждый атом или молекула может находиться в
- 33. Взаимодействие частиц в квантовой механике характеризуют потенциальной
- 34. Квантование энергии атома Запишем условие вращения электрона
- 35. Решая эту систему уравнений, находим для радиусов
- 36. Для скорости электрона на n-ой стационарной орбите
- 37. Полная энергия электрона в атоме оказалась отрицательной,
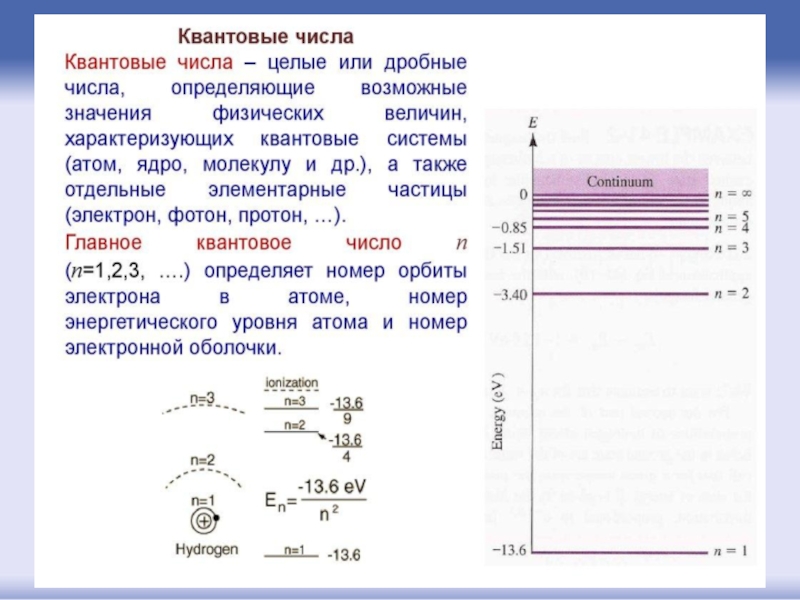
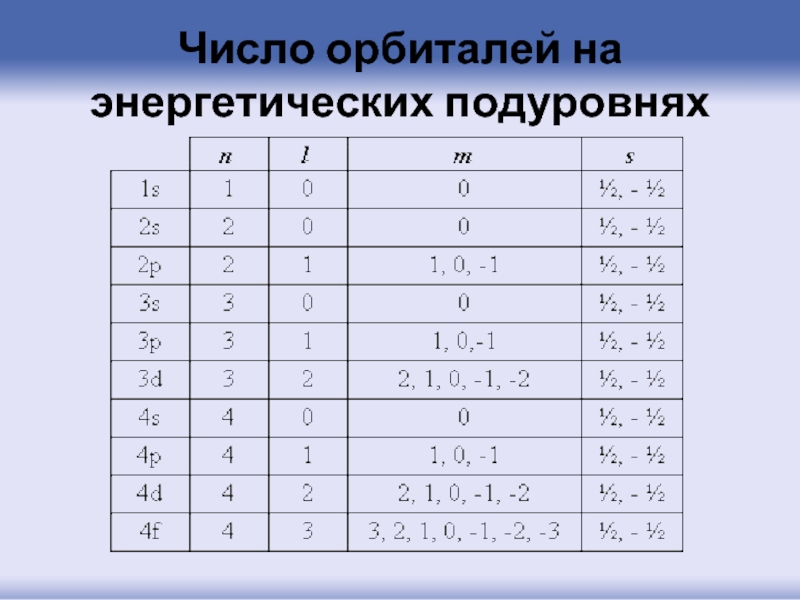
- 38. квантовые числа
- 40. Главное квантовое число n может принимать любые
- 41. Размеры атомной орбитали с увеличением атомного номера
- 42. С увеличением n расстояние между энергетическими уровнями
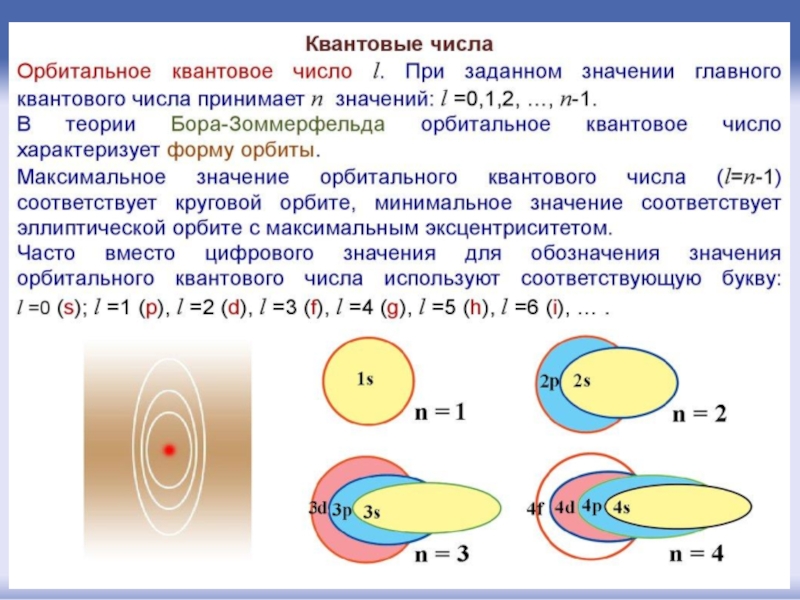
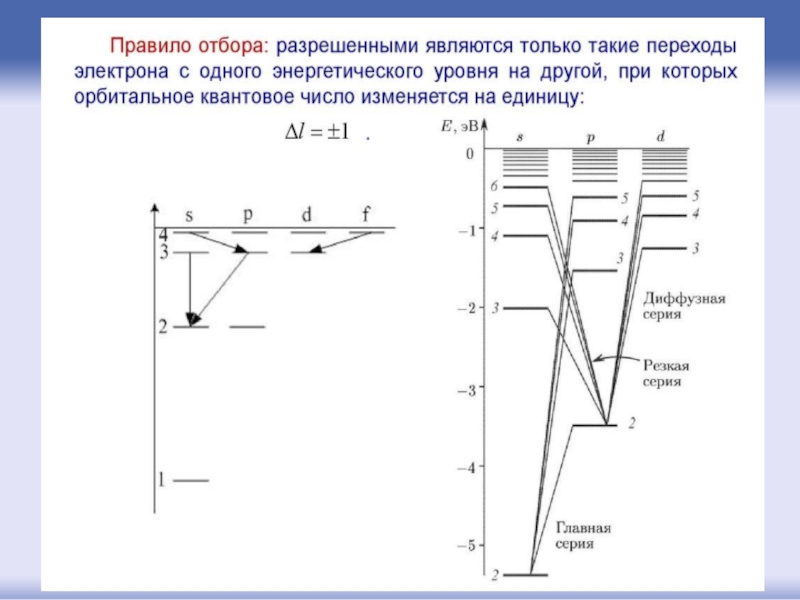
- 43. Орбитальное квантовое число l определяет форму орбитали.
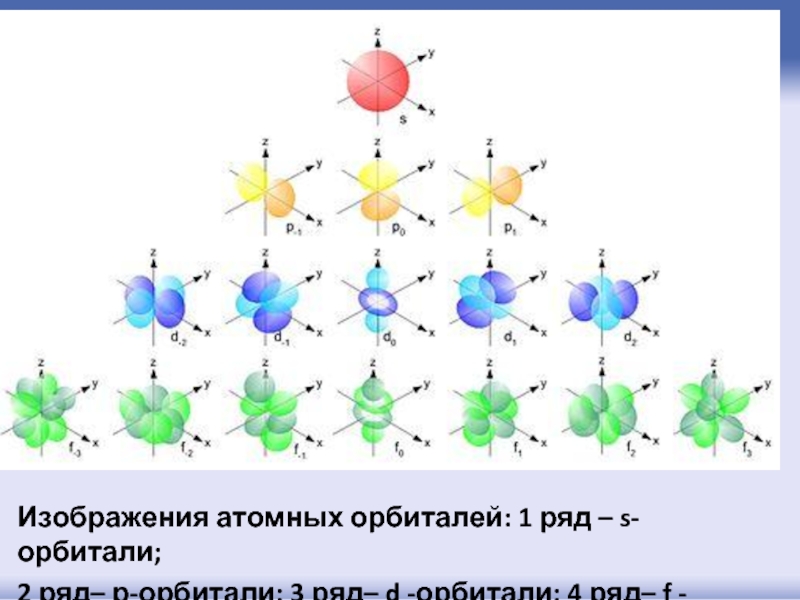
- 46. Изображения атомных орбиталей: 1 ряд – s-орбитали;
- 47. Каждому уровню энергии соответствует стоячая электронная волна,
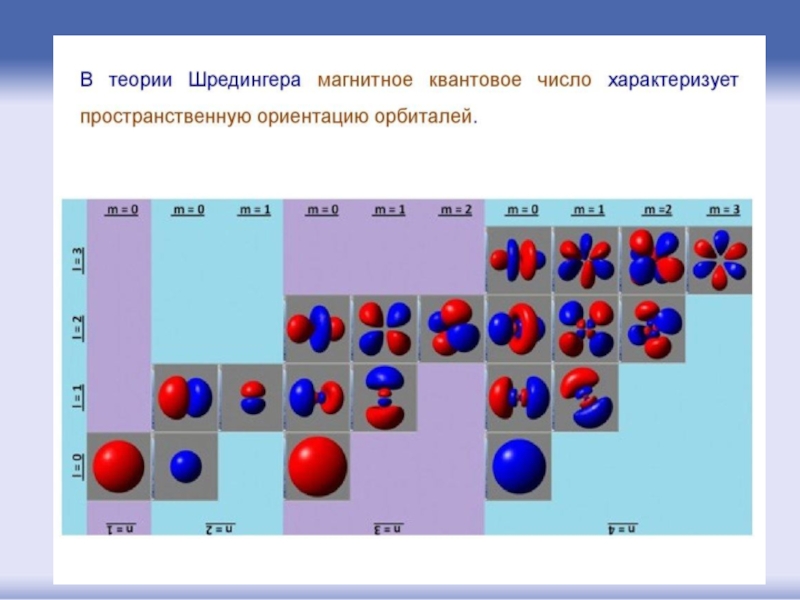
- 49. Магнитное квантовое число характеризует величину
- 54. – магнетон Бора (единица элементарного магнитного момента)
- 55. В 1925 г. голландец Ральф Кронинг и
- 57. Спиновое квантовое число s Электрон помимо координат
- 58. Спин – это одно из проявлений
- 59. Число орбиталей на энергетических подуровнях
Слайд 1Электронный учебно-методический комплекс
Твердотельная электроника
Основные понятия твердотельной электроники
МОСКВА
Слайд 2Целью дисциплины является – изучение физических основ и разновидностей электронных приборов,
Слайд 3Компете́нция (от лат. competere — соответствовать, подходить) — способность применять знания, умения, успешно действовать на основе
В процессе освоения дисциплины формируются следующие компетенции:
способность использовать основные приемы обработки и представления экспериментальных данных (ОПК-5);
способность строить простейшие физические и математические модели приборов, схем, устройств и установок электроники и наноэлектроники различного функционального назначения, а также использовать стандартные программные средства их компьютерного моделирования (ПК-1).
Слайд 4Первым электронным переключающим прибором был вакуумный диод, запатентованный в 1904 году
Слайд 5Джон Амброз (Амброзий) Флеминг – английский ученый и инженер, сделавший немало для
Слайд 6С тех пор развитие электроники отмечено изобретением и практическим освоением вакуумного
Слайд 7Ли де Фо́рест (англ. Lee De Forest; 26.08.1873 — 30.06.1961 США; 26.08.1873 — 30.06.1961 США) — американский изобретатель,
Слайд 9Создание первого транзистора
1947 год
1956 год. Вручение Бардину, Браттейну и
Слайд 11Создание Первой микросхемы с 5 транзисторами
12 сентября 1958 г. в
компании Texas Instruments
Слайд 12изобретатели интегральной схемыи интегральной схемы (1959)
Нобелевскую премию по физике за ее изобретение присудили лишь
Роберт Нортон Нойс (англ. Robert Norton Noyce; 12 .12. 1927; 12 .12. 1927 — 3; 12 .12. 1927 — 3.06; 12 .12. 1927 — 3.061990)
Джек Сен-Клер Ки́лби[1] (англ. Jack St. Clair Kilby, 8.111923 года, — 20.06.2005)
Слайд 14Сама возможность существования твердого состояния вещества обусловлена взаимодействием сил притяжения и
Характер сил взаимодействия в первую очередь определяется строением электронных оболочек взаимодействующих атомов.
Слайд 15Выделяют несколько видов связи:
Силы Ван-дер-Ваальса;
Ковалентная;
Ионная (полярная);
Металлическая;
Водородная
Слайд 16Кристаллы –
это вещества, в которых составляющие их частицы (атомы, молекулы) расположены
Слайд 21Движение электронов в атоме
Все окружающие нас тела состоят из элементарных
Слайд 2430.08.1871, Спринг Грув - 19.10.1937, Кембридж) – британский физик новозеландского происхождения.
Известен
Эрне́ст Ре́зерфорд
(англ. Ernest Rutherford)
Слайд 29Постулаты Бора
Нильс Хе́нрик Дави́д Бор
(дат. Niels Henrik David Bohr; 7.10; 7.10. 1885; 7.10. 1885
Лауреат Нобелевской премии по физике Лауреат Нобелевской премии по физике (1922).
Был членом более чем 20 академий наук мира, в том числе
иностранным иностранным почётным членом АН СССР
Слайд 31Каждый атом или молекула может находиться в том или другом энергетическом
Для описания электронной системы, будь то атом, молекула или кристалл необходимо знать все её возможные квантовые состояния, характеризуемые энергетическим спектром системы (кристалла, атома). Если электронная система находится в равновесии и не подвергается никаким внешним воздействием, то находящиеся в ней электроны должны занимать состояния с минимальной энергией.
Слайд 33Взаимодействие частиц в квантовой механике характеризуют потенциальной энергией, формула которой заимствуется
Слайд 34Квантование энергии атома
Запишем условие вращения электрона массы по круговой
Слайд 35Решая эту систему уравнений, находим для радиусов стационарных орбит электрона в
Вводя в качестве универсальной константы теории боровский радиус
= 0,529∙10-10 м
как радиус первой стационарной орбиты электрона в атоме водорода, запишем формулу в виде
Слайд 36Для скорости электрона на n-ой стационарной орбите получаем значение
Полная энергия
и потенциальной энергии кулоновского взаимодействия электрона с ядром
эВ
Слайд 37Полная энергия электрона в атоме оказалась отрицательной, так как отрицательна потенциальная
Для описания атома используют квантовые числа – энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится
Слайд 40Главное квантовое число n может принимать любые целые положительные значения от
(1)
Здесь Z – порядковый номер элемента в таблице
Д.И. Менделеева.
эВ
Слайд 41Размеры атомной орбитали с увеличением атомного номера z уменьшаются приблизительно в z раз,
Для внешних (валентных) электронов атома его ядро и внутренние атомные электронные оболочки образуют "квази-ядро", внутренний остов, суммарный положительный электрический заряд которого меньше, чем заряд ядра. Например, у атомов второго периода периодической системы элементов остовом атома является ядро, экранированное внутренней электронной оболочкой, т.е. катион с положительным электрическим зарядом (z-2).
Слайд 42С увеличением n расстояние между энергетическими уровнями и энергия связи электронов
Согласно (1), энергия электрона, находящегося в связанном состоянии (например, энергия электрона атома любого вещества), может принимать лишь некоторые дискретные значения, а все остальные значения невозможны или, как принято говорить, запрещены.
Слайд 43Орбитальное квантовое число l
определяет форму орбитали. Значение орбитального числа l=(n-1)=0,1,2,3...(n-1).
Также
l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 – d-орбиталями (5 типов),
l = 3 – f-орбиталями (7 типов)
Слайд 46Изображения атомных орбиталей: 1 ряд – s-орбитали;
2 ряд– р-орбитали; 3
Слайд 47Каждому уровню энергии соответствует стоячая электронная волна, электрон колеблется вокруг и
Слайд 49Магнитное квантовое число
характеризует величину магнитного поля, создаваемого при вращении
Например, для l = 2: m = -2, -1, 0, 1, 2.
Слайд 55В 1925 г. голландец Ральф Кронинг и независимо Джордж Уленбек и
Слайд 57Спиновое квантовое число s
Электрон помимо координат и импульса характеризуется вектором спина.
Внутренний момент импульса, связанный с вращением, назвали спином (от англ. spin – вращение), а момент, связанный с вращением вокруг ядра – орбитальным моментом.
Спин, подобно заряду, – внутренняя характеристика электрона, в классической теории аналогичного понятия быть не может.
Спиновое число s =+½.
Слайд 58
Спин – это одно из проявлений принципа тождественности частиц, который применительно
все электроны Вселенной неразличимы.
Электроны, как и фотоны,
можно изучать лишь в совокупности.