горіння
Лекція 2
ПОЛУМ’Я. ПРОЦЕСИ, ЩО ВІДБУВАЮТЬСЯ У ПОЛУМ’Ї
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2) презентация
Содержание
- 1. Основи процесів горіння. Полум’я. Процеси, що відбуваються у полум’ї. (Розділ 1.1.2)
- 2. План лекції 1. Будова полум’я 1.1. Зони
- 3. 1. БУДОВА ПОЛУМ’Я Полум’я – це газовий
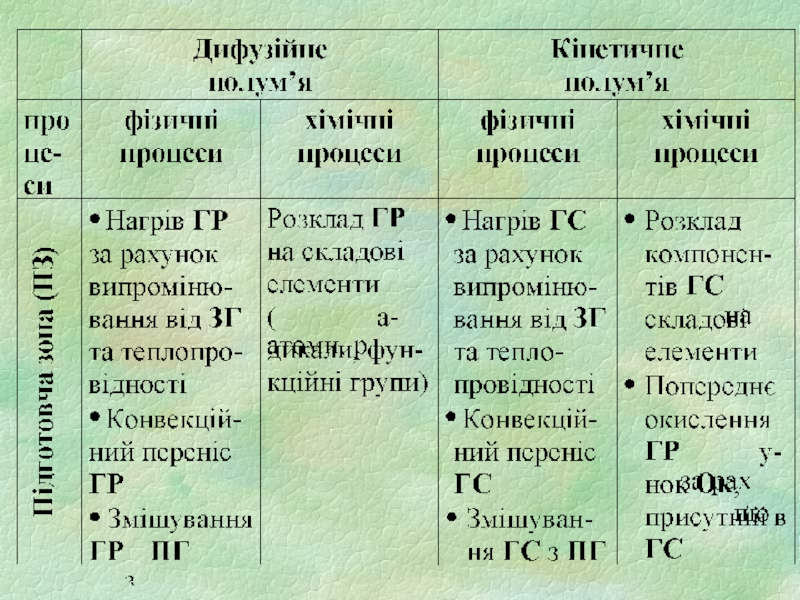
- 4. 1.1. Зони полум’я 1) підготовча зона (ПЗ)
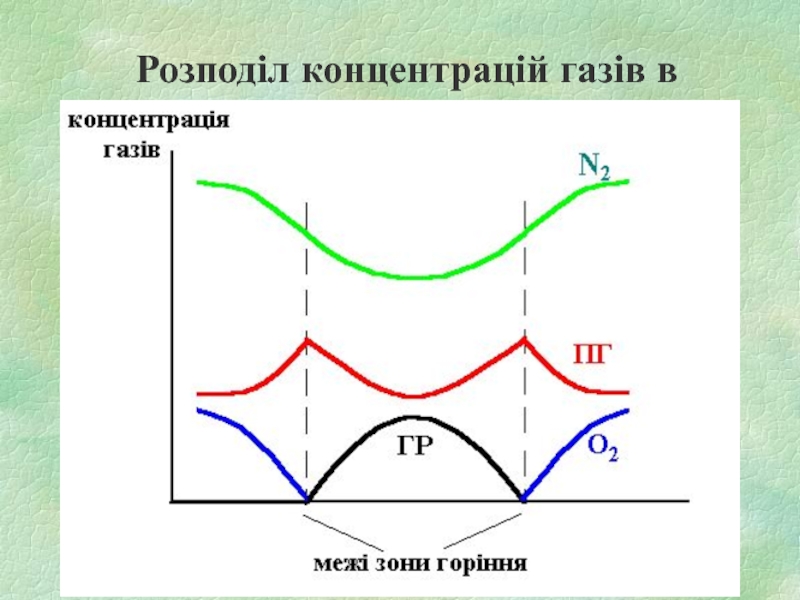
- 8. Розподіл концентрацій газів в дифузійному полум'ї
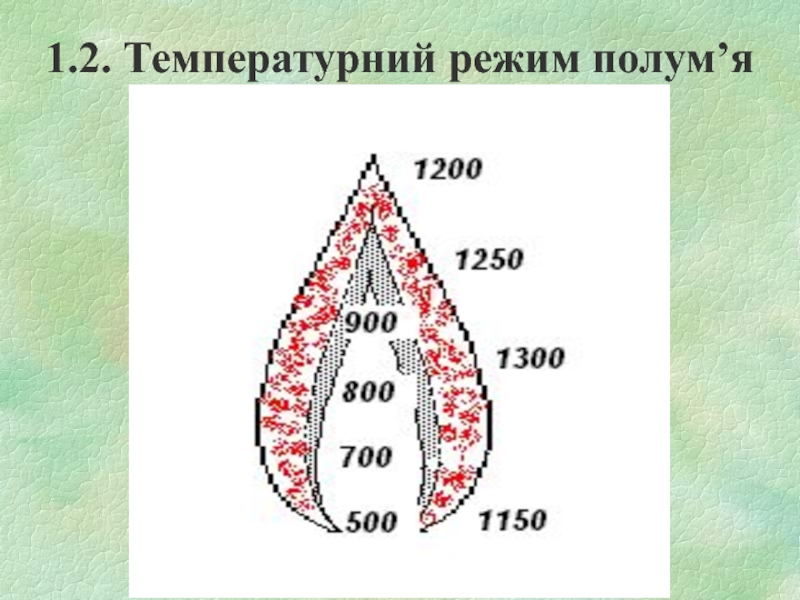
- 9. 1.2. Температурний режим полум’я
- 10. Температура в ПЗ значно нижча, ніж в
- 11. 1.3. Колір дифузійного полум’я Термічне розкладання речовин
- 12. Залежність кольору дифузійного полум’я від вмісту деяких компонентів
- 14. 2. ОСНОВНІ ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕСИ В
- 15. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ Зародження (ініціювання) ланцюгів -
- 16. Розгалуження ланцюгів - стадія ланцюгового процесу, у
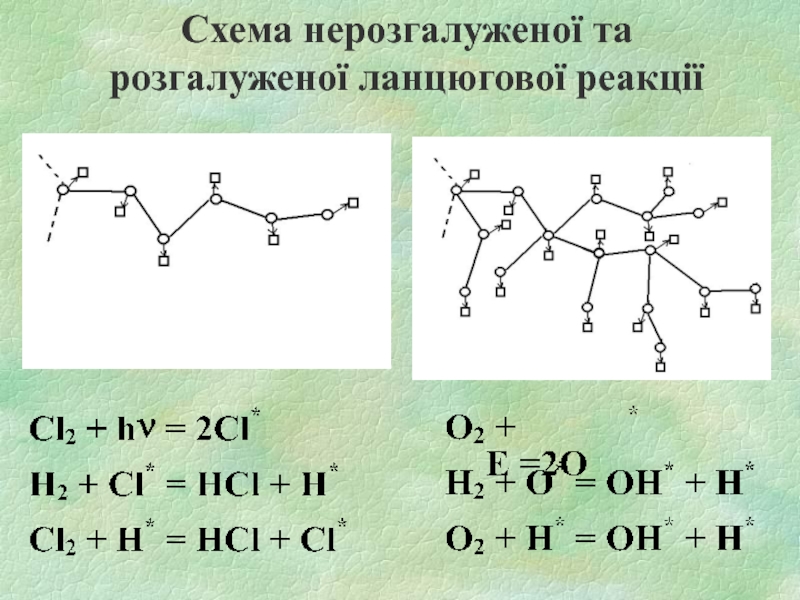
- 17. Схема нерозгалуженої та розгалуженої ланцюгової реакції
- 18. Швидкість ланцюгової реакції: ωлр = ωо
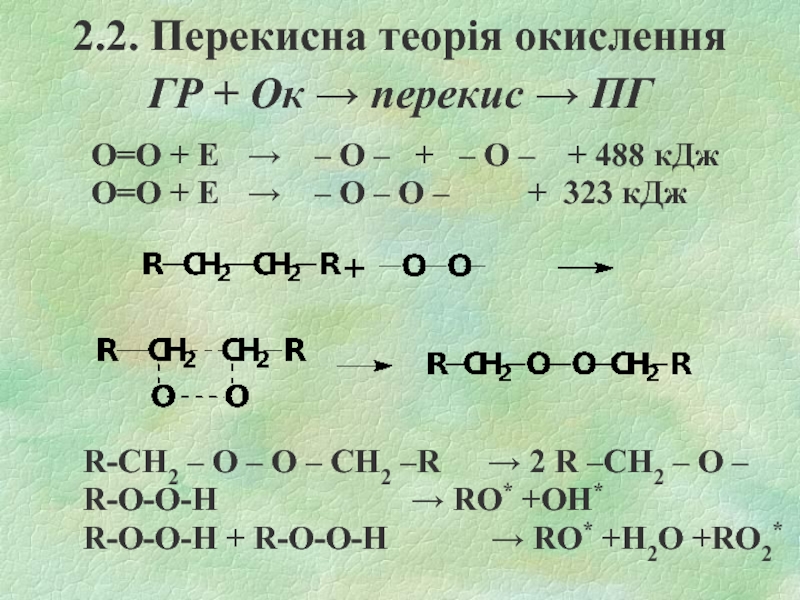
- 19. 2.2. Перекисна теорія окислення ГР
- 20. Пожежна небезпека органічних перекисей 1. Сильні
- 21. Завдання на самопідготовку: 1. Вивчити теоретичний матеріал
Слайд 2План лекції
1. Будова полум’я
1.1. Зони полум’я
1.2. Температурний режим полум’я
1.3. Колір
дифузійного полум’я
2. Основні теорії, що пояснюють процеси в полум’ї
2.1. Перекісна теорія окислення
2.2. Ланцюгова теорія окислення
2. Основні теорії, що пояснюють процеси в полум’ї
2.1. Перекісна теорія окислення
2.2. Ланцюгова теорія окислення
Слайд 31. БУДОВА ПОЛУМ’Я
Полум’я – це газовий об’єм, в якому відбуваються всі
процеси, що пов’язані з підготовкою горючої суміші до горіння і сам процес горіння.
Види полум'я:
кінетичне та дифузійне;
ламінарне та турбулентне.
Висота ламінарного полум'я:
де w - швидкість витікання газу;
d - діаметр пальника;
D - коефіцієнт дифузії.
Види полум'я:
кінетичне та дифузійне;
ламінарне та турбулентне.
Висота ламінарного полум'я:
де w - швидкість витікання газу;
d - діаметр пальника;
D - коефіцієнт дифузії.
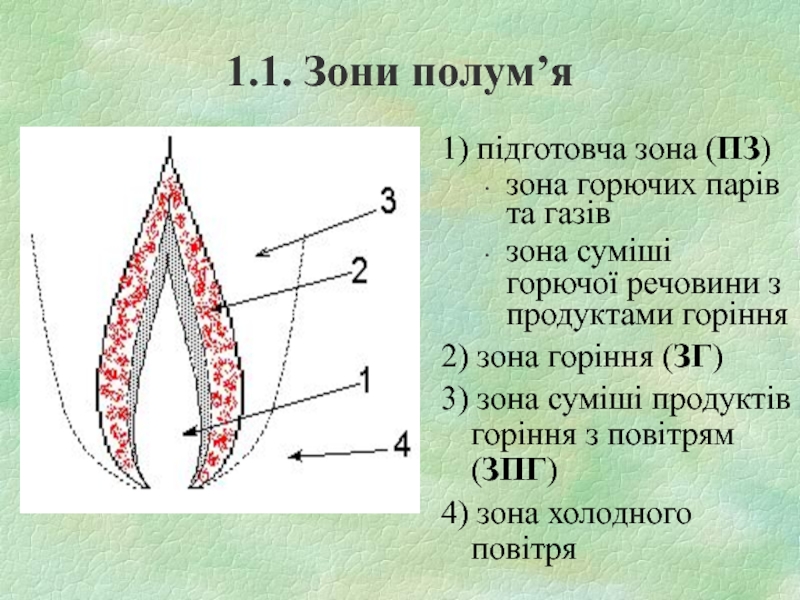
Слайд 41.1. Зони полум’я
1) підготовча зона (ПЗ)
зона горючих парів та газів
зона суміші
горючої речовини з продуктами горіння
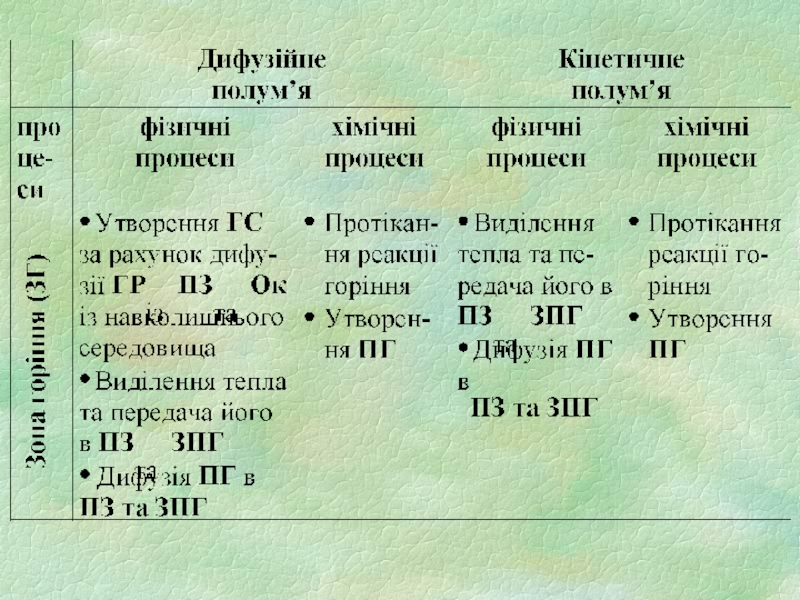
2) зона горіння (ЗГ)
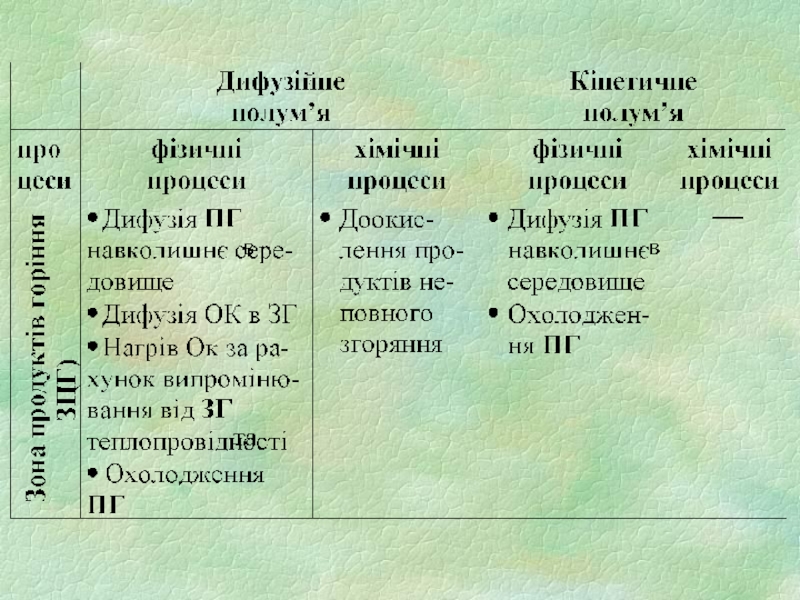
3) зона суміші продуктів горіння з повітрям (ЗПГ)
4) зона холодного повітря
2) зона горіння (ЗГ)
3) зона суміші продуктів горіння з повітрям (ЗПГ)
4) зона холодного повітря
Слайд 10Температура в ПЗ значно нижча, ніж в ЗГ.
Температура ЗГ найбільша, але
неоднакова в різних по висоті точках полум’я. Пояснюється це зміною складу суміші в зоні горіння та витратами тепла на нагрів компонентів, які поступають в цю зону.
Температура в ЗПГ падає за рахунок розбавлення гарячих продуктів горіння холодним повітрям, яке дифундує із навколишнього середовища.
Температура дифузійного полум’я завжди менша, ніж кінетичного. Це пояснюється тим, що тепловтрати із ЗГ за рахунок випромінювання у кінетичного полум’я значно менші, ніж у дифузійного.
Температура в ЗПГ падає за рахунок розбавлення гарячих продуктів горіння холодним повітрям, яке дифундує із навколишнього середовища.
Температура дифузійного полум’я завжди менша, ніж кінетичного. Це пояснюється тим, що тепловтрати із ЗГ за рахунок випромінювання у кінетичного полум’я значно менші, ніж у дифузійного.
Слайд 111.3. Колір дифузійного полум’я
Термічне розкладання речовин в підготовчій зоні:
СН2О2 = СО+
ОН+ Н ;
С3Н6О = СО +2С +6Н;
С8Н18 = 8С + 18Н
Окислення в зоні горіння:
СО +0,5 О2 = СО2 ;
ОН + 0,5 О2 =Н2О;
Н+ 0,5 О2 = Н2О.
С3Н6О = СО +2С +6Н;
С8Н18 = 8С + 18Н
Окислення в зоні горіння:
СО +0,5 О2 = СО2 ;
ОН + 0,5 О2 =Н2О;
Н+ 0,5 О2 = Н2О.
Слайд 142. ОСНОВНІ ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕСИ В ПОЛУМ’Ї
2.1. Ланцюгова теорія окислення
Активні
центри полум'я (АЦП) − це частки (атоми, радикали чи функціональні групи), які мають енергію, більшу, ніж Еакт , що обумовлює їх високу реакційну спроможність.
Ланцюговими називають процеси, у яких перетворення вихідних речовин у продукти реакції здійснюється шляхом регулярного чергування декількох реакцій за участю АЦП.
Ланцюговими називають процеси, у яких перетворення вихідних речовин у продукти реакції здійснюється шляхом регулярного чергування декількох реакцій за участю АЦП.
Слайд 15ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ
Зародження (ініціювання) ланцюгів - стадія ланцюгової реакції, в якій
утворюються вільні радикали з валентнонасичених молекул:
Н2 + О2 = Н* + НО•2
Продовження ланцюга - стадія ланцюгової реакції, що йде із збереженням вільної валентності (один АЦП вступає в реакцію, внаслідок якої один АЦП утворюється):
ОН* + Н2 = Н2О + Н*
Н2 + О2 = Н* + НО•2
Продовження ланцюга - стадія ланцюгової реакції, що йде із збереженням вільної валентності (один АЦП вступає в реакцію, внаслідок якої один АЦП утворюється):
ОН* + Н2 = Н2О + Н*
Слайд 16Розгалуження ланцюгів - стадія ланцюгового процесу, у якій перетворення активних проміжних
продуктів реакції призводить до збільшення числа вільних радикалів (один АЦП вступає в реакцію, внаслідок якої утворюється два чи більше АЦП):
Н* + О2 = ОН* + *О*
Обрив ланцюга - стадія ланцюгового процесу, що призводить до зникнення вільної валентності.
Н* + ОН* + М = Н2О + М
Н* + О2 = ОН* + *О*
Обрив ланцюга - стадія ланцюгового процесу, що призводить до зникнення вільної валентності.
Н* + ОН* + М = Н2О + М
Слайд 18Швидкість ланцюгової реакції:
ωлр = ωо + ωf – ωg
ωо
- швидкість початкового ініціювання (утворення) АЦП,
ωf - швидкість розгалуження ланцюга;
ωg - швидкість обриву ланцюга.
Умовою виникнення горіння є значне перебільшення швидкості реакції розгалуження над швидкістю обриву ланцюга ωf >> ωg. При цьому загальна швидкість процесу ωлр різко збільшується, реакція окислення переходить у процес горіння.
ωf - швидкість розгалуження ланцюга;
ωg - швидкість обриву ланцюга.
Умовою виникнення горіння є значне перебільшення швидкості реакції розгалуження над швидкістю обриву ланцюга ωf >> ωg. При цьому загальна швидкість процесу ωлр різко збільшується, реакція окислення переходить у процес горіння.
Слайд 192.2. Перекисна теорія окислення
ГР + Ок → перекис → ПГ
O=O + Е → – O – + – O – + 488 кДж
O=O + Е → – O – O – + 323 кДж
R-CH2 – О – О – CH2 –R → 2 R –CH2 – О –
R-O-O-H → RO* +ОН*
R-O-O-H + R-O-O-H → RO* +H2O +RO2*
O=O + Е → – O – O – + 323 кДж
R-CH2 – О – О – CH2 –R → 2 R –CH2 – О –
R-O-O-H → RO* +ОН*
R-O-O-H + R-O-O-H → RO* +H2O +RO2*
Слайд 20Пожежна небезпека органічних перекисей
1. Сильні окисники
С4H100 + 12Н202 =
4СО2+17Н2О - ΔH
2. Легко займаються від малопотужних джерел запалювання та згоряють із великою швидкістю.
3. Чутливі до тертя, удару або нагрівання.
4. Нестабільні в процесі зберігання. Можуть розкладатися за нормальної температури з вибухом.
2. Легко займаються від малопотужних джерел запалювання та згоряють із великою швидкістю.
3. Чутливі до тертя, удару або нагрівання.
4. Нестабільні в процесі зберігання. Можуть розкладатися за нормальної температури з вибухом.
Слайд 21Завдання на самопідготовку:
1. Вивчити теоретичний матеріал
1.1. Демидов, Шандыба, Щеглов:- Горение
и свойства горючих веществ, стор. 48-52
1.2. Демидов, Саушев:- Горение и свойства горючих веществ, с.- 64-70; 95-98.
2. Підготуватися до практичного заняття і лабораторної роботи.
1.2. Демидов, Саушев:- Горение и свойства горючих веществ, с.- 64-70; 95-98.
2. Підготуватися до практичного заняття і лабораторної роботи.