- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
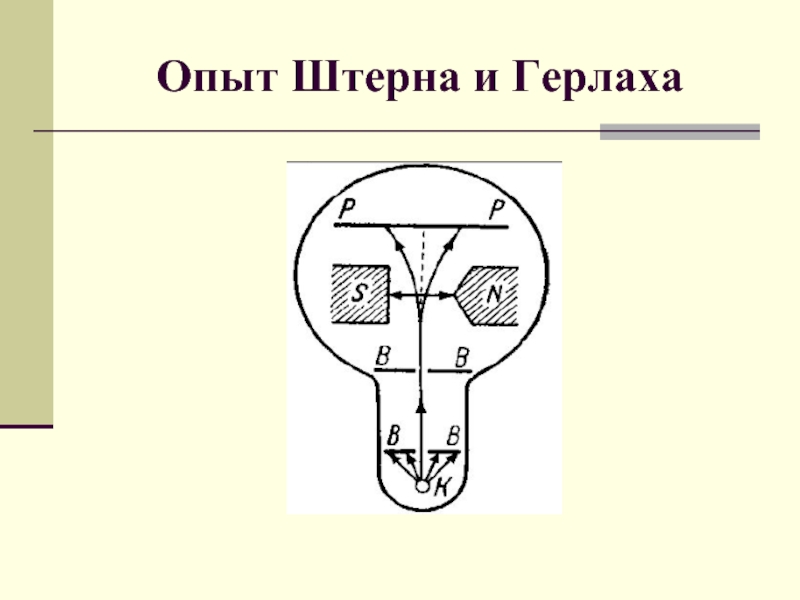
Опыт Штерна и Герлаха презентация
Содержание
- 1. Опыт Штерна и Герлаха
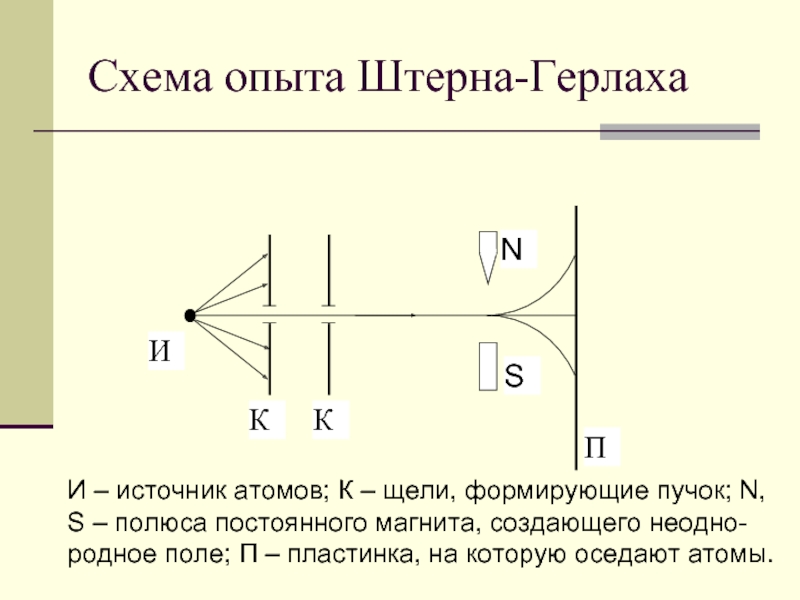
- 2. Схема опыта Штерна-Герлаха И – источник атомов;
- 3. Результаты опыта Штерна-Герлаха
- 4. Спиновое квантовое число (спин) Спин -
- 5. Принцип Паули. Распределение электронов в атоме. Спин электрона
- 6. Состояние электрона в атоме определяется набором квантовых чисел
- 7. Правила отбора Переходы между электронными состояниями возможны
- 8. Принцип Паули В одном и том же
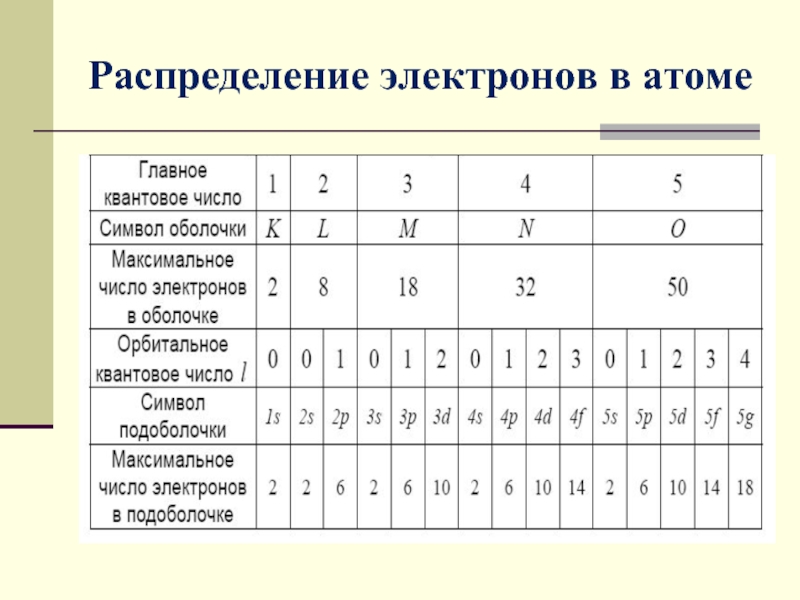
- 9. Распределение электронов в атоме по состояниям Совокупность
- 10. Распределение электронов в атоме
- 11. Линейчатый спектр атома водорода Швейцарский ученый И.
- 12. В дальнейшем (в начале XX в.) в
- 13. В инфракрасной области спектра были обнаружены:
- 14. Все приведенные выше серии в спектре атома
Слайд 2Схема опыта Штерна-Герлаха
И – источник атомов; К – щели, формирующие пучок;
Слайд 4Спиновое квантовое число
(спин)
Спин - собственный механический момент импульса электрона
s
ms = ± ½ - магнитное спиновое квантовое число,
Проекция спина на внешнее магнитное поле квантуется
Д. Уленбек, С.Гаудсмит
Слайд 7Правила отбора
Переходы между электронными состояниями возможны только в том случае, если:
1)
∆l = ± 1
2) изменение ∆m магнитного квантового числа m удовлетворяет условию
∆m = 0, ± 1
Слайд 8Принцип Паули
В одном и том же атоме не может быть более
Z(n, l, m, ms) =0 или 1
Слайд 9Распределение электронов в атоме по состояниям
Совокупность электронов в многоэлектронном атоме, имеющих
Максимальное число электронов, находящихся в состояниях определяемых данным главным квантовым числом, равно
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l
Слайд 11Линейчатый спектр атома водорода
Швейцарский ученый И. Бальмер (1825—1898) подобрал
эмпирическую формулу,
в то время спектральные линии атома водорода в видимой
области спектра:
Слайд 12В дальнейшем (в начале XX в.) в спектре атома водорода было
Слайд 13В инфракрасной области спектра были обнаружены:
серия Пашена
серия Брэкета
серия Пфунда
серия
Слайд 14Все приведенные выше серии в спектре атома водорода могут быть описаны
m имеет в каждой данной серии постоянное значение, m = 1, 2, 3, 4, 5, 6 (определяет серию), n принимает целочисленные значения начиная с m + 1 (определяет отдельные линии этой серии)