- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительный процесс - электролиз презентация
Содержание
- 1. Окислительно-восстановительный процесс - электролиз
- 2. Электролиз – окислительно-восстановительный процесс, протекающий на
- 3. Сl- Сu2+ Сl-
- 4. При электролизе: на отрицательном электроде (катоде) идет
- 5. Электролиз расплавов
- 6. Анодные процессы SO42-
- 7. Электролиз растворов NaCl
- 8. Сравнение величин электродных потенциалов приводит к выводу:
- 9. NaCl → Na+
- 10. Самостоятельная работа Написать суммарное уравнение реакции, уравнения
Слайд 2 Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического
Электролиз – процесс несамопроизвольный, т.е. ∆G > 0
Электрический ток является самым сильным окислителем и самым сильным восстановителем.
Слайд 3
Сl-
Сu2+
Сl-
Сu2+
А (+)
К (-)
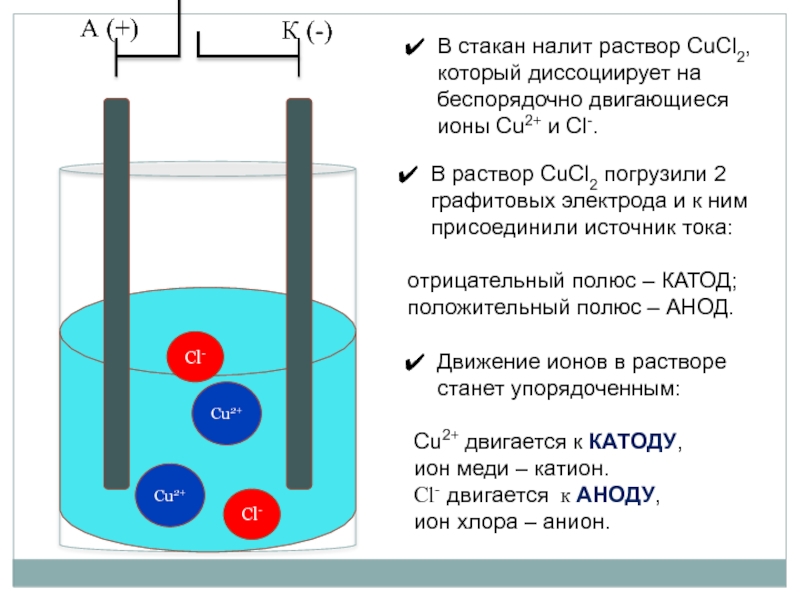
В раствор CuCl2 погрузили 2 графитовых электрода и к
отрицательный полюс – КАТОД;
положительный полюс – АНОД.
В стакан налит раствор CuCl2, который диссоциирует на беспорядочно двигающиеся ионы Cu2+ и Cl-.
Движение ионов в растворе станет упорядоченным:
Cu2+ двигается к КАТОДУ,
ион меди – катион.
Cl- двигается к АНОДУ,
ион хлора – анион.
Слайд 4При электролизе:
на отрицательном электроде (катоде) идет процесс восстановления,
а на положительном
Анодные и катодные процессы зависят от природы электролита (раствор или расплав) и материала, из которого изготовлены электроды (инертный или растворимый электрод).
Слайд 5Электролиз расплавов
K(-) Na+ A(+) Cl-
Na+ → Na0 |*2 2Cl- → Cl20
2Na+ + 2Cl- → Na0 + Cl20
2NaCl → Na0 + Cl20
-1e
+2e
эл. ток
Слайд 6Анодные процессы
SO42- -2e → SO2 + O2
4PO43--12e → 2P2O5 + 3O2
2SiO32- -2e → 2SiO2 + O2
2CO32- -2e → 2CO2 + O2
Слайд 7Электролиз растворов
NaCl → Na+ + Cl-
1) на аноде более вероятен тот процесс, для которого электродный потенциал меньше;
2) на катоде более вероятен тот процесс, для которого электродный потенциал больше.
Слайд 8Сравнение величин электродных потенциалов приводит к выводу:
Катодный процесс:
1. В растворах солей
2. В растворах солей металлов, стоящих в ЭХН правее водорода, происходит восстановление металла.
3. В растворах солей металлов, находящихся между Al и Н2, возможно одновременное восстановление металла и молекул воды
Анодный процесс:
1. В растворах, содержащих анионы кислородсодержащих кислот, происходит анодное окисление воды.
2. В растворах, содержащих анионы бескислородных кислот (кроме F-), происходит анодное окисление аниона.
Слайд 9 NaCl → Na+ + Cl-
K(-)
2H2O - 2e→H2 + 2OН- 2Cl- +2е→Cl20
2H2O + 2Cl- →Н2 + 2ОH- + Сl2
2H2O + 2NaCl →Н2 + 2NaОH + Сl2
Электролиз раствора NaCl
Слайд 10Самостоятельная работа
Написать суммарное уравнение реакции, уравнения катодных и анодных процессов, происходящих
Вариант 1 ZnSO4
Вариант 2 NiCl2
Вариант 3 MgSO4
Вариант 4 AlCl3
Вариант 5 AgNO3
Вариант 6 FeCl3