Осадження (сумісне осадження)
Золь-гель процес
Гідроліз
Термогідролізліз
Гідротермальний
синтез
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Одержання нанопорошків з гідроксидів презентация
Содержание
- 1. Одержання нанопорошків з гідроксидів
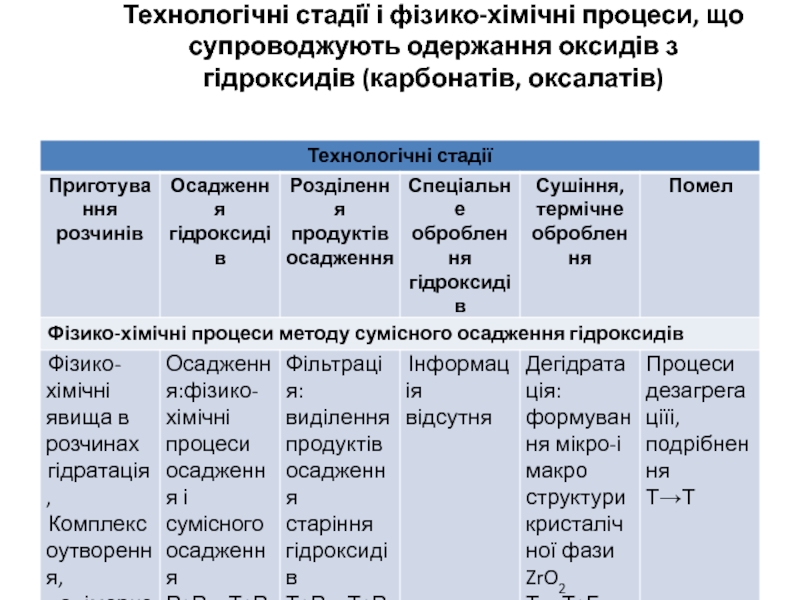
- 2. Технологічні стадії і фізико-хімічні процеси, що супроводжують одержання оксидів з гідроксидів (карбонатів, оксалатів)
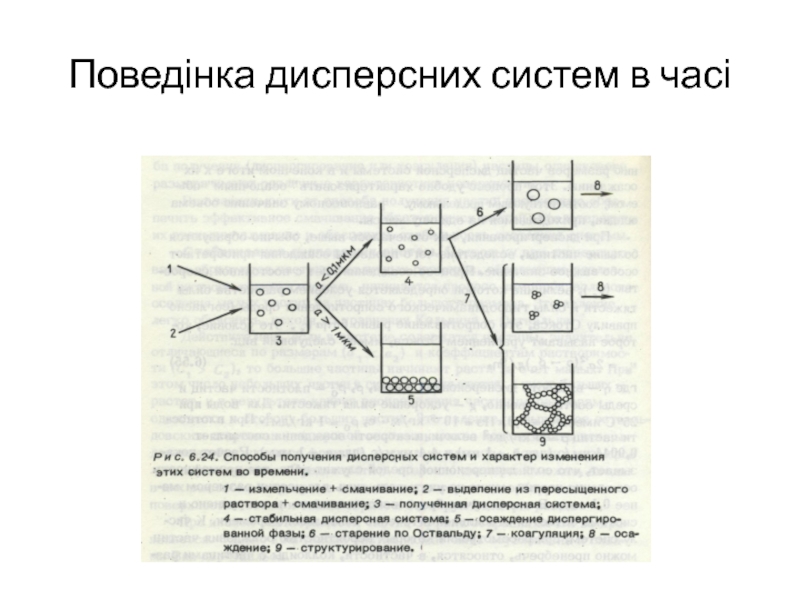
- 3. Поведінка дисперсних систем в часі
- 4. Получение материалов в золь-гель технологии
- 5. Понятия геля Гель из полимерного золя образуется
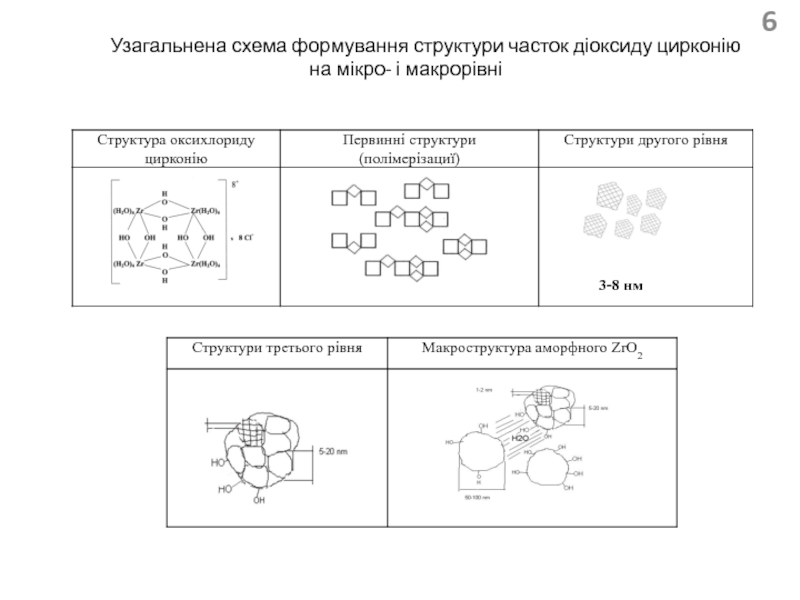
- 6. Узагальнена схема формування структури часток діоксиду цирконію на мікро- і макрорівні
- 7. Структура гідроксокомплексів Zr(IV) в водних розчинах (аналіз
- 8. Дані розшифровки структури аморфного діоксиду цирконію Дані
- 9. Узагальнена схема структурно-хімічних перетворень водних розчинів цирконію
- 10. Схема шляхів формування мікроструктури
- 11. Технологічна схема формовки мікросфер
- 12. Алкоксидный метод золь-гель синтеза
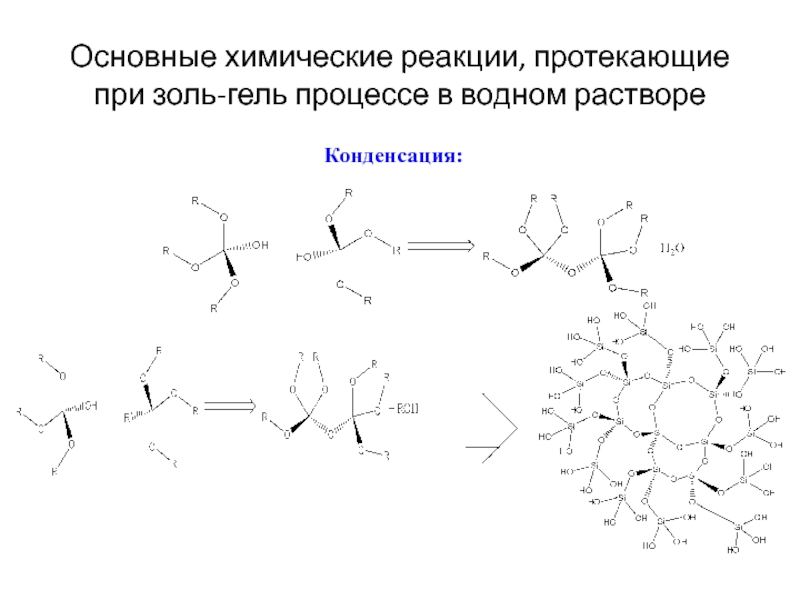
- 13. Основные химические реакции, протекающие при золь-гель процессе в водном растворе Конденсация:
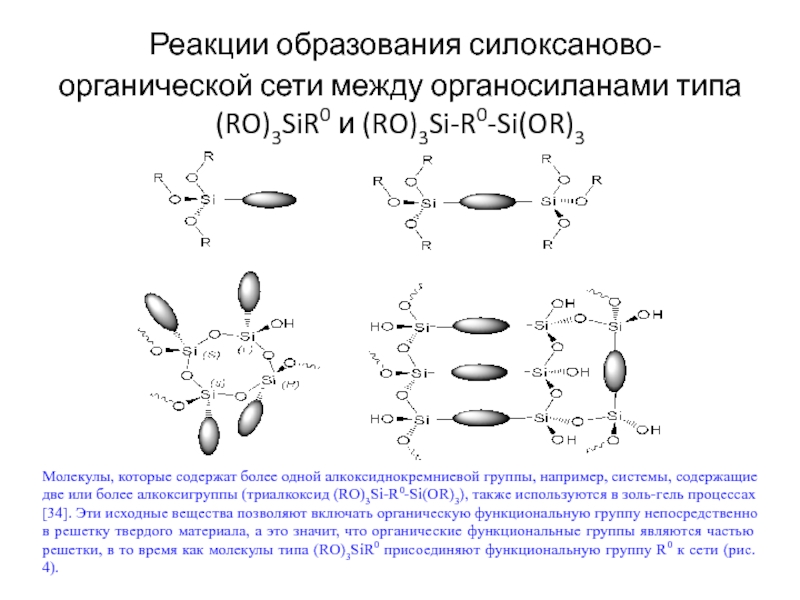
- 14. Реакции образования силоксаново-органической сети между органосиланами
- 15. Коллоидный метод золь–гель синтеза Коллоидный метод золь–гель
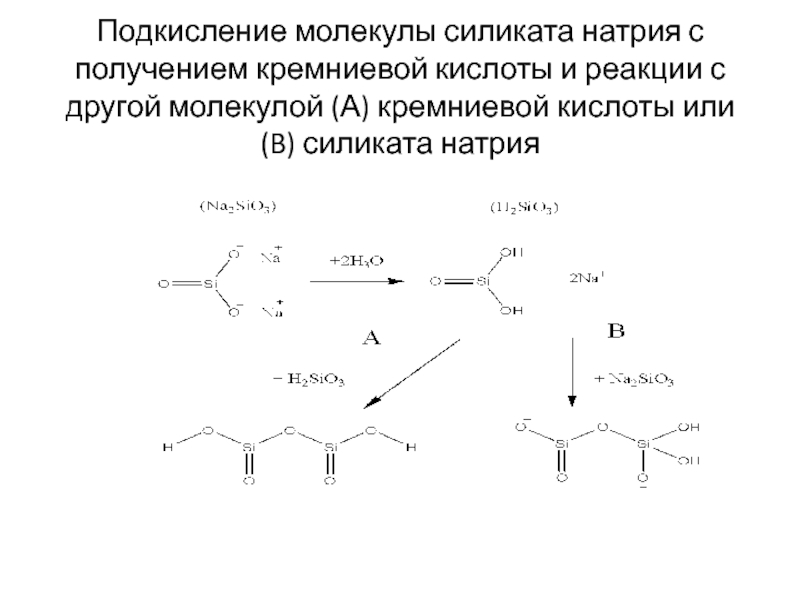
- 16. Подкисление молекулы силиката натрия с получением кремниевой
- 17. ТЕКСТ Основная стадия в процессе образования геля
Слайд 1Методи одержання нанорозмірних порошків, основані на утворенні та переробці гідроксидів (карбонатів,
Слайд 2 Технологічні стадії і фізико-хімічні процеси, що супроводжують одержання оксидів з гідроксидів
Слайд 5Понятия геля
Гель из полимерного золя образуется в процессе полимеризации мономеров и
Гель из коллоидного золя образуется по другому механизму. Частицы дисперсной фазы (мицеллы) под воздействием дисперсионных сил притяжения взаимодействуют друг с другом, образуя остов неорганического полимера.
Дать определение геля, исходя из типа химических связей и взаимодействий, не представляется возможным^ поскольку в зависимости от типа золя в золь-гель-системе происходят совершенно разные химические и физические процессы. Для полимерных гелей характерно наличие ковалентных связей между молекулами и фрагментами молекул, образующих гигантский кластер. Коллоидные гели создаются, как правило, за счет ван-дер-ваальсовых сил притяжения между агрегатами. При этом в коллоидных системах эти связи могут быть обратимыми, то есть могут разрушаться в процессе встряхивания, а затем восстанавливаться. В полимерных системах ковалентные связи являются постояннодействующими.
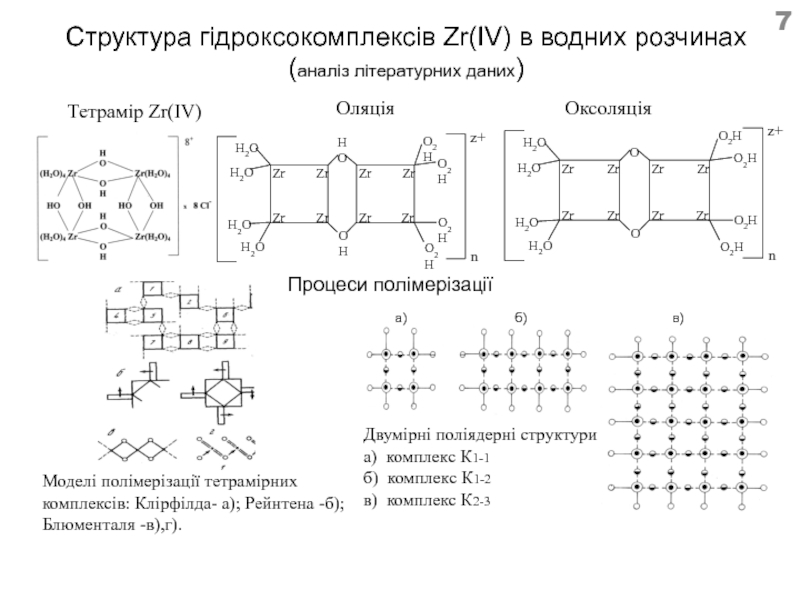
Слайд 7Структура гідроксокомплексів Zr(IV) в водних розчинах
(аналіз літературних даних)
Тетрамір Zr(IV)
Оляція
Оксоляція
Процеси полімерізації
Моделі полімерізації
Двумірні поліядерні структури
а) комплекс К1-1
б) комплекс К1-2
в) комплекс К2-3
а)
б)
в)
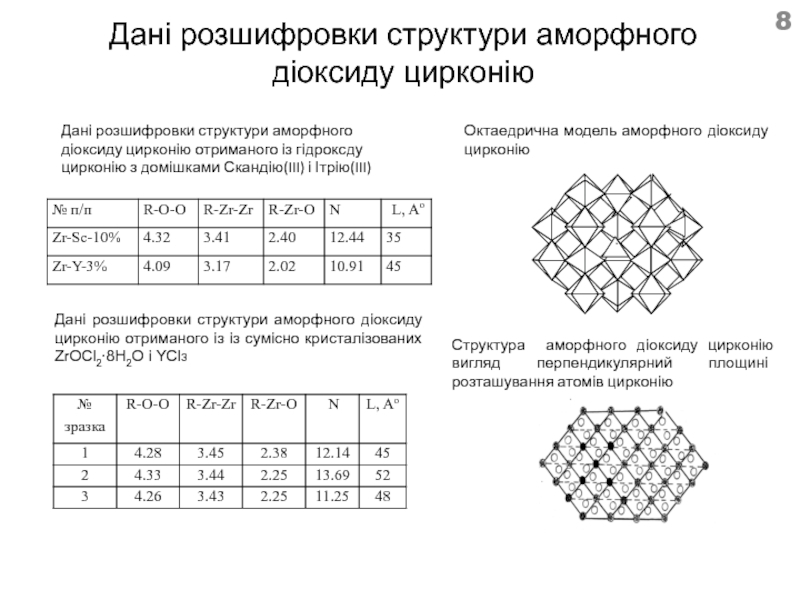
Слайд 8Дані розшифровки структури аморфного діоксиду цирконію
Дані розшифровки структури аморфного діоксиду цирконію
Дані розшифровки структури аморфного діоксиду цирконію отриманого із гідроксду цирконію з домішками Скандію(III) і Ітрію(III)
Октаедрична модель аморфного діоксиду цирконію
Структура аморфного діоксиду цирконію вигляд перпендикулярний площині розташування атомів цирконію
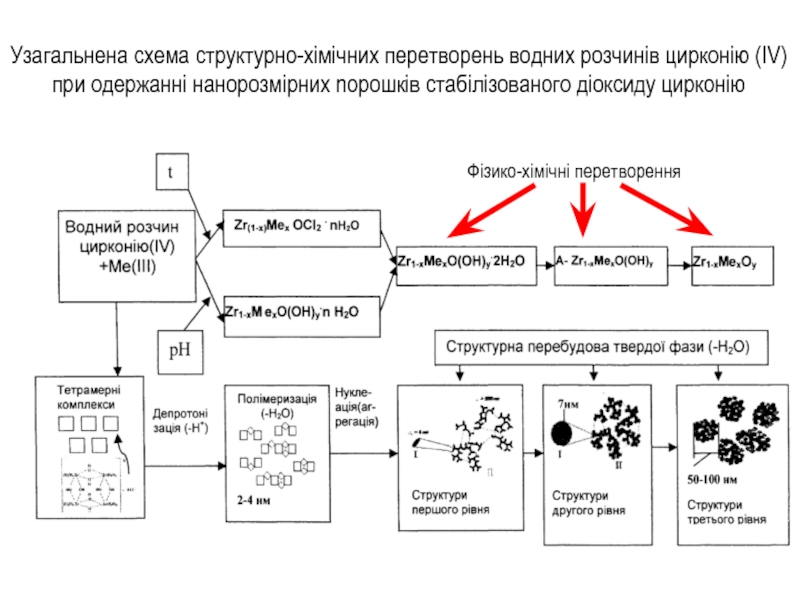
Слайд 9Узагальнена схема структурно-хімічних перетворень водних розчинів цирконію (IV) при одержанні нанорозмірних
Фізико-хімічні перетворення
Слайд 10
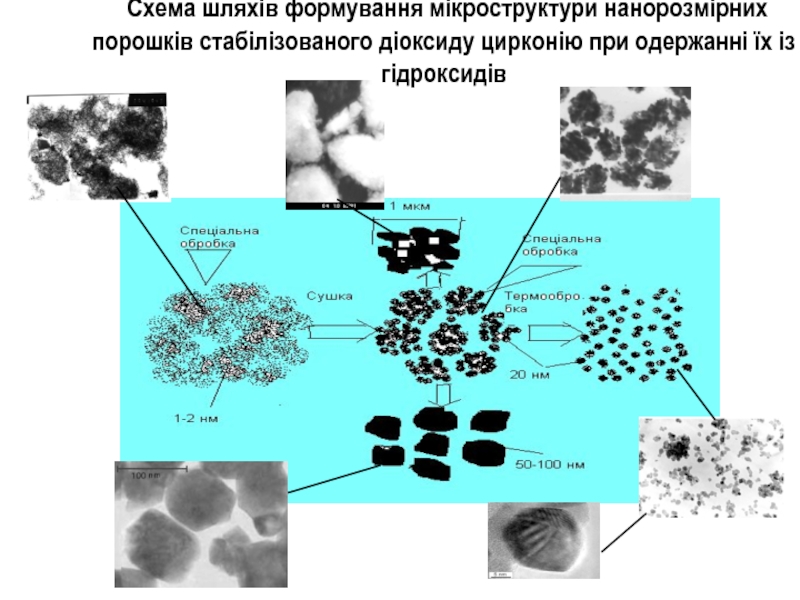
Схема шляхів формування мікроструктури нанорозмірних порошків стабілізованого діоксиду цирконію при
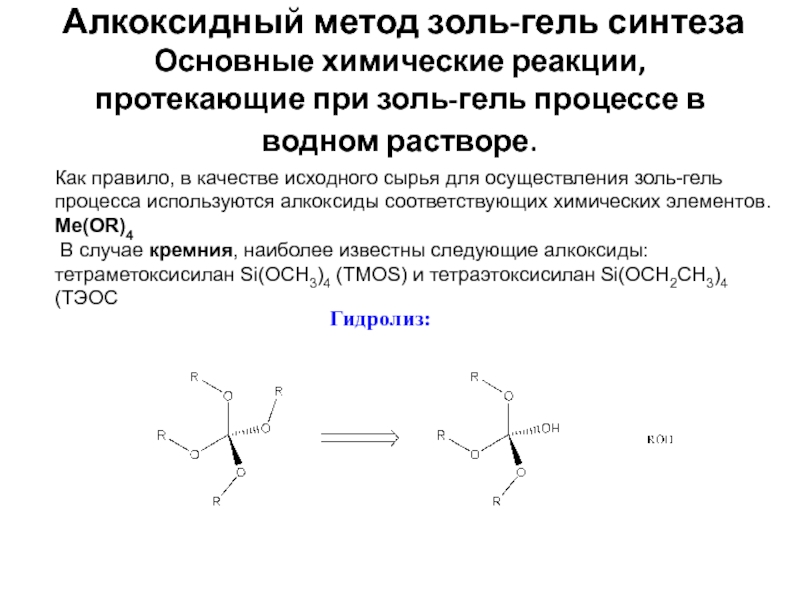
Слайд 12 Алкоксидный метод золь-гель синтеза Основные химические реакции, протекающие при золь-гель
Гидролиз:
Как правило, в качестве исходного сырья для осуществления золь-гель процесса используются алкоксиды соответствующих химических элементов. Ме(OR)4
В случае кремния, наиболее известны следующие алкоксиды: тетраметоксисилан Si(OCH3)4 (TMOS) и тетраэтоксисилан Si(OCH2CH3)4 (ТЭОС
Слайд 13Основные химические реакции, протекающие при золь-гель процессе в водном растворе
Конденсация:
Слайд 14 Реакции образования силоксаново-органической сети между органосиланами типа (RO)3SiR0 и (RO)3Si-R0-Si(OR)3
Молекулы,
Слайд 15Коллоидный метод золь–гель синтеза
Коллоидный метод золь–гель синтеза включает в себя как
• использование готовых агрегативно устойчивых золей поликремниевой кислоты с разными размерами частиц от 5 до 100 нм;
• низкая стоимость кремнийсодержащего прекурсора
возможность использования различных модифицирующих агентов, способствующих изменению адгезионных, прочностных, электрических и других свойств получаемого материала.
Термин «коллоидный кремнезем» относится к стабильным дисперсиям, состоящим из дискретных частиц аморфного кремнезема (SiO2). Его обычно считают гидрофильным золем, поскольку частицы стабилизируются посредством «сольватации» или «гидратации». Такое определение исключает растворы поликремниевых кислот, в которых полимерные молекулы или частицы настолько малы, что оказываются нестабильными. В водном растворе кремнезем при t=25
Слайд 16Подкисление молекулы силиката натрия с получением кремниевой кислоты и реакции с