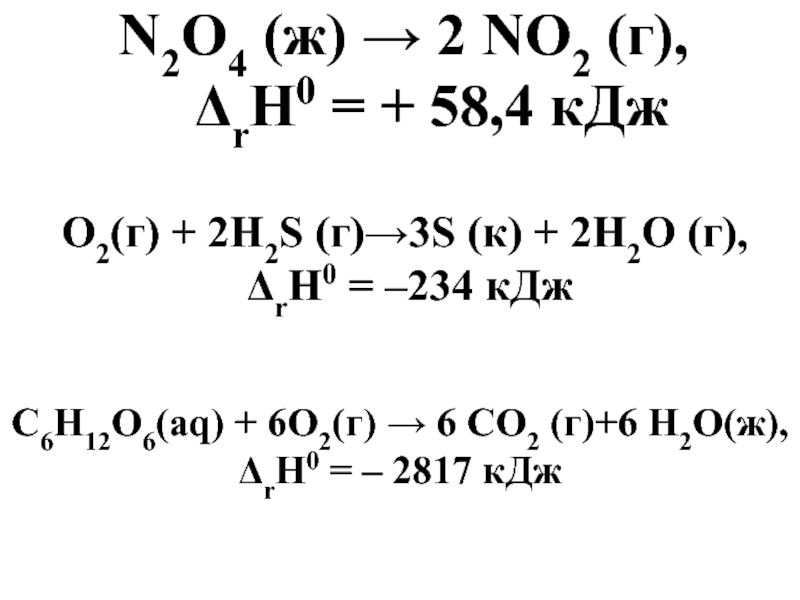- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия презентация
Содержание
- 1. Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия
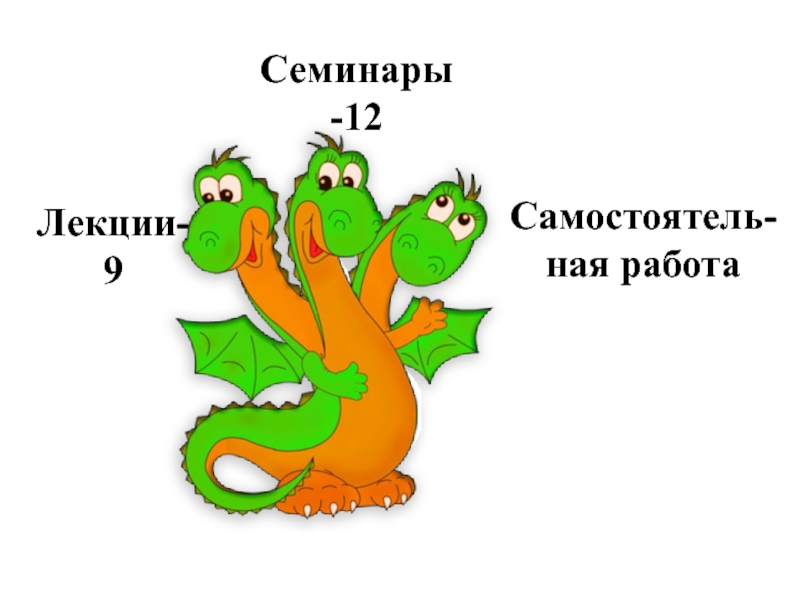
- 2. Лекции-9 Семинары-12 Самостоятель-ная работа
- 3. Химическая термодинамика раздел химии, изучающий взаимные превращения
- 4. Лекция 1 Первый закон термодинамики. Термохимия
- 5. П Л А Н 1.1 Основные понятия
- 6. 1.1 ЭНЕРГИЯ – способность совершать работу (кДж, ккал) 1 ккал = 4,184 кДж
- 7. Виды энергии Потенциальная -энергия взаимодействия Кинетическая -энергия движения
- 8. По видам совершаемых работ различают: химическую, электрическую, световую,
- 9. По видам совершаемых работ различают: механическую, звуковую, поверхностную, и др. виды энергии
- 10. Работа (А) – это способ превращения одного
- 11. Важнейшими видами полезной работы в организме
- 12. 2) осмотическая работа почек и цитоплазматических мембран по переносу веществ против градиента концентраций,
- 13. 3) электрическая работа нервной ткани и мозга по переносу заряженных частиц.
- 14. ТЕПЛОТА (Q) – перенос энергии между двумя телами, имеющими разные температуры.
- 15. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА – это тело или
- 17. ОТКРЫТЫЕ СИСТЕМЫ обмениваются с окружающей средой и
- 18. За 40 лет человек потребляет ~40 т
- 19. ЗАКРЫТЫЕ СИСТЕМЫ обмениваются с окружающей средой только энергией; обмен веществом отсутствует (запаянная ампула)
- 20. ИЗОЛИРОВАННЫЕ СИСТЕМЫ
- 21. Термодинамическое описание системы включает: набор
- 22. набор термодина-мических функций, описывающих способность системы совершать работу.
- 23. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ
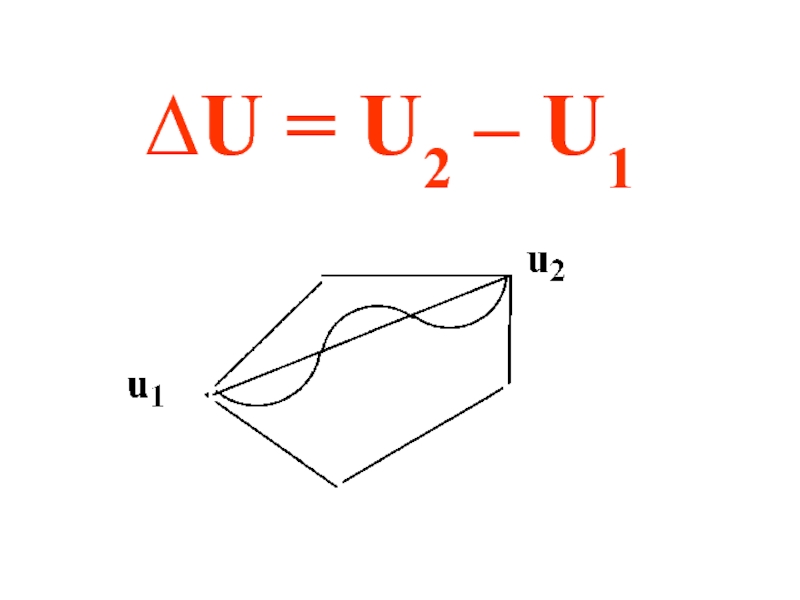
- 24. Примером функции состояния является внутренняя энергия системы
- 25. ∆U = U2 – U1
- 26. 1.2 Первый закон термодинамики является выражением всеобщего
- 27. В организме человека превращение одного вида энергии
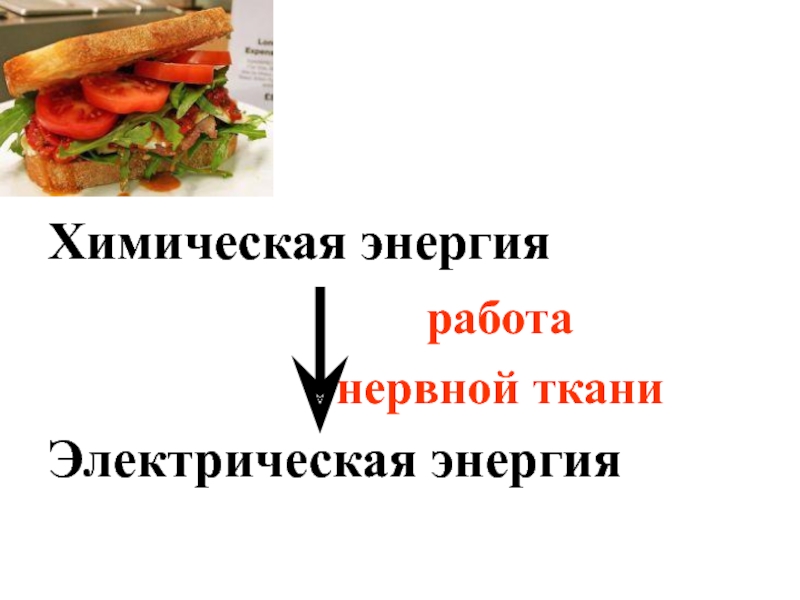
- 28. Химическая энергия работа нервной ткани Электрическая энергия
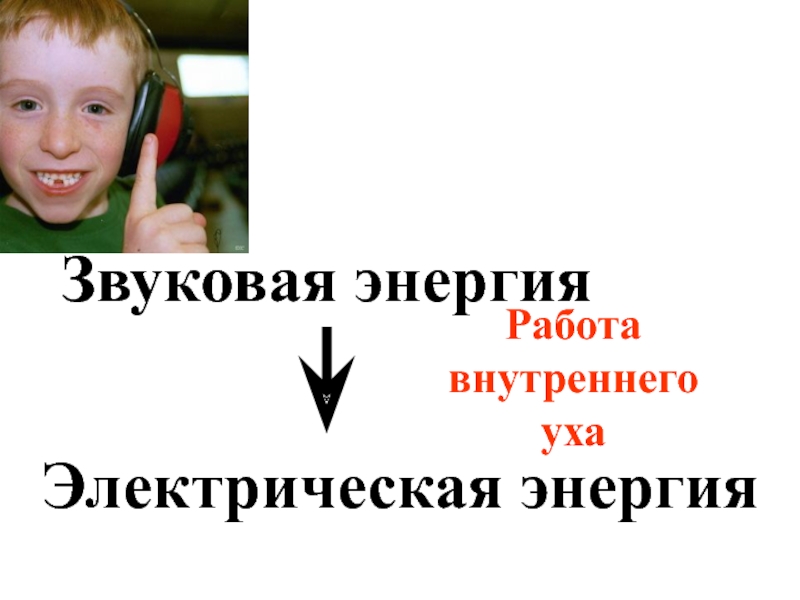
- 29. Звуковая энергия Электрическая энергия Работа внутреннего уха
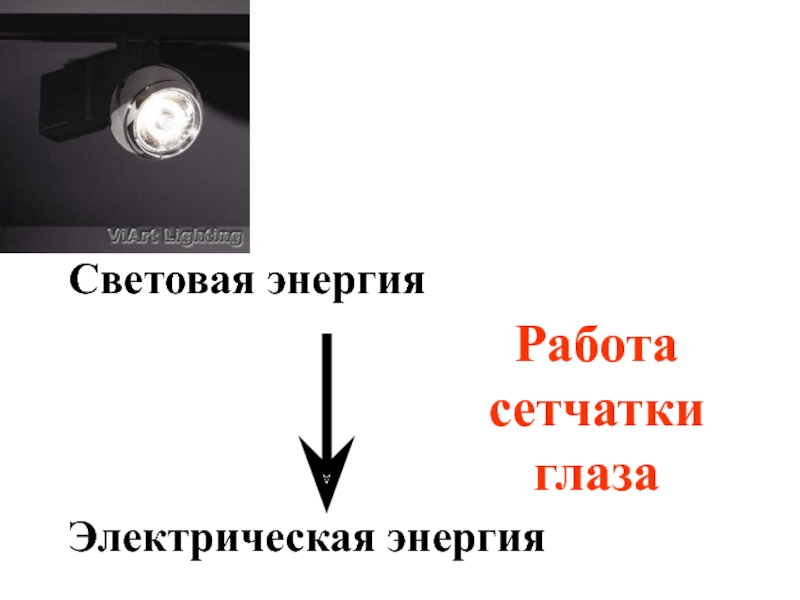
- 30. Световая энергия Электрическая энергия Работа сетчатки глаза
- 31. Первый закон термодинамики не имеет доказательств, но
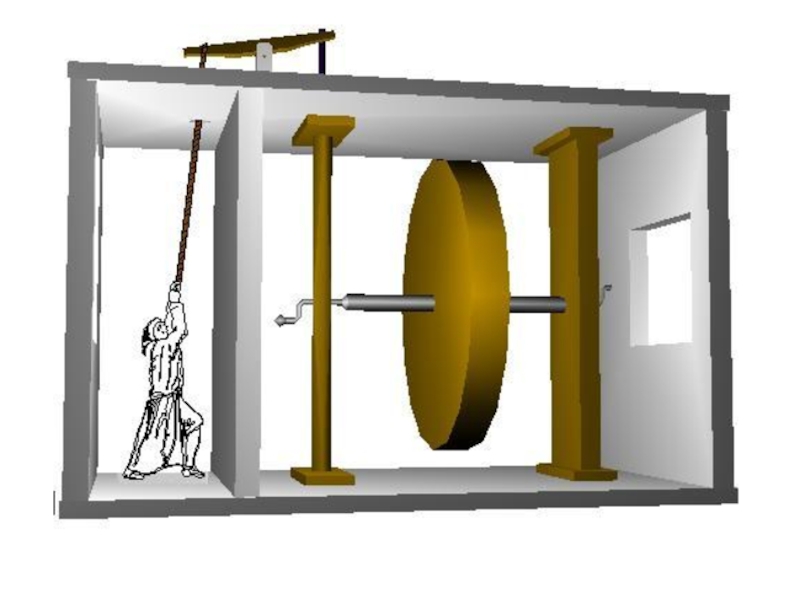
- 32. Вечный двигатель первого рода
- 33. Первые проекты вечного двигателя появились в 13
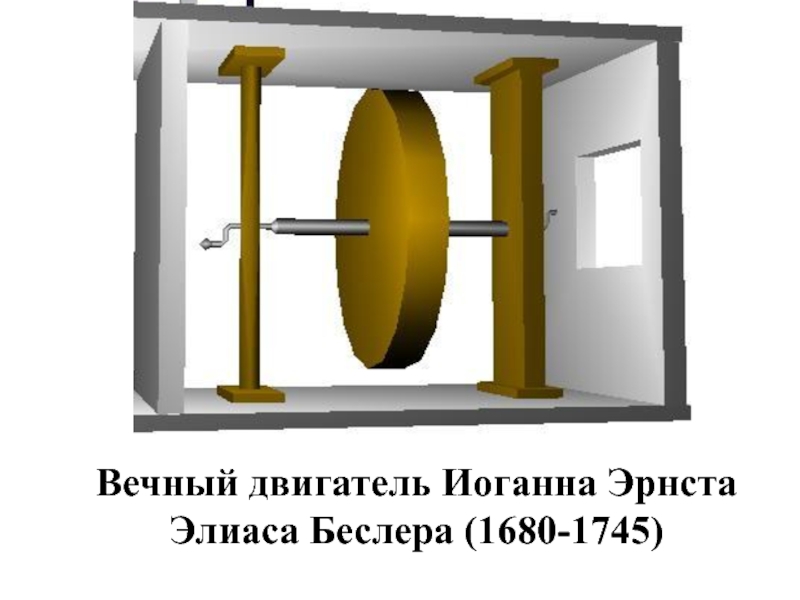
- 34. Вечный двигатель Иоганна Эрнста Элиаса Беслера (1680-1745)
- 36. Математическое выражение первого закона термодинамики для различных
- 37. 2. Теплота, подводимая к закрытой системе, расходуется
- 38. Для изобарного процесса
- 39. Соответственно Qр = H2 – H1 =
- 40. 3. Внутренняя энергия открытой системы возрастает как
- 41. 1.3 Термохимия – раздел химической термодинамики,
- 42. ΔrH0298 – это стандартная теплота реакции
- 43. Уравнения химических реакций, в которых указаны тепловые эффекты и агрегатное состояние веществ называются термохимическими уравнениями.
- 44. N2O4 (ж) → 2 NO2 (г),
- 45. Герман Гесс (1802 - 1850) Центральным
- 46. Тепловой эффект химической реакции, протекающей
- 47. Закон Гесса есть следствие первого закона термодинамики.
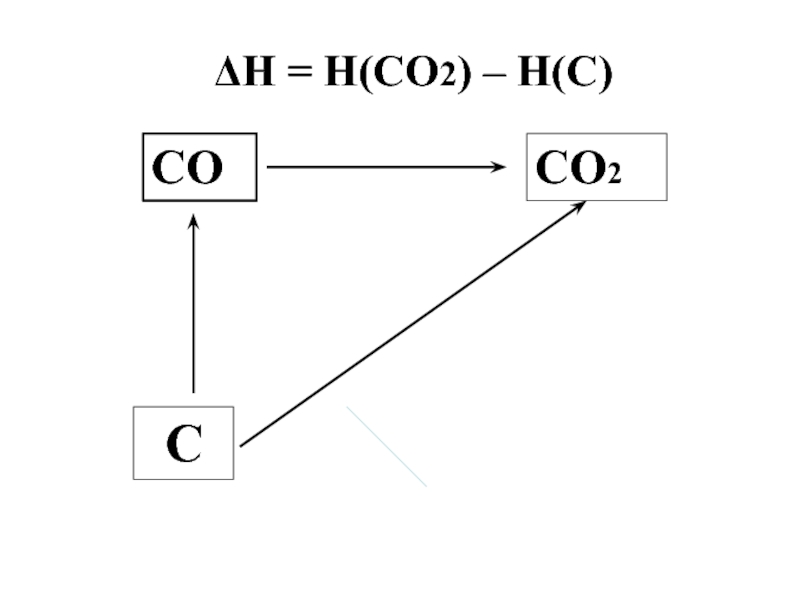
- 48. С СО2 СО ΔH = H(CO2) – H(C)
- 49. Следствия из закона Гесса: 1. Расчет
- 50. Стандартные теплоты образования простых веществ в их наиболее устойчивых формах равны нулю.
- 51. Для условной химической реакции: аА
- 52. 2. Расчет теплового эффекта химической реакции по
- 53. Для условной реакции: ΔrH =
- 54. Термохимия является основой диетологии, науки о рацио-нальном
- 55. Калорийность важнейших компонентов пищи Жиры
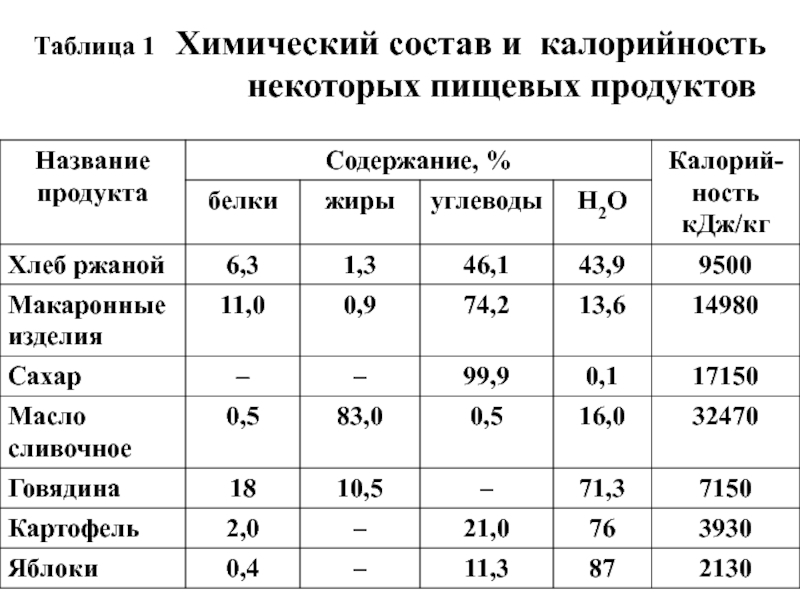
- 56. Таблица 1 Химический состав и калорийность некоторых пищевых продуктов
- 57. Суточная потребность человека в энергии зависит от
- 58. Энергозатраты организма возрастают при различных заболеваниях. Например,
- 59. Мозг человека, как во время сна, так
- 60. Увеличение калорийности пищи при одновременном снижении мышечной
- 61. По данным ВОЗ в мире зарегистрировано 300
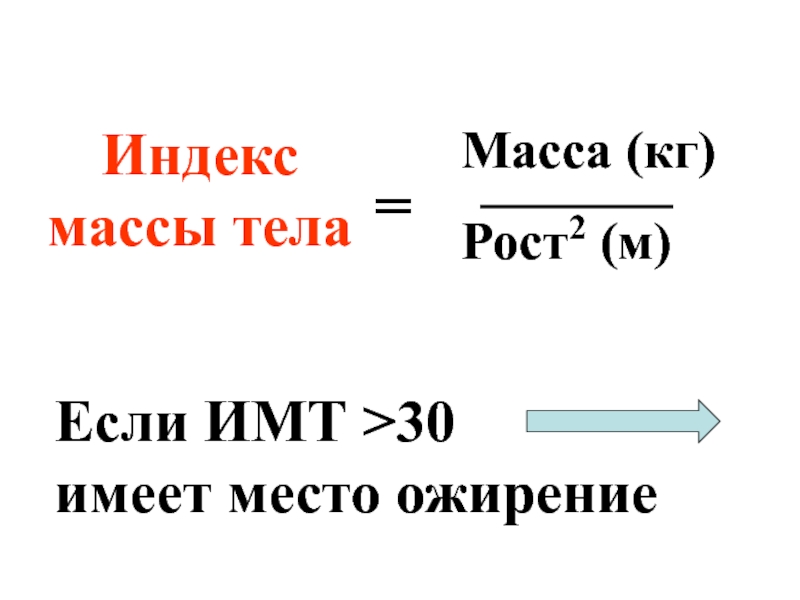
- 64. Индекс массы тела Масса (кг) Рост2 (м)
- 65. Ожирение повышает риск сердечно-сосудистых заболеваний, диабета и рака.
- 66. Благодарим за внимание!!!
Слайд 1Общая химия
- раздел химической науки, изучающий основные законы, описывающие химические процессы,
Слайд 3Химическая термодинамика
раздел химии, изучающий взаимные превращения энергии, теплоты и работы в
Слайд 5П Л А Н
1.1 Основные понятия химической термодинамики
1.2 Первый закон
1.3 Термохимия
Слайд 10Работа (А) – это способ превращения одного вида энергии в другой
Различают: (а) работу расширения газа = р ΔV,
где р - давление, ΔV – изменение объема,
(б) полезную работу А΄
Слайд 11Важнейшими видами полезной работы
в организме являются:
1) механическая работа –
Слайд 122) осмотическая работа почек и цитоплазматических мембран по переносу веществ против
Слайд 15ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА
– это тело или группа тел, отделенных от окружающей
Слайд 17ОТКРЫТЫЕ СИСТЕМЫ обмениваются с окружающей средой и веществом, и энергией (живая
Слайд 18За 40 лет человек потребляет ~40 т воды, 12 млн. л
10 тысяч плиток шоколада и проливает 69 литров слез.
Слайд 19ЗАКРЫТЫЕ СИСТЕМЫ обмениваются с окружающей средой только энергией; обмен веществом отсутствует
Слайд 20ИЗОЛИРОВАННЫЕ СИСТЕМЫ
Слайд 21Термодинамическое описание системы включает:
набор термодинамических параметров:
Т,
изменение которых свидетельствует о протекании термодинамических процессов;
Слайд 23ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ
Функции
состояния процесса
Их изменения зависят от начального и конечного состояния системы и не зависят от числа промежуточных стадий процесса
Их величина зависит от числа промежуточных стадий
A и Q
Слайд 24Примером функции состояния является внутренняя энергия системы (U) – это совокупность
Слайд 261.2 Первый закон термодинамики является выражением всеобщего закона сохранения энергии:
энергия не
Слайд 27В организме человека превращение одного вида энергии в другой сопровождается совершением
Химическая энергия пищи
работа мышц
Механическая энергия
Слайд 31Первый закон термодинамики не имеет доказательств, но является результатом опыта, накопленного
Ярким доказательством его справедливости служит невозможность создания вечного двигателя первого рода.
Слайд 32Вечный двигатель первого рода
Слайд 33Первые проекты вечного двигателя появились в 13 веке
В 1775 году Парижская
Слайд 36Математическое выражение первого закона термодинамики для различных типов систем:
1. Внутренняя энергия
U = const, ΔU = 0
Слайд 372. Теплота, подводимая к закрытой системе, расходуется на увеличение ее внутренней
Q = ΔU + A
или
Q = ΔU + А΄ + pΔV
Слайд 38Для изобарного процесса
Q= ΔU + pΔV = ( U2 – U1) + p( V2 – V1) =
= (U2 + pV2) – (U1 + pV1)
U + pV = Н,
где Н – термодинамическая функция состояния, называемая энтальпией или теплосодержанием системы
Слайд 39Соответственно
Qр = H2 – H1 = ΔH,
где ΔH – тепловой эффект
для экзотермического процесса ΔH < 0,
для эндотермического процесса ΔH > 0
Слайд 403. Внутренняя энергия открытой системы возрастает как при ее нагревании, так
ΔU = Q ± μΔν – A,
где μ – коэффициент пропорциональности, называемый химическим потенциалом,
Δν – изменение количества вещества, моль
Слайд 411.3 Термохимия –
раздел химической термодинамики, изучающий тепловые эффекты химических реакций.
Тепловые
Слайд 42ΔrH0298 – это стандартная теплота реакции
т.е. теплота, измеренная при стандартных
р = 101,3 кПа, СМ = 1 моль/л, рН = 7.
Слайд 43Уравнения химических реакций, в которых указаны тепловые эффекты и агрегатное состояние
Слайд 44N2O4 (ж) → 2 NO2 (г),
ΔrH0 = +
O2(г) + 2H2S (г)→3S (к) + 2H2О (г),
ΔrH0 = –234 кДж
С6Н12О6(aq) + 6О2(г) → 6 СО2 (г)+6 Н2О(ж), ΔrН0 = – 2817 кДж
Слайд 45Герман Гесс
(1802 - 1850)
Центральным законом термохимии является закон, сформулированный в
Слайд 46
Тепловой эффект химической реакции, протекающей при постоянном давлении или объеме,
Закон Гесса (1840)
Слайд 47Закон Гесса есть следствие первого закона термодинамики. Поскольку энтальпия является функцией
ΔH = H2 – H1
Слайд 49Следствия из закона Гесса:
1. Расчет теплового эффекта реакции по теплотам
ΔfH – теплота образования (кДж/моль) – это тепловой эффект образования одного моль сложного вещества из простых веществ.
Слайд 51Для условной химической реакции:
аА + bB → сС + dD
ΔrH
– b ΔfH(В)
Слайд 522. Расчет теплового эффекта химической реакции по теплотам сгорания индиви-дуальных веществ.
ΔсгН
Слайд 54Термохимия является основой диетологии, науки о рацио-нальном питании.
Приведенные теплоты сгорания (кДж/г
Слайд 57Суточная потребность человека в энергии зависит от мышечной нагрузки и составляет:
при
при умеренной и напряженной мышечной работе (студенты, врачи и др.) – 3500 ккал,
при тяжелом физическом труде (литейщики, каменщики и др.) – 4500 ккал,
при особо тяжелом физическом труде (спортсмены) – 7000 ккал.
Слайд 58Энергозатраты организма возрастают при различных заболеваниях. Например, при ревмотоидном артрите энергетическая
Слайд 59Мозг человека, как во время сна, так и в период напряженной
Слайд 60Увеличение калорийности пищи при одновременном снижении мышечной активности являются главными причинами
Ожирение – неинфекционная эпидемия 21 века.