- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Нейтральная частица атом презентация
Содержание
- 1. Нейтральная частица атом
- 2. Электрон в атоме не имеет траектории движения.
- 3. Электроны, находящиеся на орбиталях различного размера, образуют
- 5. От строения электронной оболочки атома в значительной
- 6. Максимальное число электронов на энергетических уровнях и подуровнях атома
- 7. Заполнение уровней и подуровней электронами происходит в
- 8. Исходя из представления о дискретности энергетических состояний
- 9. Частота э/м волн, излучаемых атомом, определяется
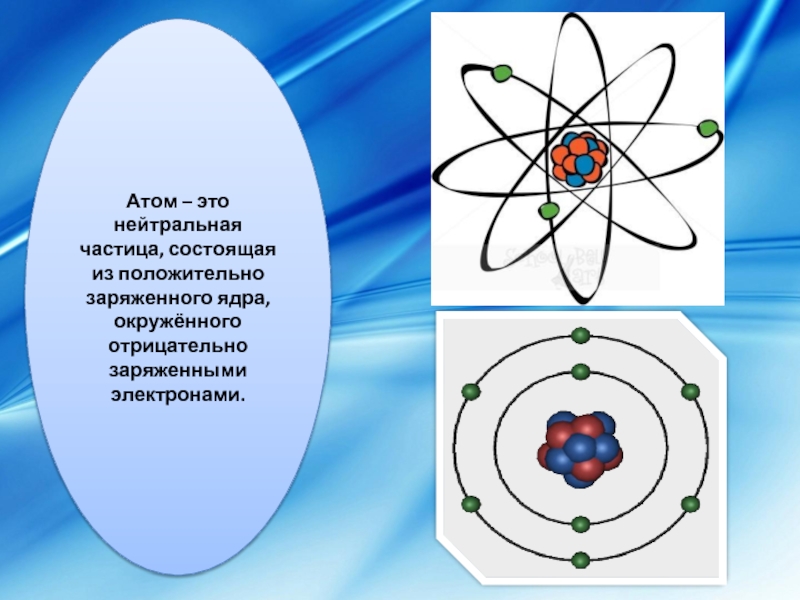
Слайд 1Атом – это нейтральная частица, состоящая из положительно заряженного ядра, окружённого
Слайд 2Электрон в атоме не имеет траектории движения.
Квантовая механика рассматривает вероятность нахождения электрона
Быстро движущийся электрон находится в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако, с определенной плотностью отрицательного заряда
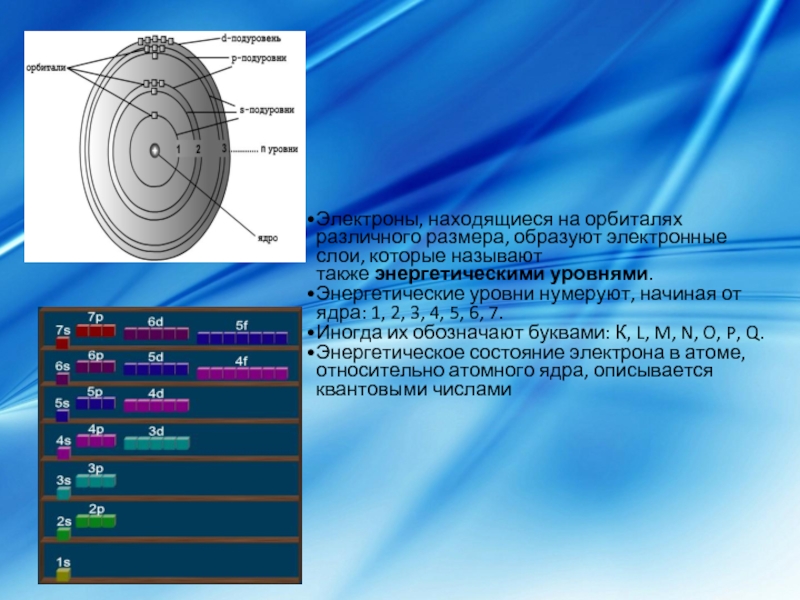
Слайд 3Электроны, находящиеся на орбиталях различного размера, образуют электронные слои, которые называют
Энергетические уровни нумеруют, начиная от ядра: 1, 2, 3, 4, 5, 6, 7.
Иногда их обозначают буквами: К, L, M, N, O, P, Q.
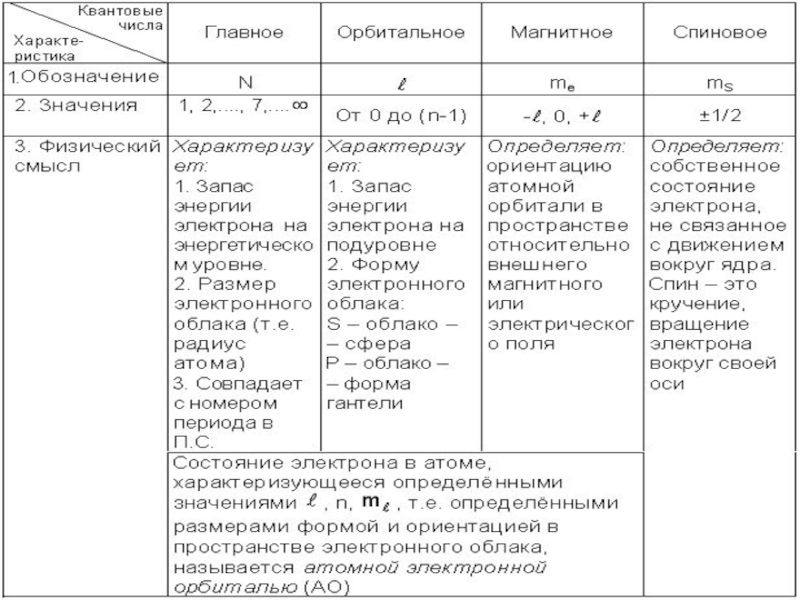
Энергетическое состояние электрона в атоме, относительно атомного ядра, описывается квантовыми числами
Слайд 5От строения электронной оболочки атома в значительной степени зависят свойства химического
Электроны в атоме обладают различной энергией и размещаются на энергетических уровнях и подуровнях в соответствии с принципом Паули, правилом Хунда, правилами Клечковского и принципом наименьшей энергии.
Согласно принципа Паули, в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
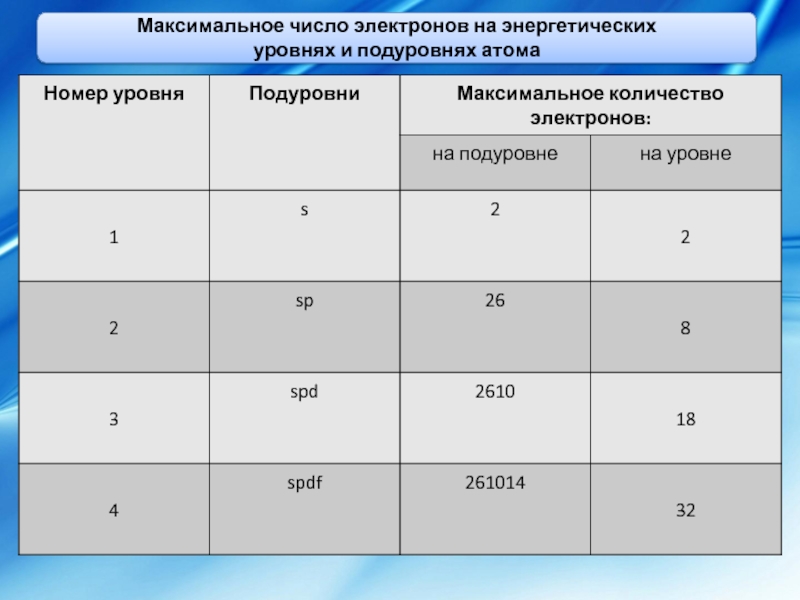
Этот принцип (принцип запрета) позволяет определить максимальное число электронов на уровнях и подуровнях атома
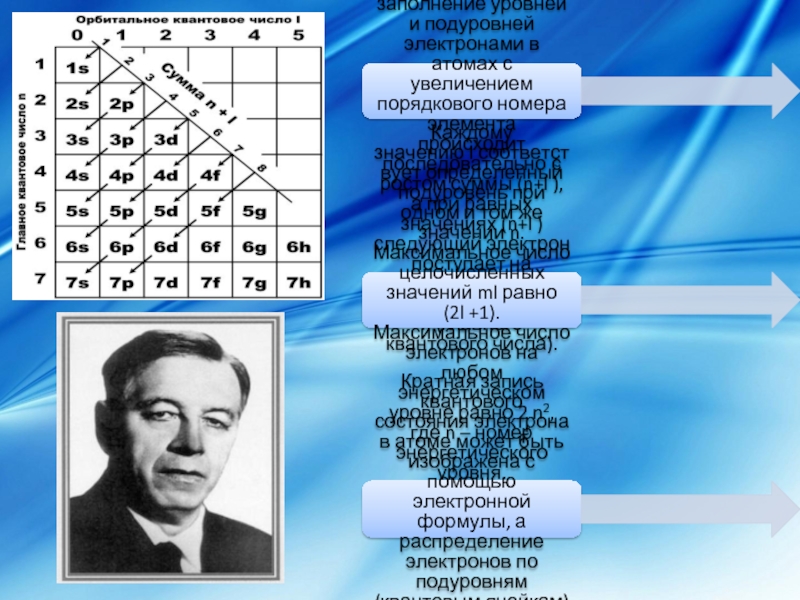
Слайд 7Заполнение уровней и подуровней электронами происходит в соответствии с правилом Клечковского, которое
Каждому значению l соответствует определенный подуровень при одном и том же значении n. Максимальное число целочисленных значений ml равно (2l +1). Максимальное число электронов на любом энергетическом уровне равно 2 n2, где n – номер энергетического уровня.
Кратная запись квантового состояния электрона в атоме может быть изображена с помощью электронной формулы, а распределение электронов по подуровням (квантовым ячейкам) – графической формулой.
Слайд 8Исходя из представления о дискретности энергетических состояний атома Н.Бор в 1913
Слайд 9 Частота э/м волн, излучаемых атомом, определяется не частотой вращения электронов
Постулаты Бора, сохранив в основном модель атома Резерфорда, вместе с тем освободили ее от упомянутых выше недостатков (противоречий опыту).