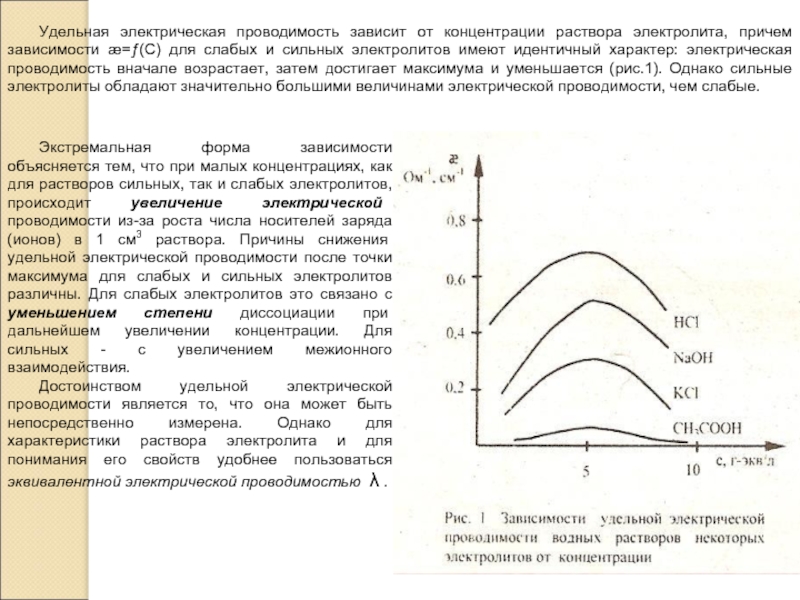
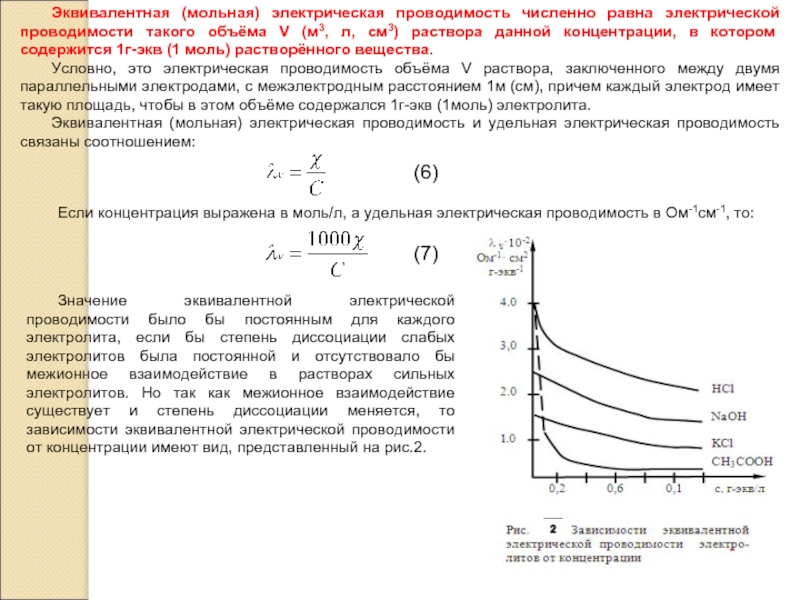
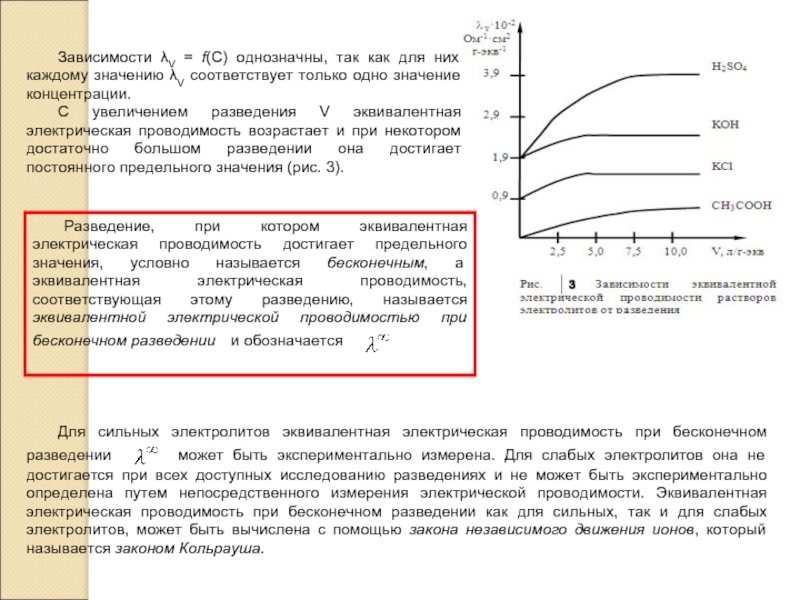
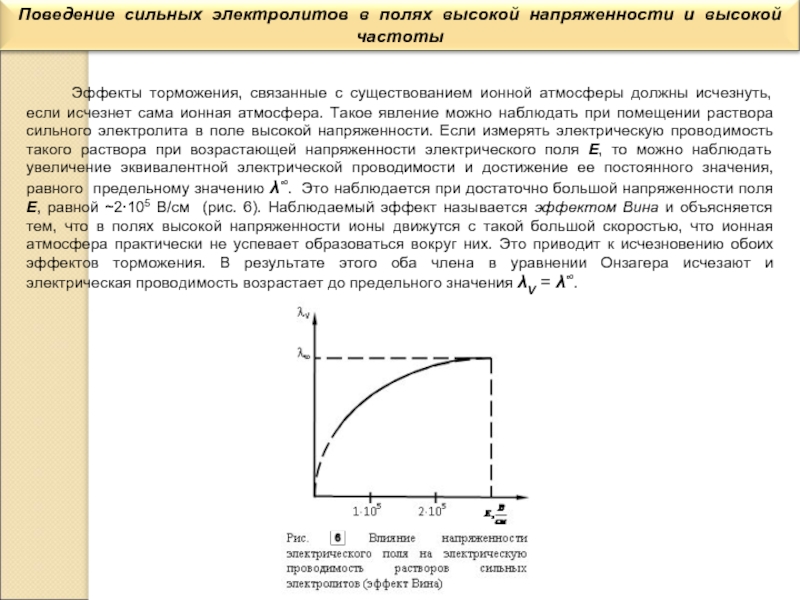
электролита, но для этого необходимо иметь электрохимическую ячейку с электродами, каждый из которых имеет площадь S=1см2 и отстоящими друг от друга на расстоянии l=1 см. В этом случае измеренное сопротивление Rх является удельным сопротивлением ρ раствора электролита и тогда удельная электрическая проводимость æ=1/Rх. Такой метод измерения называется абсолютным.
Абсолютный метод технически трудно осуществим из-за сложности конструирования ячейки со строго заданными геометрическими размерами. Кольраушем этим методом с большой точностью были получены данные по электрической проводимости растворов КСl, NaCl, CsCl различных концентраций при различных температурах. Эти значения послужили справочным материалом для применения более простого – относительного метода.
Ранее было показано, что величина сопротивления раствора, находящегося между электродами, определяется уравнением:
Отношение расстояния между электродами к площади электродов для данной электрохимической ячейки является величиной постоянной, обозначается буквой К и называется постоянной ячейки:
Тогда R= К/æ .
Относительный метод состоит в следующем:
Определение постоянной ячейки К. Для этого измеряют сопротивление стандартного раствора Rст с известной электрической проводимостью æст:
Rст= К/ æст ,
откуда К = æст∙ Rст .
2. Измерение сопротивления Rx исследуемого раствора электролита. Из соотношения R= К/æ следует, что зная К и определив Rх, можно рассчитать электрическую проводимость исследуемого раствора æх:
æх=K/Rх