- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярно-кинетическая теория. Идеальный газ. Уравнение молекулярно-кинетической теории идеального газа. Закон Дальтона презентация
Содержание
- 1. Молекулярно-кинетическая теория. Идеальный газ. Уравнение молекулярно-кинетической теории идеального газа. Закон Дальтона
- 2. 1. Основные положения молекулярно-кинетической теории и их
- 3. Молекулярно-кинетической теорией называется учение о строении и
- 4. Фактом, подтверждающим существование молекул, является возможность
- 5. Единица количества вещества называется молем. Моль
- 6. Она показывает, сколько атомов или
- 7. Молярная масса может быть вычислена через массу
- 8. Модель идеального газа предполагает следующее: молекулы обладают
- 9. На основе использования законов динамики и
- 10. Обозначив среднее значение кинетической энергии поступательного движения Е: получим
- 11. Если сосуд заполнили смесью газов,
- 12. 2. Температура. Связь температуры со скоростью движения молекул. Температурные шкалы
- 13. Состояние системы, при котором макроскопические
- 14. Экспериментальные исследования показали,
- 15. Так как
- 16. Следовательно, средняя кинетическая энергия молекул любых газов,
- 17. В физике обычно температуру измеряют в градусах,
- 18. Шкала измерения температуры в соответствии с
- 19. С введением постоянной Больцмана следует еще одно из уравнений молекулярно-кинетической теории
- 20. Сравнив последнее уравнение с уравнением Получим
- 21. Итак, температура – есть мера
- 22. Исходя из этого, легко рассчитать
- 23. 3. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Изотермический, изохорный и изобарный процессы
- 24. Используя зависимость давления газа от его температуры
- 25. Число молекул газа
- 26. При неизменной массе газа величина Поэтому
- 27. Процессы, происходящие при неизменном значении одного из параметров состояния называются изопроцессами.
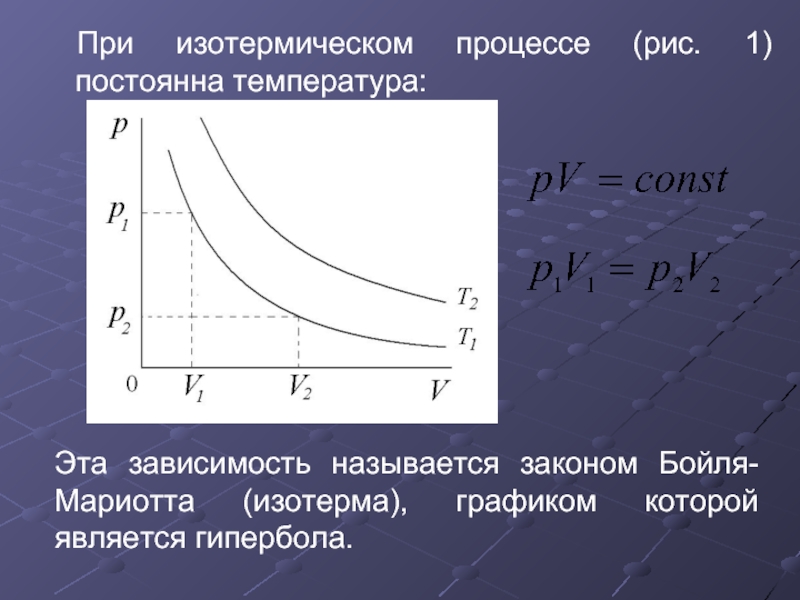
- 28. При изотермическом процессе (рис. 1) постоянна температура:
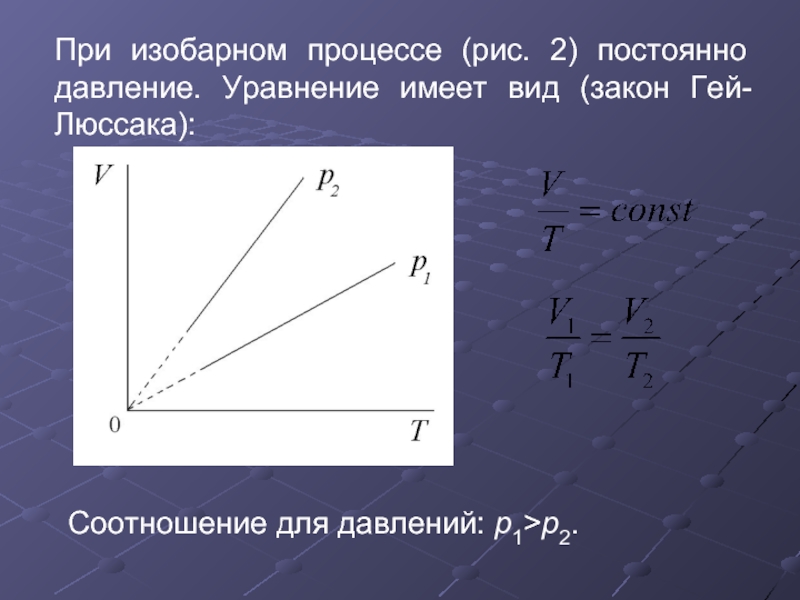
- 29. При изобарном процессе (рис. 2) постоянно давление.
- 30. Выбирая начальное состояние, соответствующее Т0=273К, запишем
- 31. При изохорном процессе (рис. 3) постоянен объем.
- 32. Выбирая начальное состояние, соответствующее Т0=273К, запишем
Слайд 21. Основные положения молекулярно-кинетической теории и их опытное обоснование. Идеальный газ.
Слайд 3Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления
Все тела состоят из частиц: атомов и молекул;
Эти частицы хаотически движутся;
Частицы взаимодействуют друг с другом.
Слайд 4
Фактом, подтверждающим существование молекул, является возможность определить их массу и размеры
Хаотичность движения подтверждается броуновским движением, конечной скоростью диффузии, теплопроводности.
Взаимодействие друг с другом частиц носит электромагнитный характер (силы межмолекулярного взаимодействия – силы притяжения и отталкивания).
Слайд 5
Единица количества вещества называется молем. Моль равен количеству вещества, содержащего столько
Слайд 6
Она показывает, сколько атомов или молекул содержится в одном моле вещества.
где m0 - масса одной частицы.
Слайд 7Молярная масса может быть вычислена через массу молекулы Mr, измеренную в
Слайд 8Модель идеального газа предполагает следующее: молекулы обладают пренебрежимо малым объемом, между
Слайд 9
На основе использования законов динамики и положений молекулярно-кинетической теории было получено
где m0 - масса молекулы; n - концентрация молекул <υ>2- среднее значение квадрата скорости молекул; ρ - плотность газа.
Слайд 11
Если сосуд заполнили смесью газов, то давление смеси равно сумме парциальных
.
Слайд 13
Состояние системы, при котором макроскопические параметры, характеризующие ее, остаются длительное время
Слайд 14
Экспериментальные исследования показали, что для любых газов, находящихся в тепловом равновесии,
Это позволяет принять величину Θ в качестве естественной меры температуры.
Слайд 16Следовательно, средняя кинетическая энергия молекул любых газов, находящихся в тепловом равновесии
Слайд 17В физике обычно температуру измеряют в градусах, принимая, что температура Т
Слайд 18
Шкала измерения температуры в соответствии с этим уравнением называется абсолютной шкалой.
k=1,38∙10-23 Дж/К.
k - постоянная Больцмана. Знание коэффициента k позволило установить связь между абсолютной температурой шкалой и шкалой Цельсия:
T=t+273.
Слайд 19С введением постоянной Больцмана следует еще одно из уравнений молекулярно-кинетической теории
Слайд 21
Итак, температура – есть мера средней кинетическая энергия хаотического движения молекул
Слайд 22
Исходя из этого, легко рассчитать среднюю квадратичную скорость движения молекул
Соотношение
Слайд 233. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
Изотермический, изохорный и изобарный
Слайд 24Используя зависимость давления газа от его температуры и концентрации молекул
можно
Концентрация молекул:
Слайд 25Число молекул газа
где R=NAk называется универсальной газовой постоянной R=8,31 Дж/(моль
Слайд 27Процессы, происходящие при неизменном значении одного из параметров состояния называются изопроцессами.
Слайд 28При изотермическом процессе (рис. 1) постоянна температура:
Эта зависимость называется законом Бойля-Мариотта
Слайд 29При изобарном процессе (рис. 2) постоянно давление. Уравнение имеет вид (закон
Соотношение для давлений: p1>p2.
Слайд 30Выбирая начальное состояние, соответствующее Т0=273К, запишем
Соотношение связывает объем газа и его
Слайд 31При изохорном процессе (рис. 3) постоянен объем. Уравнение имеет вид (закон
Соотношение для объемов: V1>V2.