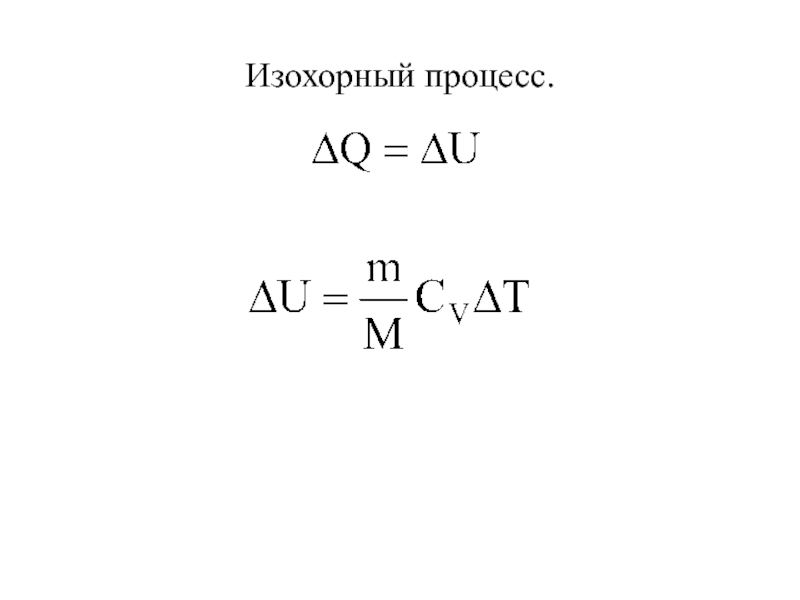- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярно-кинетическая теория идеальных газов презентация
Содержание
- 1. Молекулярно-кинетическая теория идеальных газов
- 2. 1.Статистический и термодинамический методы
- 4. Идеальный газ
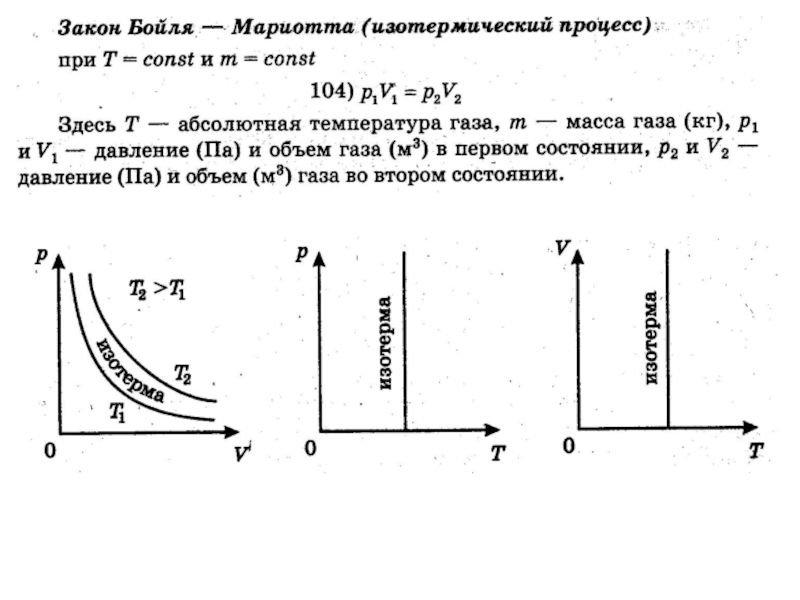
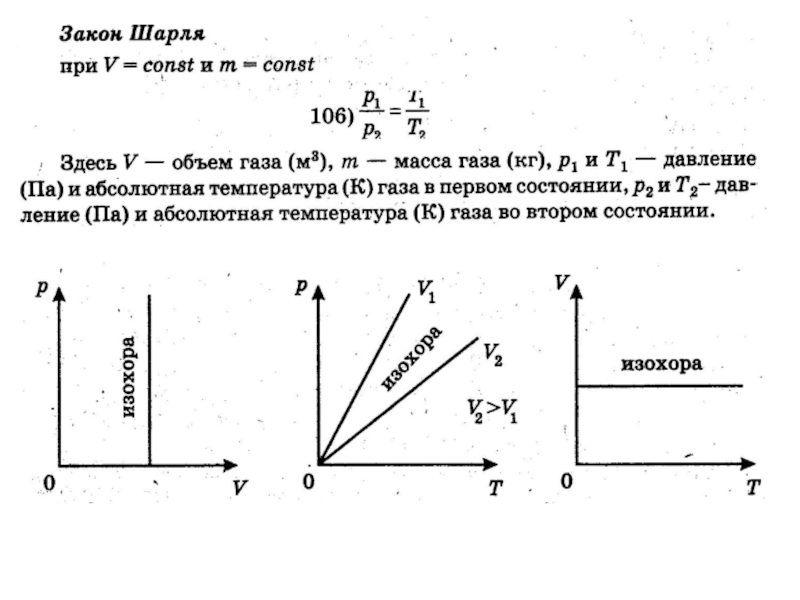
- 5. 2. Изопроцессы
- 6. Уравнение Клапейрона
- 10. ЗАКОН ДАЛЬТОНА: Давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
- 11. Уравнение Клапейрона – Менделеева
- 12. Основное уравнение молекулярно-кинетической теории газов
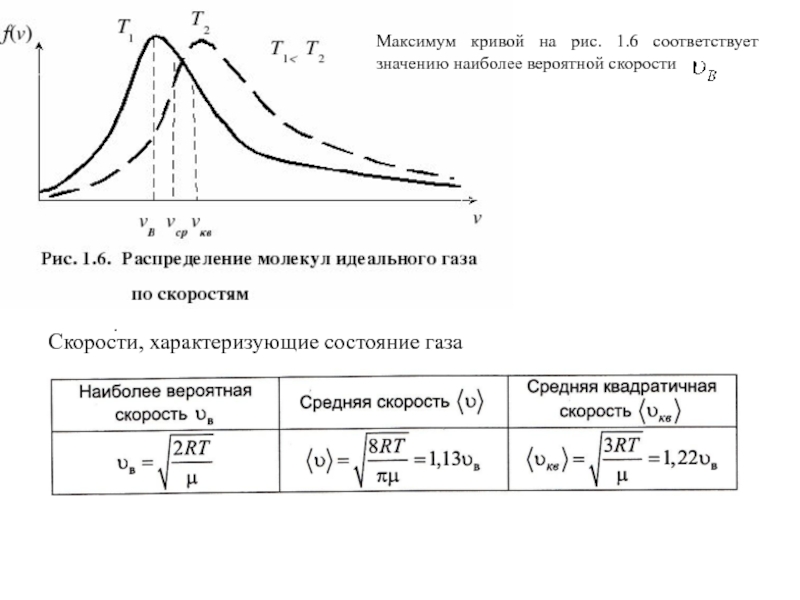
- 13. Закон Максвелла о распределении молекул идеального газа по скоростям
- 14. Скорости, характеризующие состояние газа Максимум кривой на
- 15. 1. Из формулы наиболее вероятной скорости следует,
- 16. Барометрическая формула
- 17. Распределение Больцмана
- 18. Средняя длина свободного пробега молекул
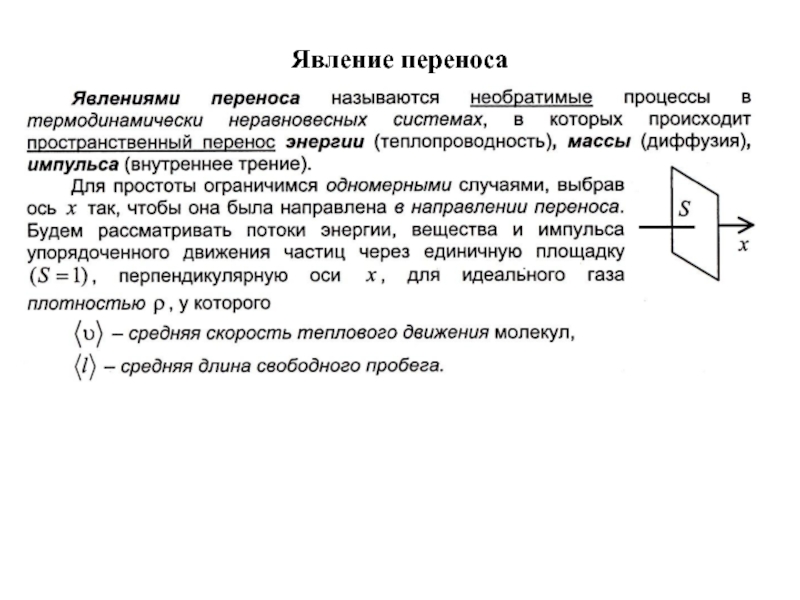
- 19. Явление переноса
- 20. Теплопроводность
- 21. Диффузия
- 22. Внутреннее трение (вязкость)
- 23. Основы термодинамики
- 24. Важной характеристикой термодинамической системы является ее внутренняя
- 25. Внутренняя энергия для произвольной массы идеального газа:
- 26. Первое начало термодинамики
- 27. Закон сохранения и превращения энергии, получил название
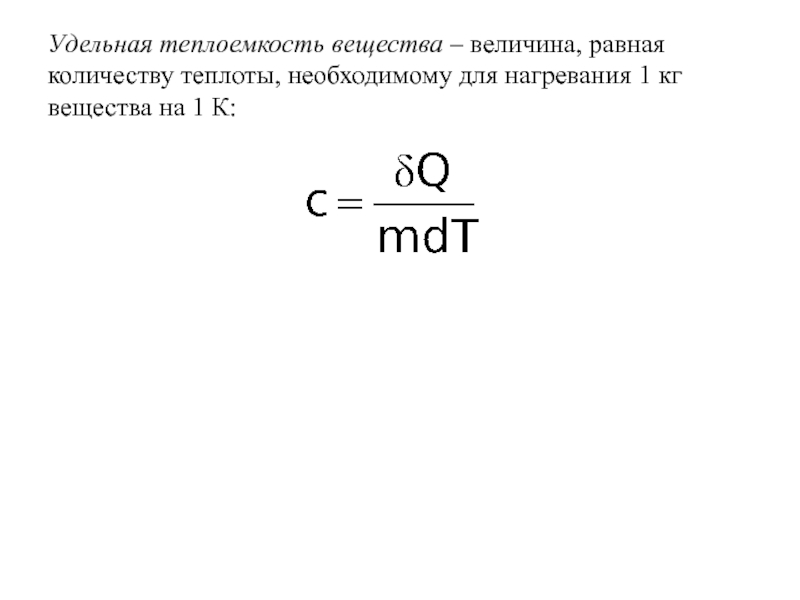
- 28. Удельная теплоемкость вещества – величина, равная количеству
- 29. Молярная теплоемкость - величина, равная количеству теплоты,
- 30. Уравнение Майера - постоянная Пуассона.
- 31. Применение первого начала термодинамики к изопроцессам.
- 32. Изотермический процесс.
- 33. Изобарный процесс.
- 34. Изохорный процесс.
- 35. Адиабатный процесс - процесс, при котором отсутствует
- 36. Термодинамический процесс называется обратимым, если он может
- 37. Энтропией называется функция состояния системы, дифференциалом которой является :
- 38. Для обратимых процессов изменение энтропии:
- 40. Тогда
- 41. Изменение энтропии в изопроцессах:
- 42. Второе начало термодинамики 1) по Кельвину:
- 43. Математической формулировкой второго начала является
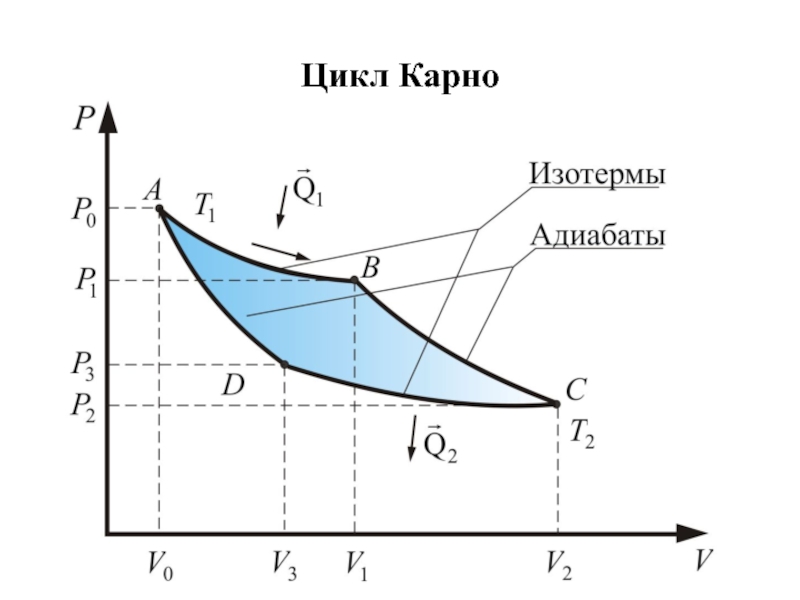
- 44. Цикл Карно
- 45. Следствия: 1). КПД цикла Карно не зависит
Слайд 10ЗАКОН ДАЛЬТОНА: Давление смеси идеальных газов равно сумме парциальных давлений, входящих в
Слайд 14Скорости, характеризующие состояние газа
Максимум кривой на рис. 1.6 соответствует значению наиболее
.
Слайд 151. Из формулы наиболее вероятной скорости следует, что при повышении температуры
Слайд 24Важной характеристикой термодинамической системы является ее внутренняя энергия. Внутренняя энергия -
Слайд 27Закон сохранения и превращения энергии, получил название первого начала термодинамики: количество теплоты
Слайд 28Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания
Слайд 29Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1
Связь удельной и молярной теплоемкости:
Слайд 35Адиабатный процесс - процесс, при котором отсутствует теплообмен между системой и
Слайд 36Термодинамический процесс называется обратимым, если он может происходить как в прямом,
Слайд 38 Для обратимых процессов изменение энтропии:
Слайд 39
Слайд 40 Тогда для замкнутой системы
Таким образом, для произвольного процесса,
где, знак равенства – для обратимого процесса; знак больше − для необратимого.
Слайд 42Второе начало термодинамики
1) по Кельвину: невозможен круговой процесс, единственным результатом которого
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к телу более нагретому.
Слайд 43 Математической формулировкой второго начала является выражение Энтропия замкнутой системы