НОУ СОШ №38 ОАО «РЖД» учитель физики С. А. Валовень
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярная физика. Газовые законы презентация
Содержание
- 1. Молекулярная физика. Газовые законы
- 2. Повторение Перечислите основные положения МКТ. Дайте
- 3. Изопроцессы в газах Процессы, протекающие при неизменном
- 4. (Название процесса)
- 5. процесс изменения состояния термодинамической системы
- 6. (Название процесса)
- 7. процесс изменения состояния термодинамической системы
- 8. (Название процесса)
- 9. процесс изменения состояния термодинамической системы
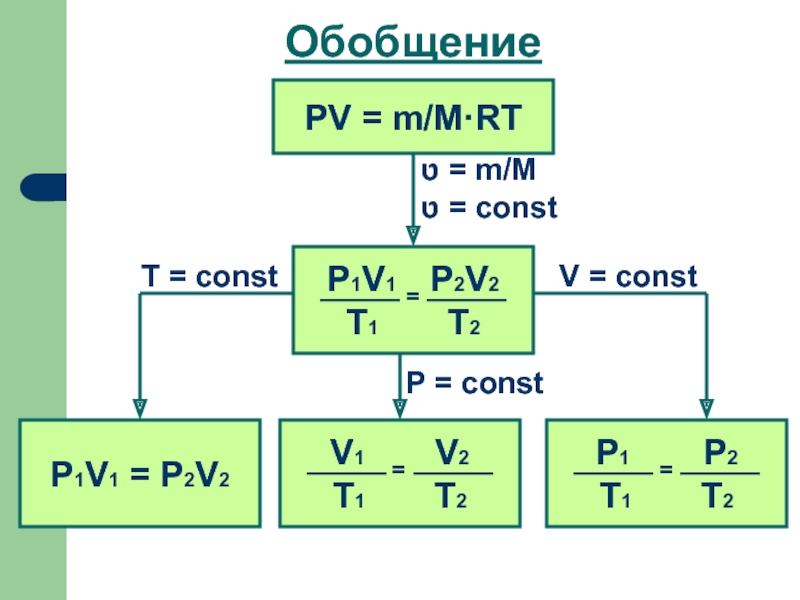
- 10. Обобщение PV = m/M·RT ט =
Слайд 1Молекулярная физика. Тепловые явления. Уравнение состояния идеального газа. Газовые законы.
Тема: «Газовые
Слайд 2
Повторение
Перечислите основные положения МКТ.
Дайте определение относительной молекулярной массы.
Что такое количество вещества?
Что
Какое движение называют броуновским?
Какой газ называют идеальным в МКТ?
Дайте определение и приведите примеры макроскопических параметров.
Дайте определение и приведите примеры микроскопических параметров.
Запишите основное уравнение МКТ. Чем оно замечательно?
Что такое температура? В каких единицах она измеряется?
Какое состояние системы называют тепловым равновесием?
Запишите уравнение состояния идеального газа. Чьи имена носит это уравнение и почему?
Какие макроскопические параметры используются в уравнении Менделеева – Клапейрона?
Слайд 3Изопроцессы в газах
Процессы, протекающие при неизменном значении
одного из параметров, называют
Рассмотрим следующие изопроцессы:
Слайд 5
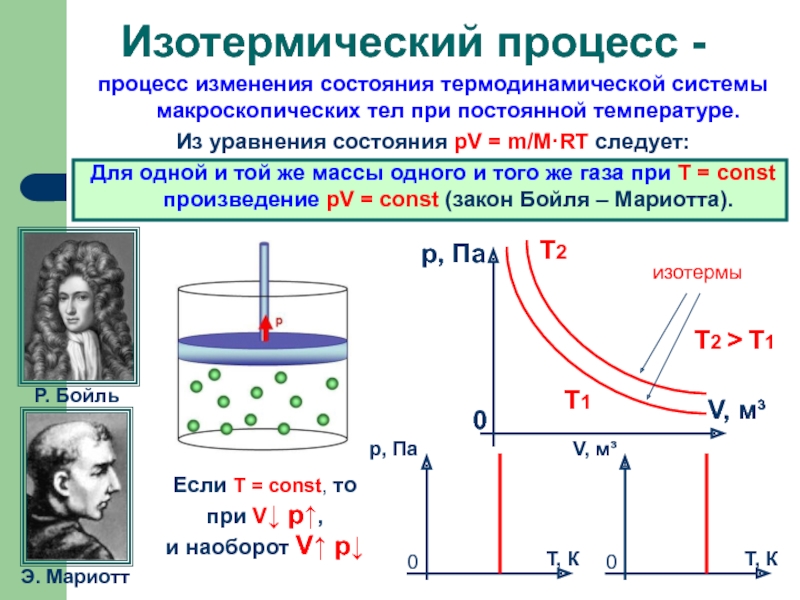
процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
Из
Для одной и той же массы одного и того же газа при T = const произведение pV = const (закон Бойля – Мариотта).
Изотермический процесс -
Р. Бойль
Э. Мариотт
Если T = const, то
при V↓ p↑,
и наоборот V↑ p↓
изотермы
Т2
Т1
Т2 > Т1
Слайд 7
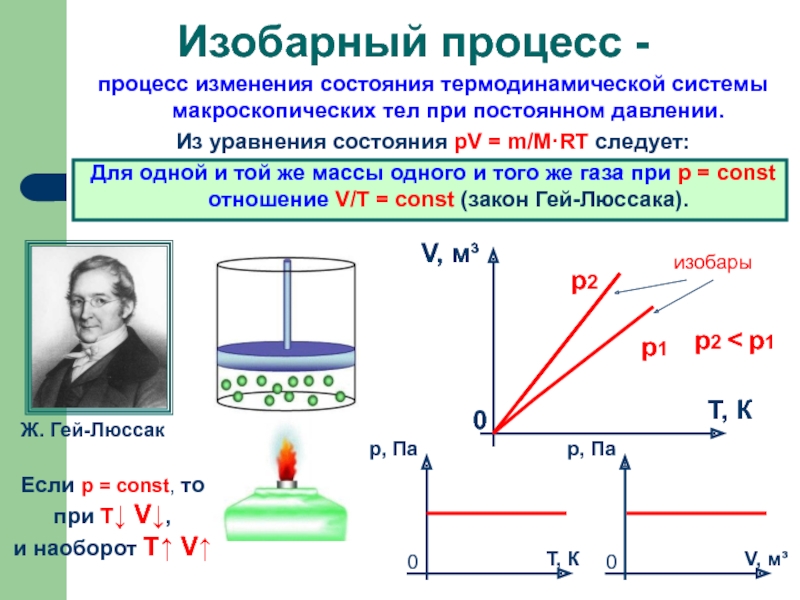
процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
Из
Для одной и той же массы одного и того же газа при р = const отношение V/Т = const (закон Гей-Люссака).
Изобарный процесс -
Ж. Гей-Люссак
Если р = const, то
при Т↓ V↓,
и наоборот T↑ V↑
изобары
р2
р1
р2 < р1
Слайд 9
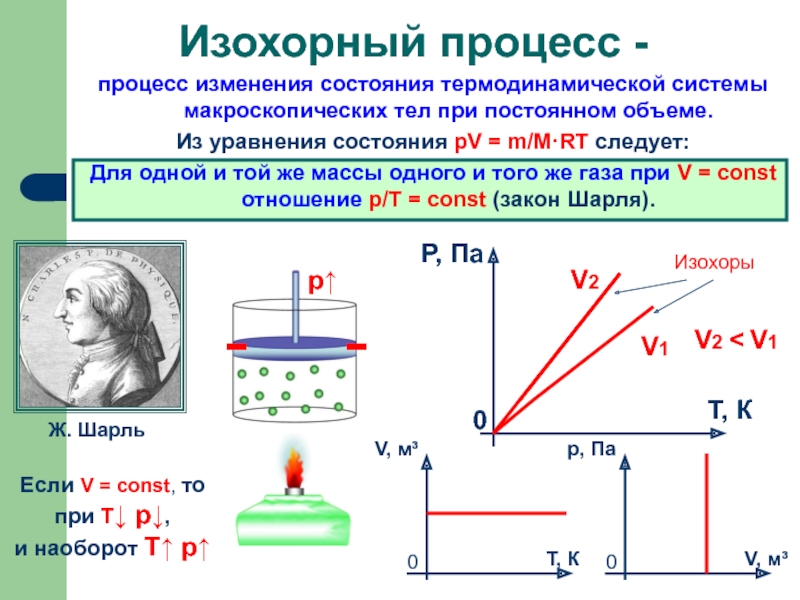
процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме.
Из
Для одной и той же массы одного и того же газа при V = const отношение p/Т = const (закон Шарля).
Изохорный процесс -
Ж. Шарль
Если V = const, то
при Т↓ p↓,
и наоборот T↑ p↑
Изохоры
V2
V1
V2 < V1
р↑