величинами 10-8 см.
Квантовая механика – физическая теория описания законов движения на микроуровне.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Микромир – мир атомов и элементарных частиц презентация
Содержание
- 1. Микромир – мир атомов и элементарных частиц
- 2. В 1900 г. М. Планк сформулировал гипотезу
- 3. Становление представлений об атоме
- 4. Античный период Атомистика, или учение об атомах,
- 5. Демокрит (около 460–370 гг. до н. э.).
- 6. XVIII-XIX века Дж. Дальтон Английский ученый приписал атому количественную «мерку» – относительный вес.
- 7. Но по-прежнему оставался неразрешимым сакраментальный вопрос: что же представляет собой атом?
- 8. Менделеев: 1. Химические атомы каждого элемента
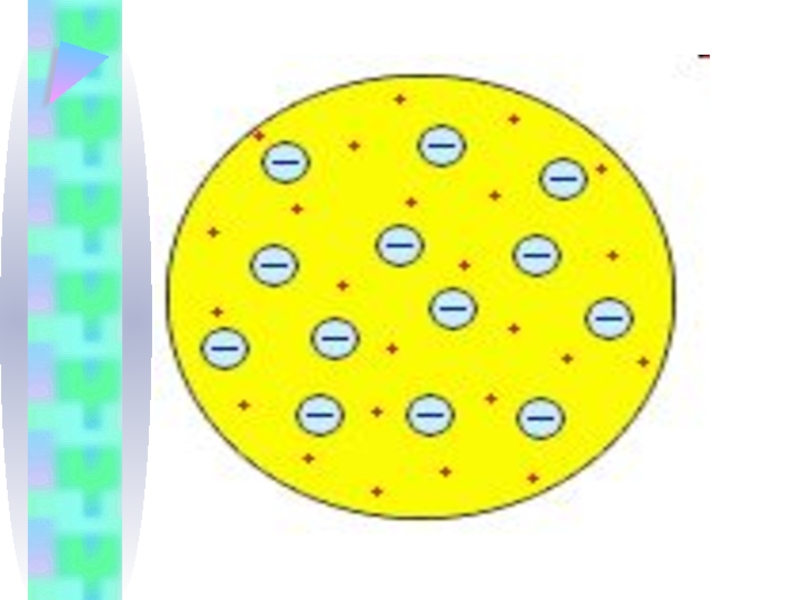
- 9. ХХ век Модель атома Томсона Первую
- 11. Д.Томсон. английский физик, один из создателей учения
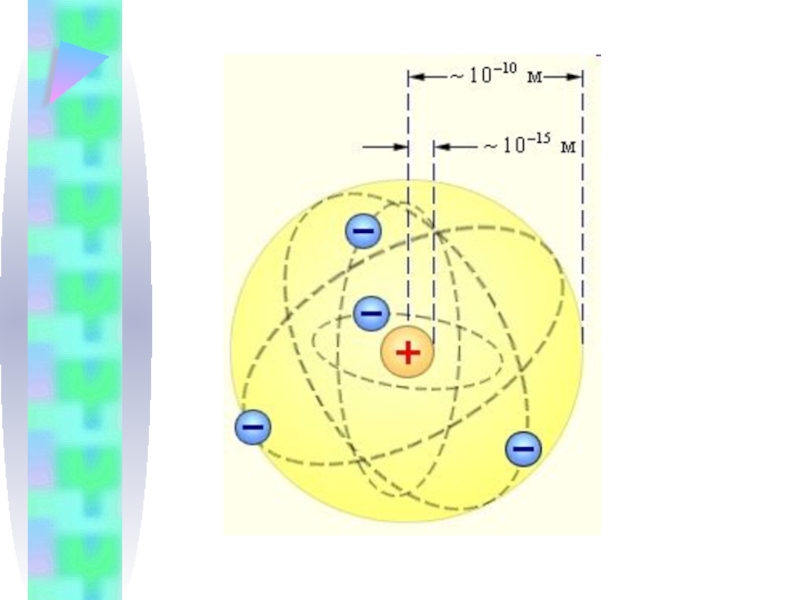
- 12. 2. Модель атома Резерфорда Резерфорд построил планетарную модель атома.
- 13. Резерфорд Эрнст (1871-1937), английский физик, один из
- 14. Главный недостаток модели Резерфорда:
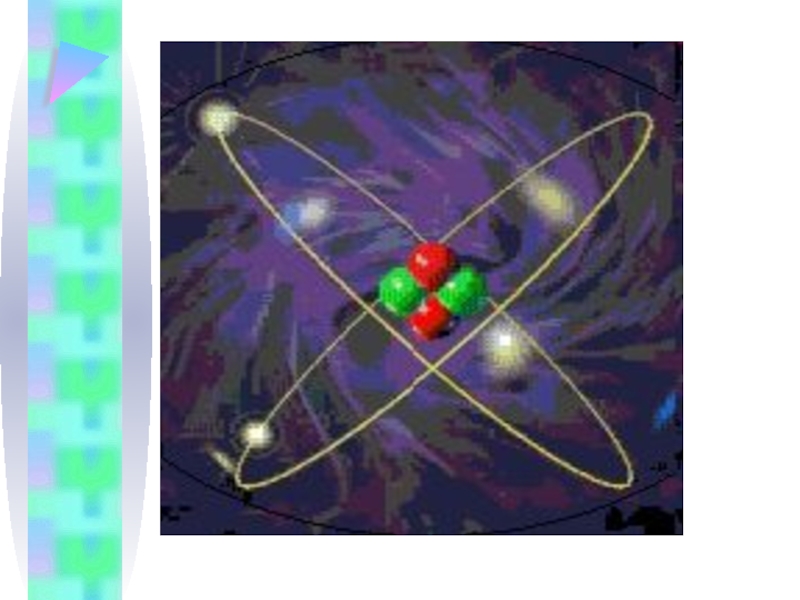
- 16. Модель атома Бора 1913 г.
- 17. Бор, Нильс Хенрик Давид (1885-1962),датский физик, лауреат
- 19. Постулаты Бора: 1. Атом может существовать в
- 20. Атом – наименьшая частица химического элемента, входящая
- 21. атомное ядро (размер 10-12 см) состоит из
- 22. число электронов соответствует порядковому номеру химического элемента в периодической системе и числу протонов в ядре
- 23. электроны наружного слоя (валентные) менее прочно связанны
- 24. В начале 20 в. в науке складывается
- 25. корпускулярная концепция - материя состоит из частиц (атомов), в т.ч. свет – поток корпускул
- 26. континуальная концепция - материя – непрерывное электромагнитное поле
- 27. корпускулярно-волновой дуализм – универсальное свойство природы, когда
- 28. особенностей поведения микрочастиц: корпускулярно-волновая природа взаимопревращаемость частиц и переход вещества в излучение
- 29. 3. местоположение и импульс частицы можно предсказать
- 30. 5. взаимодействие между физическим объектом и измерительным устройством.
Слайд 2В 1900 г. М. Планк сформулировал гипотезу квантов энергии: излучение или
поглощение энергии электромагнитных волн атомами вещества происходит не непрерывно, а определенными неделимыми порциями – квантами.
Слайд 4Античный период
Атомистика, или учение об атомах, – одна из древнейших областей
познания мира – возникла в античные времена.
«атом» означает «неделимый»
«атом» означает «неделимый»
Слайд 5 Демокрит (около 460–370 гг. до н. э.).
1. Из ничего ничто
произойти не может; ничто существующее не может быть уничтожено, и всякое изменение состоит лишь в соединении и разделении.
2. Нет случайности, а всему есть причина и необходимость.
3. Атомы, бесконечные по числу и по форме, своим движением, столкновением и возникающим оттого круговращением образуют видимый мир.
4. Различие предметов зависит только от различия числа, формы и порядка атомов, из которых они образованы.
2. Нет случайности, а всему есть причина и необходимость.
3. Атомы, бесконечные по числу и по форме, своим движением, столкновением и возникающим оттого круговращением образуют видимый мир.
4. Различие предметов зависит только от различия числа, формы и порядка атомов, из которых они образованы.
Слайд 6XVIII-XIX века
Дж. Дальтон
Английский ученый приписал атому количественную «мерку»
– относительный вес.
Слайд 7
Но по-прежнему оставался неразрешимым сакраментальный вопрос: что же представляет собой атом?
Слайд 8Менделеев:
1. Химические атомы каждого элемента неизменны.
2. Видов атомов столько, сколько есть
химических элементов (на 1892 г. – около 70).
3. Все атомы данного элемента одинаковы.
4. Атомы имеют вес – несомненно различие (относительного) веса атомов различных элементов.
3. Все атомы данного элемента одинаковы.
4. Атомы имеют вес – несомненно различие (относительного) веса атомов различных элементов.
Слайд 9ХХ век
Модель атома Томсона
Первую модель атома в 1903 г. предложил Джозеф
Джон Томсон (1856 – 1940), создав ее вскоре после открытия им же в 1895 – 1897 гг. электрона.
Слайд 11 Д.Томсон. английский физик, один из создателей учения о радиоактивности и строении
атома, основатель научной школы, Открыл (1899) альфа- и бета-лучи и установил их природу.
Слайд 13 Резерфорд Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности
и строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925)
Слайд 14
Главный недостаток модели Резерфорда:
НЕСТАБИЛЬНОСТЬ!
ē должен упасть через 10-10 с
и непрерывно
излучать
Слайд 16Модель атома Бора
1913 г. датский физик
Нильс Хенрик Давид Бор.
Модель
Бора опиралась на квантовую гипотезу.
Слайд 17 Бор, Нильс Хенрик Давид (1885-1962),датский физик, лауреат Нобелевской премии по физике
1922, присужденной за создание квантовой теории строения атома.
Слайд 19 Постулаты Бора:
1. Атом может существовать в стационарном состоянии, не испуская и
не поглощая электромагнитного излучения (электроны движутся по определенным устойчивым орбитам),
2. При переходе атома из одного стационарного состояния в другое, он излучает или поглощает порцию Е
2. При переходе атома из одного стационарного состояния в другое, он излучает или поглощает порцию Е
Слайд 20Атом – наименьшая частица химического элемента, входящая в состав молекул простых
и сложных веществ.
Атом – электронейтрален
Атом – электронейтрален
Слайд 21атомное ядро (размер 10-12 см) состоит из протонов и нейтронов, вся
масса атома сосредоточена в ядре.
Слайд 22число электронов соответствует порядковому номеру химического элемента в периодической системе и
числу протонов в ядре
Слайд 23электроны наружного слоя (валентные) менее прочно связанны с ядром и могут
отрываться от атома и присоединяться к другим атомам, образуя катионы и анионы
Слайд 24В начале 20 в. в науке складывается представление о противопоставлении 2-х
видов материи - вещества и поля:
Слайд 25корпускулярная концепция - материя состоит из частиц (атомов),
в т.ч. свет
– поток корпускул
Слайд 27корпускулярно-волновой дуализм – универсальное свойство природы, когда всем микрообъектам присущи одновременно
и корпускулярные, и волновые характеристики
Слайд 28особенностей поведения микрочастиц:
корпускулярно-волновая природа
взаимопревращаемость частиц и переход вещества в излучение
Слайд 293. местоположение и импульс частицы можно предсказать только с определенной вероятностью.
4.
точное измерение возможно только при потоке частиц.