- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металловедение. Атомное строение металлов и сплавов. Типы кристаллических решеток. (Лекция 1) презентация
Содержание
- 1. Металловедение. Атомное строение металлов и сплавов. Типы кристаллических решеток. (Лекция 1)
- 2. ОБЩИЕ СВЕДЕНИЯ
- 3. ЗАДАЧИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ в результате изучения
- 4. атомное строение металлов и сплавов
- 5. Типы кристаллических решеток
- 6. Каждый атом в вершине
- 7. Типы кристаллических решеток Существует несколько
- 8. В КУБИЧЕСКОЙ ОБЪЕМНОЦЕНТРИРОВАННОЙ РЕШЕТКЕ, КРОМЕ ВОСЬМИ АТОМОВ,
- 9. В КУБИЧЕСКОЙ ГРАНЕЦЕНТРИРОВАННОЙ РЕШЕТКЕ К12, ЧИСЛО АТОМОВ
- 10. Число атомов в различных сечениях пространственной кристаллической
Слайд 1ЛЕКЦИЯ 1
План лекции:
- общие сведения;
- атомное строение металлов
- типы кристаллических решеток
Слайд 2ОБЩИЕ СВЕДЕНИЯ
Цель изучения дисциплины – формирование у студентов обобщенной системы знаний
Основоположник отечественной науки о металле – великий русский ученый
М.В. Ломоносов (1711г.-1765г.),
один из образованнейших людей своего времени.
Основы современного металловедения были заложены выдающимися русскими металлургами П.П. Аносовым (1799г.-1851г.) и Д.К. Черновым (1839г.-1921г.), впервые установившим связь между строением и свойствами металлов и сплавов
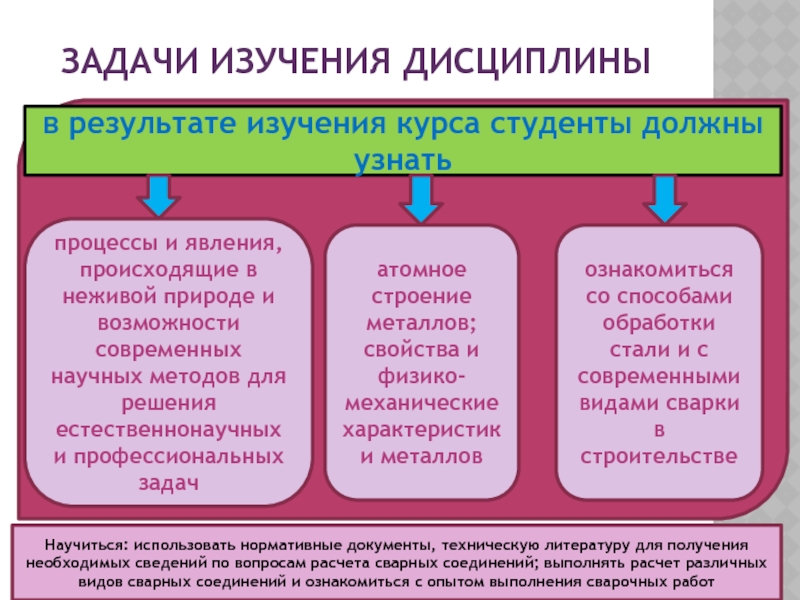
Слайд 3ЗАДАЧИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
в результате изучения курса студенты должны узнать
процессы и явления,
атомное строение металлов; свойства и физико-механические характеристики металлов
ознакомиться со способами обработки стали и с современными видами сварки в строительстве
Научиться: использовать нормативные документы, техническую литературу для получения необходимых сведений по вопросам расчета сварных соединений; выполнять расчет различных видов сварных соединений и ознакомиться с опытом выполнения сварочных работ
Слайд 4
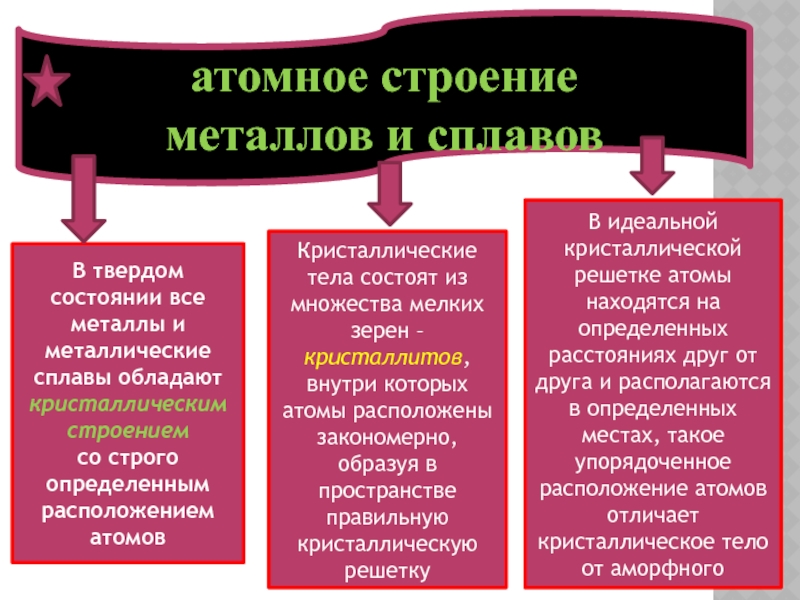
атомное строение
металлов и сплавов
В твердом состоянии все металлы и металлические
со строго определенным расположением атомов
Кристаллические тела состоят из множества мелких зерен – кристаллитов, внутри которых атомы расположены закономерно, образуя в пространстве правильную кристаллическую решетку
В идеальной кристаллической решетке атомы находятся на определенных расстояниях друг от друга и располагаются в определенных местах, такое упорядоченное расположение атомов отличает кристаллическое тело от аморфного
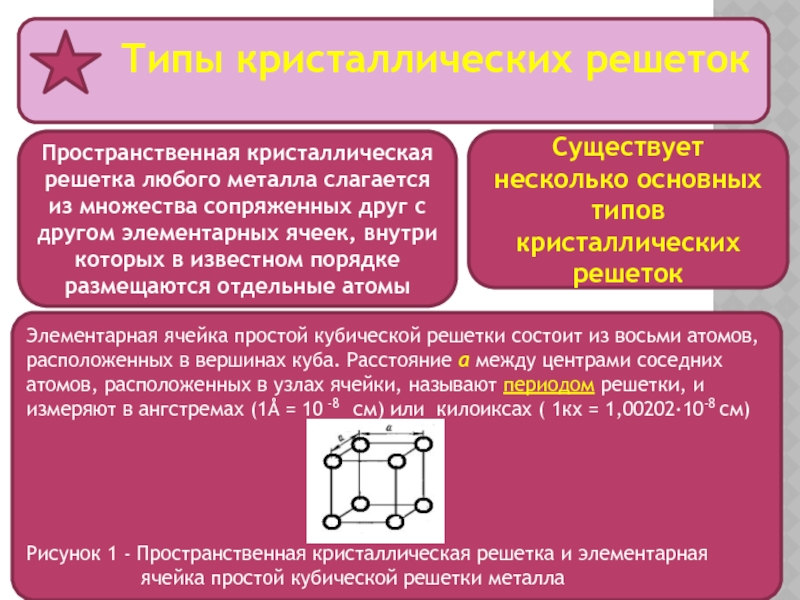
Слайд 5 Типы кристаллических решеток
Пространственная кристаллическая решетка любого металла
Существует несколько основных типов кристаллических решеток
Элементарная ячейка простой кубической решетки состоит из восьми атомов, расположенных в вершинах куба. Расстояние а между центрами соседних атомов, расположенных в узлах ячейки, называют периодом решетки, и измеряют в ангстремах (1Å = 10 -8 см) или килоиксах ( 1кх = 1,00202·10-8 см)
Рисунок 1 - Пространственная кристаллическая решетка и элементарная
ячейка простой кубической решетки металла
Слайд 6 Каждый атом в вершине куба принадлежит одновременно восьми
На всю ячейку в целом (8 вершин) приходится, таким образом, 1 атом.
Кубическая кристаллическая решетка сокращенно обозначается индексом К6
Слайд 7
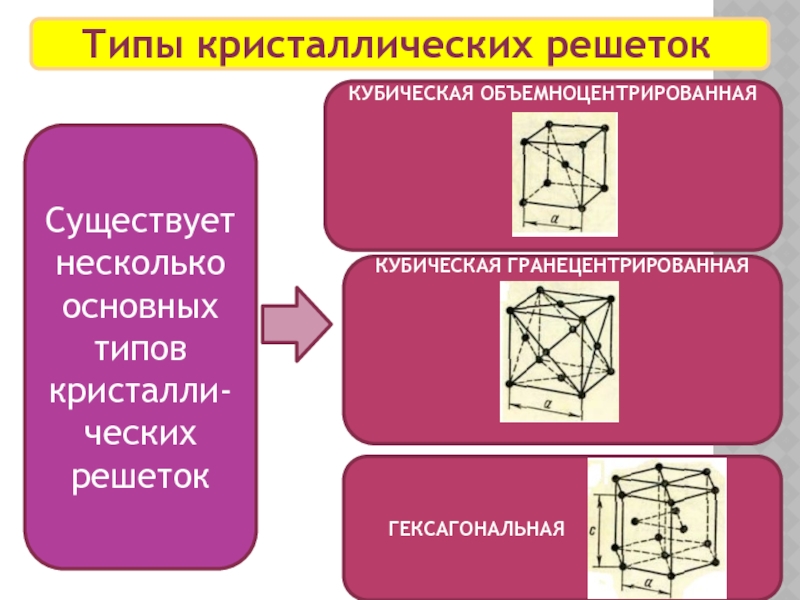
Типы кристаллических решеток
Существует несколько основных типов кристалли-ческих решеток
КУБИЧЕСКАЯ ОБЪЕМНОЦЕНТРИРОВАННАЯ
КУБИЧЕСКАЯ ГРАНЕЦЕНТРИРОВАННАЯ
Слайд 8В КУБИЧЕСКОЙ ОБЪЕМНОЦЕНТРИРОВАННОЙ РЕШЕТКЕ, КРОМЕ ВОСЬМИ АТОМОВ, НАХОДЯЩИХСЯ В ВЕРШИНАХ КУБА,
Базисом кристаллической решетки называют число атомов, приходящихся на одну элементарную ячейку. Базис характеризует плотность решетки, т.к. кроме объема, занимаемого атомами, остается еще свободное пространство.
Коэффициентом компактности называется отношение объема, занимаемого атомами, ко всему объему решетки. Чем больше коэффициент компактности, тем больше плотность элементарной ячейки.
Слайд 9В КУБИЧЕСКОЙ ГРАНЕЦЕНТРИРОВАННОЙ РЕШЕТКЕ К12, ЧИСЛО АТОМОВ РАВНО ЧЕТЫРЕМ: 1/8·8=1АТОМ ОТ
Взаимную связь атомов друг с другом характеризует координационное число.
Под координационным числом понимают число атомов-соседей, находящихся на равном и наиболее близком расстоянии от избранного атома. Так, в простой кубической решетке на таких расстояниях находятся 6 соседних атомов. Чем больше координационное число, тем больше плотность упаковки атомов