- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Квантовые постулаты Бора презентация
Содержание
- 1. Квантовые постулаты Бора
- 2. Бор Нильс Хенрик Давид (7.10.1885—18.11.1962)
- 3. Электроны движутся вокруг ядра, подобно тому как
- 4. Модель Резерфорда 1. В
- 5. явилась крупным шагом в развитии знаний о
- 6. Модель атома Резерфорда не смогла объяснить все
- 7. Никаких доказательств того, что атомы непрерывно исчезают,
- 8. В 1913 году Бор показал, что несовпадение
- 9. Бор предположил, что величины характеризующие микромир,
- 10. Атомная система может находиться
- 11. Электрон может вращаться вокруг ядра не по
- 12. ПОСТУЛАТЫ БОРА I I
- 13. III постулат Излучение света происходит при переходе
- 14. энергия испущенного атомом фотона равна разности энергий
- 15. Таким образом, Бор предположил, что
- 16. Свои постулаты Бор применил для объяснения излучения
- 18. Если атом водорода переходит из более высоких
- 19. Если атом водорода переходит из более высоких
- 20. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ Если атом водорода
- 21. Если атом переходит в одно из возбужденных
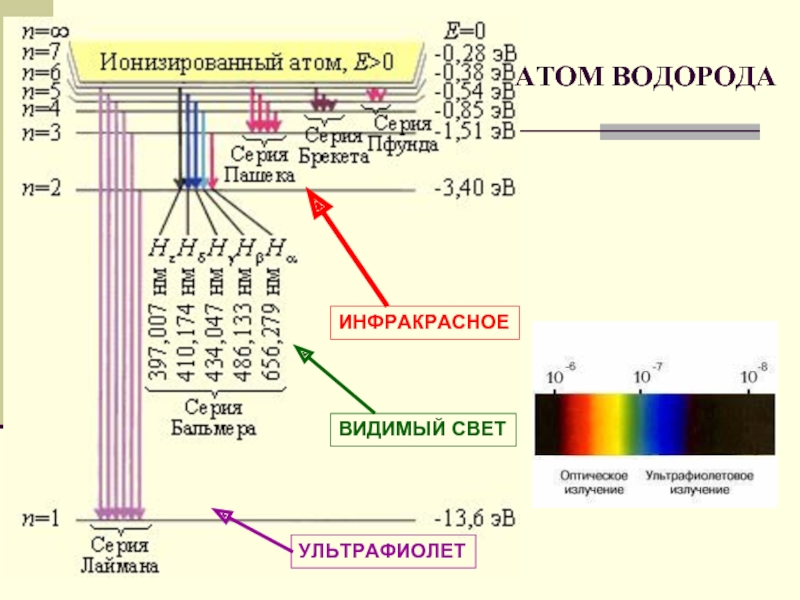
- 22. УЛЬТРАФИОЛЕТ ВИДИМЫЙ СВЕТ АТОМ ВОДОРОДА ИНФРАКРАСНОЕ
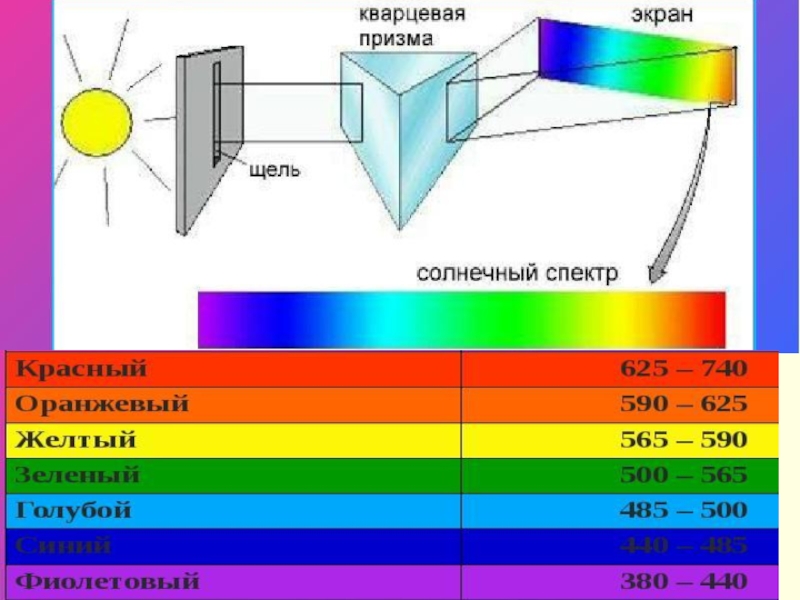
- 23. Для получения спектров используют специальные приборы
- 25. Виды спектров
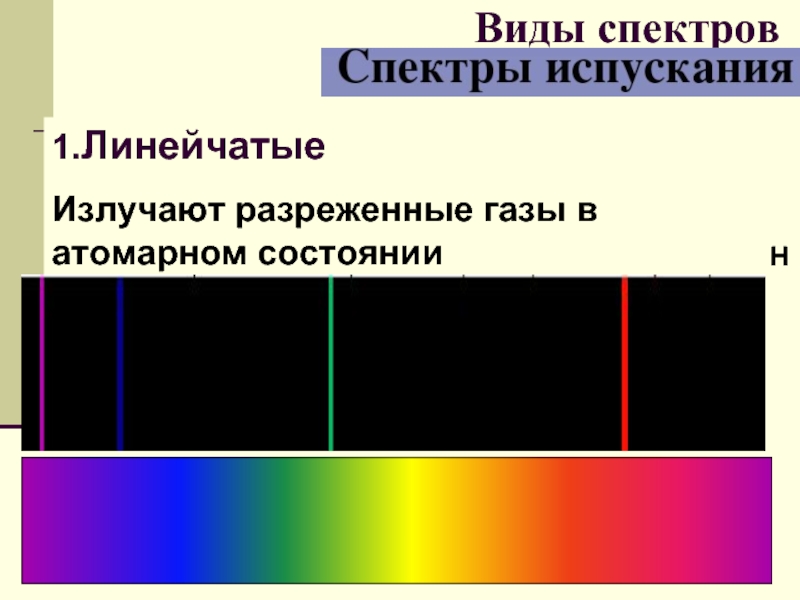
- 28. 1.Линейчатые Излучают разреженные газы в атомарном состоянии Виды спектров Н
- 29. спектры излучения состоит из узких линий разного
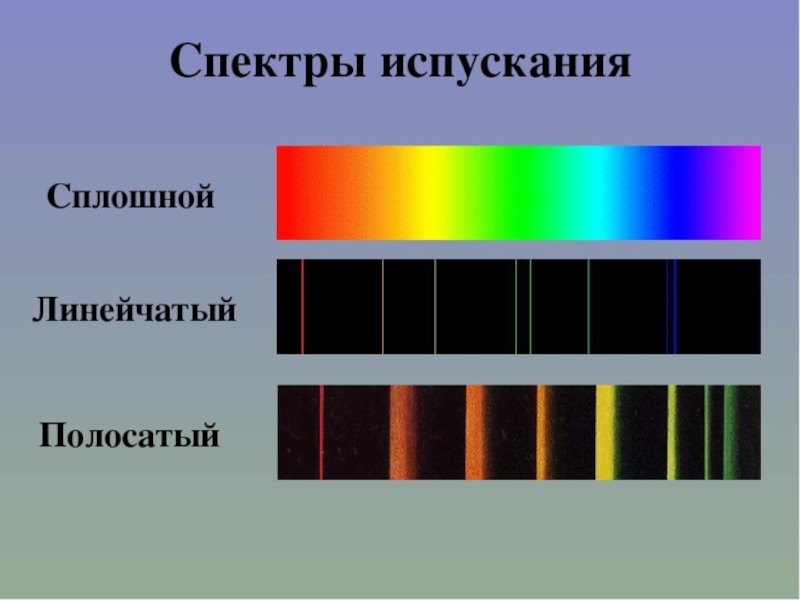
- 32. Виды спектров 2.Полосатые Излучают разреженные газы
- 35. СПЕКТРЫ ПОГЛОЩЕНИЯ Поглощение света-
- 36. Спектры поглощения Спектры поглощения получают, пропуская
- 37. получают, пропуская свет от источника, дающего
- 39. Метод определения качественного и количественного состава вещества
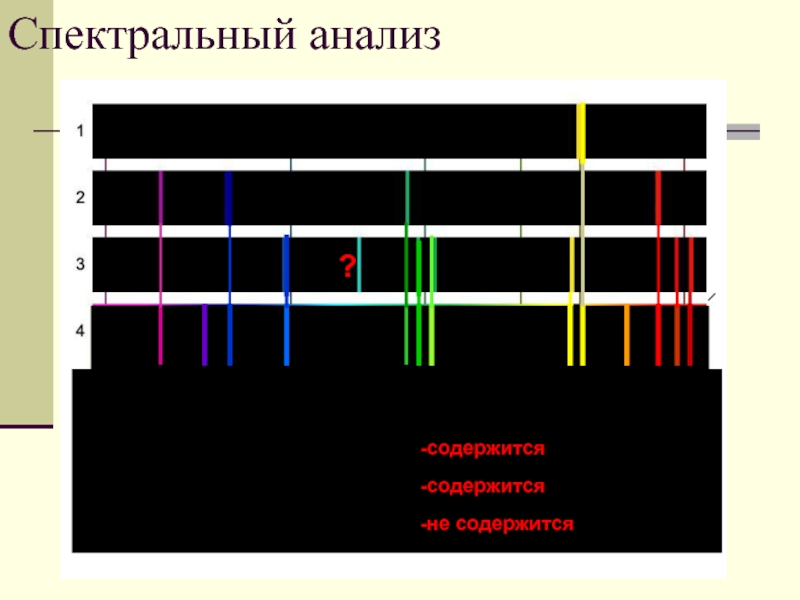
- 40. Спектральный анализ ? Содержится
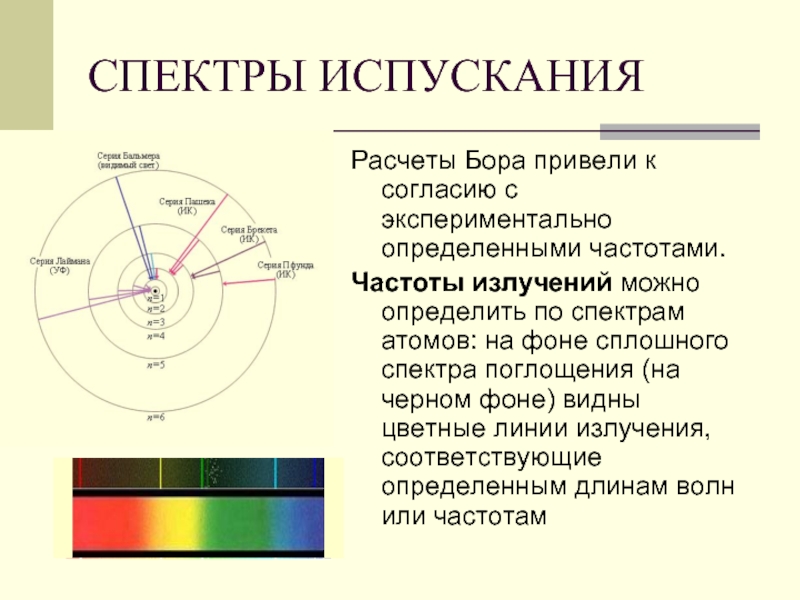
- 43. СПЕКТРЫ ИСПУСКАНИЯ Расчеты Бора привели
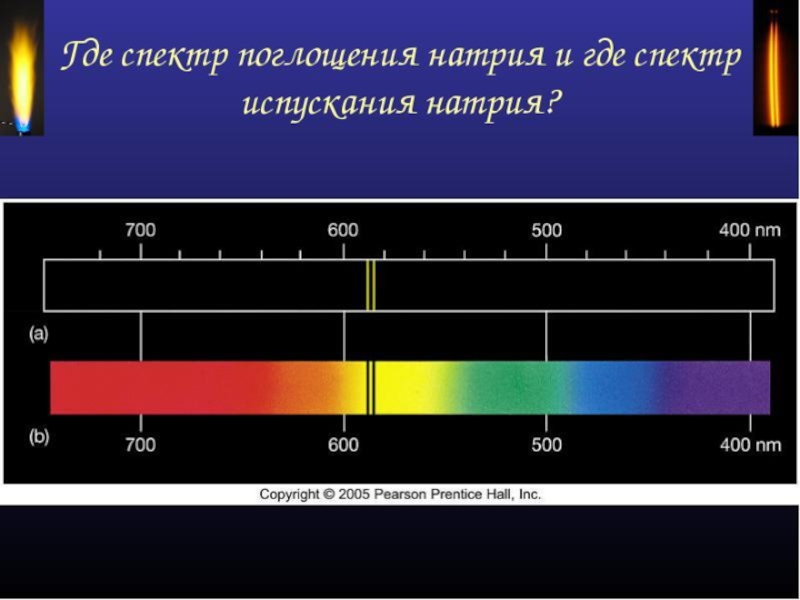
- 44. СПЕКТРЫ ИСПУСКАНИЯ СПЕКТРЫ ПОГЛОЩЕНИЯ 1-сплошной 2-натрия 3-водорода 4-гелия 5-солнечный 6-натрия 7-водорода 8-гелия
- 46. Построить количественную теорию уже следующего за
- 47. Исследование линейчатого спектра вещества позволяет определить,
- 48. С помощью спектрального анализа можно обнаружить
- 49. Химический состав атмосфер планет и звезд,
Слайд 2Бор Нильс Хенрик Давид
(7.10.1885—18.11.1962)
Датский физик, один из создателей современной
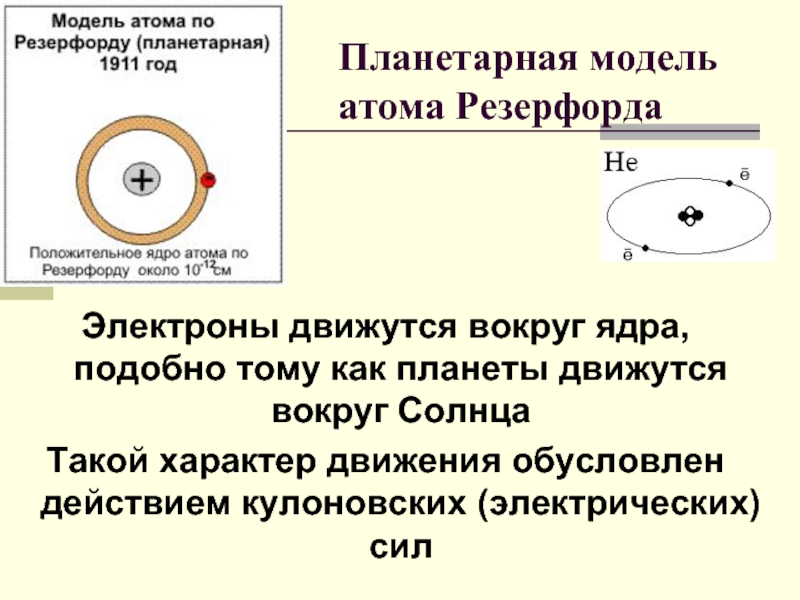
Слайд 3Электроны движутся вокруг ядра, подобно тому как планеты движутся вокруг Солнца
Такой характер движения обусловлен действием кулоновских (электрических)сил
Планетарная модель атома Резерфорда
Слайд 4Модель Резерфорда
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. В целом атом нейтрален, из чего следует, что число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической таблице.
Слайд 5явилась крупным шагом в развитии знаний о строении атома.
оказалась очень
для объяснения многих
экспериментальных данных,
была совершенно необходимой для
объяснения опытов по рассеянию
α-частиц.
Однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость
Модель Резерфорда
Слайд 6Модель атома Резерфорда не смогла объяснить все свойства атомов.
По законам
атом должен излучать электромагнитные волны (электроны движутся с ускорением.) =>
потенциальная энергия в системе ядро – электрон должна уменьшаться, что приведет к падению электрона на ядро
(за время порядка 10–8 с атом прекратил бы свое существование) .
Однако атомы обычно не излучают электромагнитные волны, а
электроны не падают на атомные ядра, т.е. атомы устойчивы.
Слайд 7Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало,
Модель Резерфорда
Слайд 8В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных
поведение микрочастиц и макроскопических тел нельзя описывать одними и теми же законами
Слайд 9Бор предположил, что
величины характеризующие микромир, должны квантоваться, т.е. они
могут
Законы микромира - квантовые законы!
Эти законы в начале 20 столетия еще не были установлены наукой.
Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда.
Слайд 10 Атомная система может находиться только в особых стационарных,
ПОСТУЛАТЫ БОРА
I постулат
Слайд 11Электрон может вращаться вокруг ядра не по произвольным, а только по
I постулат
ПОСТУЛАТЫ БОРА
Слайд 12
ПОСТУЛАТЫ БОРА
I I постулат
При движении по стационарным орбитам электрон не излучает
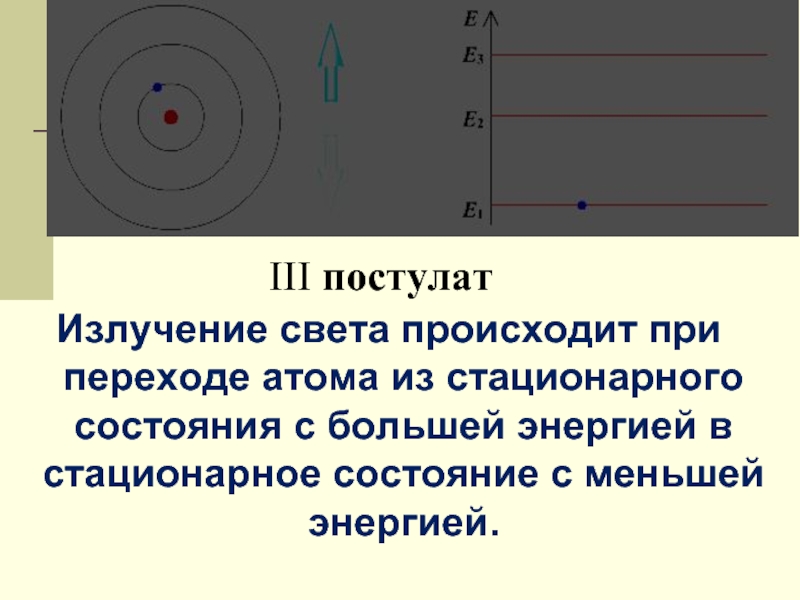
Слайд 13III постулат
Излучение света происходит при переходе атома из стационарного состояния с
Слайд 14энергия испущенного
атомом фотона равна
разности энергий
стационарных состояний, а
частота излучения
определяется по формуле:
Ek
Слайд 15Таким образом,
Бор предположил, что
электрон в атоме не подчиняется законам
ПОСТУЛАТЫ БОРА
Слайд 16Свои постулаты Бор применил для объяснения излучения и поглощения света атомом
Третий постулат позволяет вычислить по известным экспериментальным значениям энергий стационарных состояний частоты излучения атома водорода.
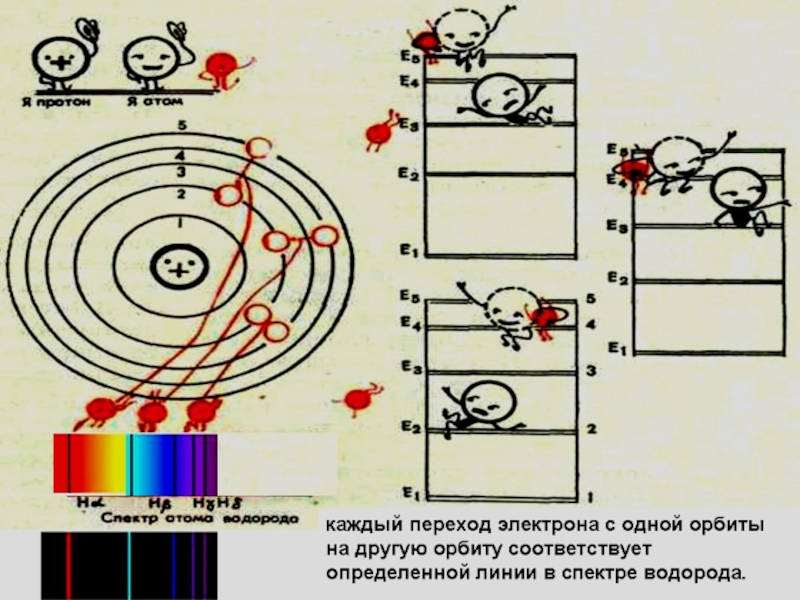
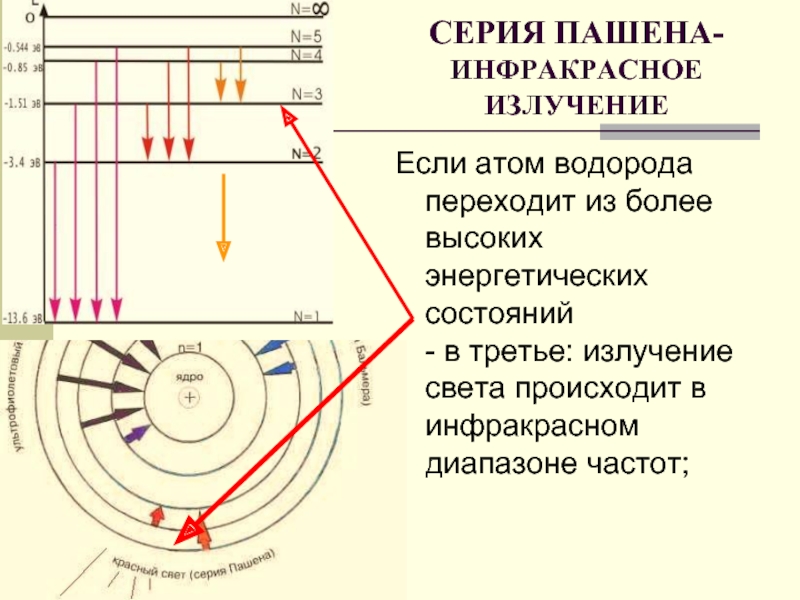
Слайд 18Если атом водорода переходит из более высоких энергетических состояний - в
СЕРИЯ ПАШЕНА-
ИНФРАКРАСНОЕ ИЗЛУЧЕНИЕ
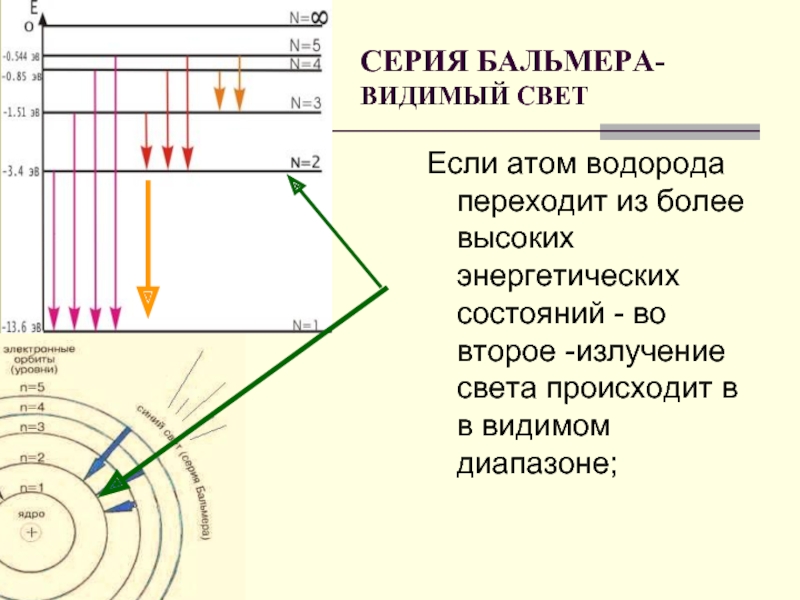
Слайд 19Если атом водорода переходит из более высоких энергетических состояний - во
СЕРИЯ БАЛЬМЕРА-
ВИДИМЫЙ СВЕТ
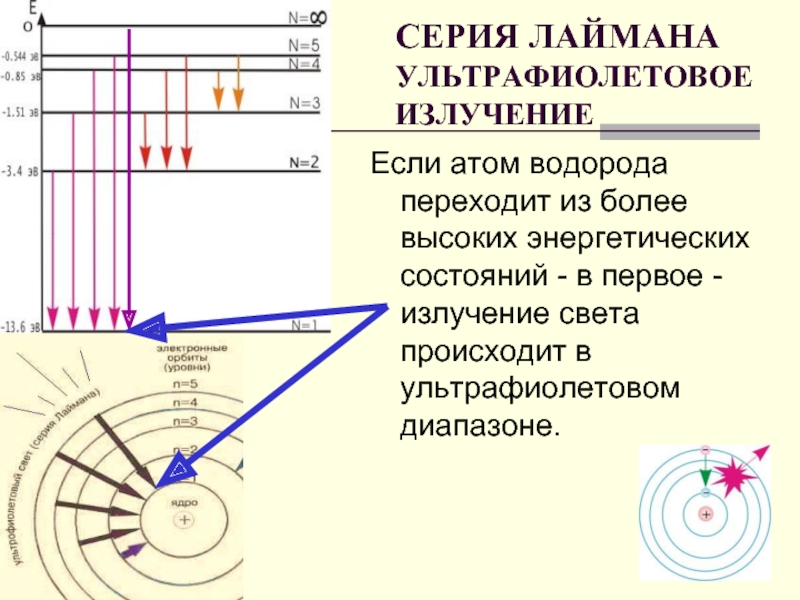
Слайд 20СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ
Если атом водорода переходит из более высоких энергетических
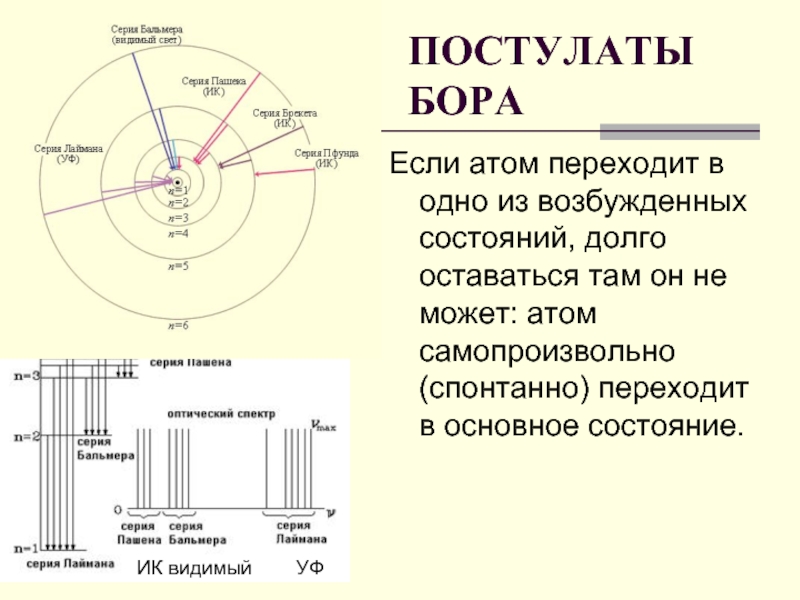
Слайд 21Если атом переходит в одно из возбужденных состояний, долго оставаться там
ПОСТУЛАТЫ БОРА
ИК видимый УФ
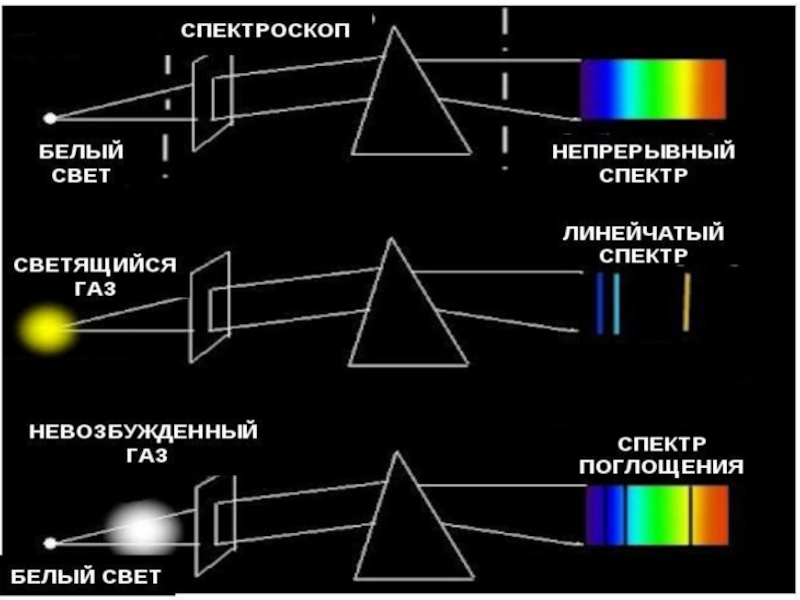
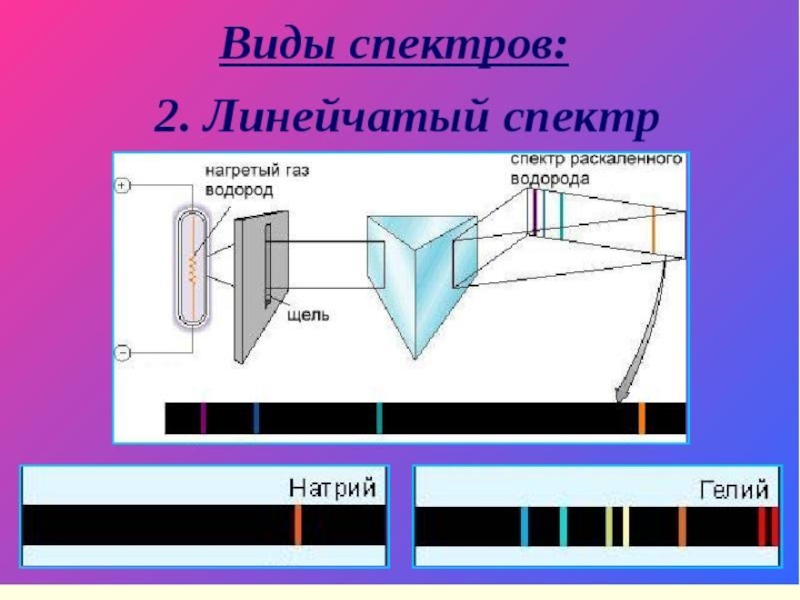
Слайд 23Для получения спектров используют специальные приборы СПЕКТРОСКОПЫ
Исследование спектров испускания
Количественное содержание элемента в соединении определяется путем измерения яркости спектральных линий.
Слайд 25Виды спектров
Непрерывные или сплошные
Излучают нагретые тела в твёрдом и жидком состоянии,
Одинаковы для разных веществ.
Нельзя использовать для определения состава вещества
Слайд 29спектры излучения
состоит из узких линий разного цвета.
Такой спектр называется линейчатым
Для получения такого спектра используют дуговой или искровой разряд.
Линейчатый спектр излучения у каждого химического элемента свой, не совпадающий со спектром другого химического элемента.
Слайд 35СПЕКТРЫ ПОГЛОЩЕНИЯ
Поглощение света- процесс, обратный излучению: атом переходит из низших энергетических
При этом атом поглощает излучение тех же частот, которые излучает при обратных переходах.
Слайд 36
Спектры поглощения
Спектры поглощения получают, пропуская свет от источника. дающего сплошной спектр, через
Спектр поглощения — это совокупность частот, поглощаемых данным веществом.
Слайд 37
получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого
Слайд 39Метод определения качественного и количественного состава вещества по его спектру называется
Зная длины волн, испускаемых различными парами, можно установить наличие тех или иных элементов в веществе.
Слайд 40Спектральный анализ
?
Содержится ли в смеси газов (спектр4):
А) натрий (спектр1)
Б) водород (спектр
В) гелий (спектр 3)?
-содержится
-содержится
-не содержится