- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Курс общей физики презентация
Содержание
- 1. Курс общей физики
- 2. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА Молекулярная физика –
- 3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ Все тела состоят из
- 4. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ Данные положения подтверждаются
- 5. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
- 6. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ Количество молекул
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ где a и b
- 8. ИДЕАЛЬНЫЙ ГАЗ Любое вещество представляет некоторую
- 9. ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА. Теплота —
- 10. ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА.
- 11. ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА В случае,
- 12. ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА Полученная формула
- 13. ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ
- 14. ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ
- 15. ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ Заметим,
- 16. РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА При тепловом равновесии (Т=cоnst) υкв
- 17. РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА Т.о., f(υ) равна вероятности того,
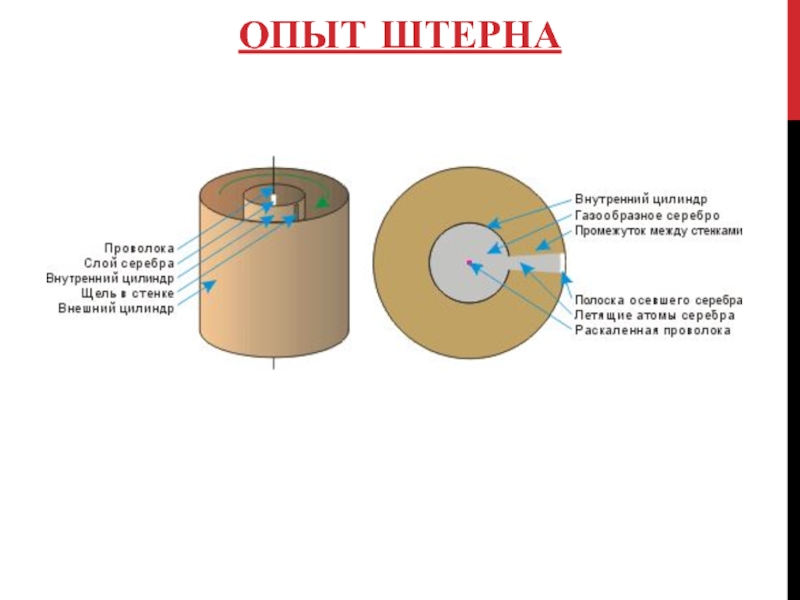
- 18. ОПЫТ ШТЕРНА
- 19. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА Рассмотрим столб газа сечением S,
- 20. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА Пользуясь барометрической формулой и
- 21. ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН
- 22. ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН
- 23. ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН
Слайд 2МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНОГО ГАЗА
Молекулярная физика – это наука, которая изучает физические
Для теоретического изучения вопросов молекулярной физики используются два взаимодополняющих метода – статистический и термодинамический.
Статистический метод состоит в изучении свойств макроскопических систем на основе анализа закономерностей теплового движения большого количества микрочастиц составляющих систему с помощью методов математической статистики.
Макроскопическая система – это система состоящая из очень большого числа частиц.
Термодинамический метод основывается на изучении свойств системы взаимодействующих тел путем анализа условий и количественных соотношений преобразования энергии, происходящих в системе.
Слайд 3ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
Все тела состоят из мельчайших частиц атомов и молекул
Частицы
Между частицами вещества действуют силы притяжения и отталкивания, зависящие от расстояния между частицами
Слайд 4ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
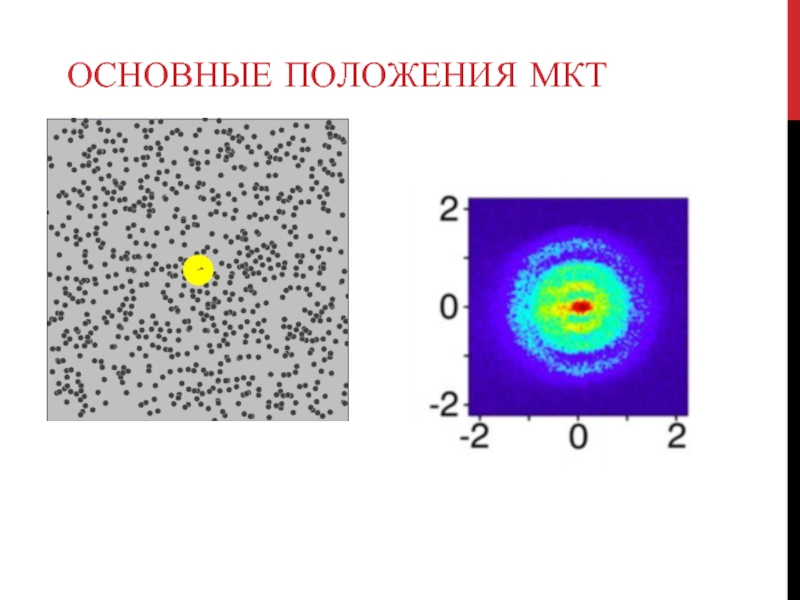
Данные положения подтверждаются благодаря следующим экспериментальным результатам. Наличие
Наиярчайшее подтверждение непрерывного хаотического движения молекул – броуновское движение. При размерах броуновских частичек ~10-4 – 10-5 м число ударов молекул жидкости о них не будет слишком большим и начнут проявляться отклонения числа ударов молекул в отдельные стороны частички от средних значений. Говорят, что наблюдаются флуктуации скорости броуновской частицы.
Флуктуации – это отклонение тех или иных величин от их средних значений, которые происходят в малых объемах или на протяжении малых промежутков времени.
Слайд 6ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
Количество молекул в любом самом небольшом объеме
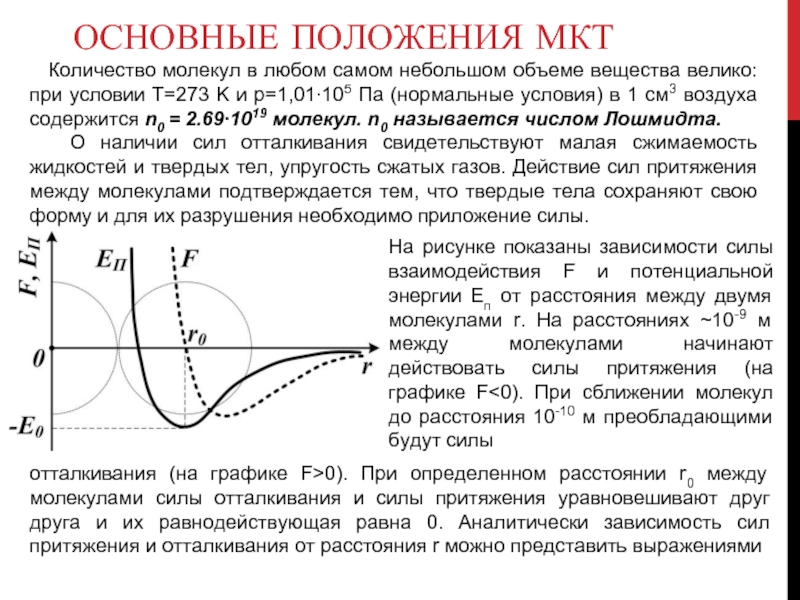
О наличии сил отталкивания свидетельствуют малая сжимаемость жидкостей и твердых тел, упругость сжатых газов. Действие сил притяжения между молекулами подтверждается тем, что твердые тела сохраняют свою форму и для их разрушения необходимо приложение силы.
На рисунке показаны зависимости силы взаимодействия F и потенциальной энергии Eп от расстояния между двумя молекулами r. На расстояниях ~10-9 м между молекулами начинают действовать силы притяжения (на графике F<0). При сближении молекул до расстояния 10-10 м преобладающими будут силы
отталкивания (на графике F>0). При определенном расстоянии r0 между молекулами силы отталкивания и силы притяжения уравновешивают друг друга и их равнодействующая равна 0. Аналитически зависимость сил притяжения и отталкивания от расстояния r можно представить выражениями
Слайд 7ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
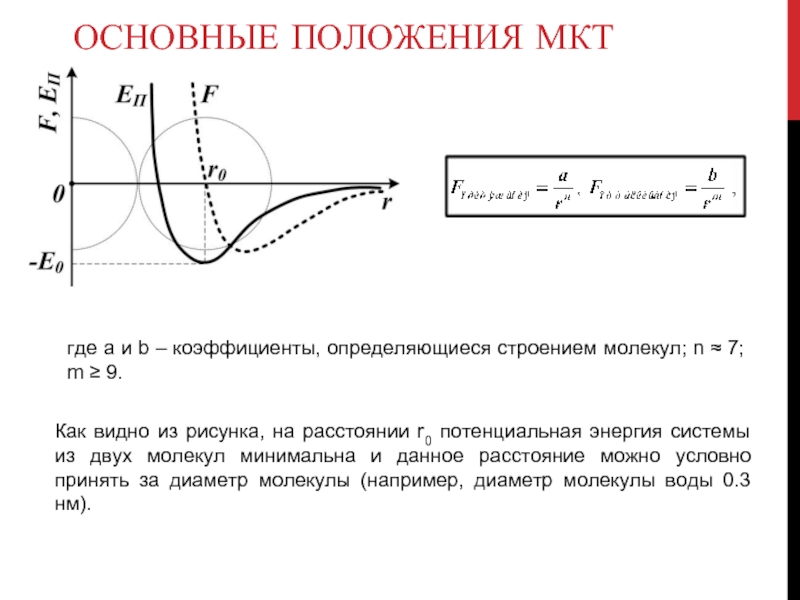
где a и b – коэффициенты, определяющиеся строением молекул;
Как видно из рисунка, на расстоянии r0 потенциальная энергия системы из двух молекул минимальна и данное расстояние можно условно принять за диаметр молекулы (например, диаметр молекулы воды 0.3 нм).
Слайд 8ИДЕАЛЬНЫЙ ГАЗ
Любое вещество представляет некоторую систему, состоящую из множества частиц.
Для упрощения рассмотрения процессов, которые происходят в системе пользуются идеализированным понятием «идеальный газ». Идеальный газ – это система материальных точек, между которыми совершенно отсутствует притяжение. Приближенно любой газ в разряженном состоянии (т.е. при малых давлениях и достаточно высокой температуре) можно рассматривать как идеальный. В таком случае размеры молекул значительно меньше среднего расстояния между ними. Единственно возможным взаимодействием молекул идеального газа является их взаимное отталкивание при соударении. Такое взаимодействие подобно соударяющимся упругим шарикам.
Слайд 9ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА.
Теплота — это особая форма энергии, с
Температура — макроскопическая характеристика теплового движения. Значит температура является мерой содержащегося в теле тепла и определяет направление перехода тепла — от более нагретого тела к менее нагретому.
Слайд 10ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА.
Очевидно, что т.к. теплота
Отметим, что температура — это макроскопическая характеристика тела, тогда как кинетическая энергия соответствует отдельной частице. Тогда температура должна быть связана со средней кинетической энергией, приходящейся на одну частицу в системе большого числа частиц (здесь под системой понимается идеальный газ). Обозначим среднюю кинетическую энергию частицы в системе из N составляющих символом
где mi – масса i-й частицы системы; υi – скорость i-й частицы системы.
Слайд 11ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА
В случае, если масса всех частиц системы
где – среднеквадратичная или тепловая скорость частиц.
Пусть
Чтобы выразить температуру в Кельвинах, нужно знать коэффициент пропорциональности, показывающий, сколько джоулей соответствует одному Кельвину. Такой коэффициент называют постоянной Больцмана и, как следует из измерений, равен 1.38·10‑23 Дж/К, где К означает Кельвин. Тогда соотношение между температурой в и энергией запишется как
где k – константа Больцмана.
Слайд 12ТЕПЛОТА КАК ФОРМА ЭНЕРГИИ. ТЕМПЕРАТУРА
Полученная формула выражает среднюю кинетическую энергию поступательного
Подчеркнем, что температуры имеет статистический характер, т.к. она связана со средней энергией частиц. Отсюда можно говорить лишь о температуре системы достаточно большого числа частиц — макроскопической системы, и нельзя говорить о температуре одной или десяти частиц. При измерении температуры происходит обмен теплом между системой частиц и измерительным прибором термометром. Понятие температуры тела приобретает смысл в том случае, если обмен теплом между телом и прибором в процессе измерения температуры мало изменяет состояние тела.
Слайд 13ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ
Пусть в сосуде
Далее молекула долетит до противоположной стенки, отразится от нее и снова ударится о первую стенку. Время между ударами будет Δt = 2ℓ/(υx), а число ударов за 1 с n = 1/Δt =υx/(2ℓ). За 1 с молекула сообщит стенке импульс в проекции на ось x
Слайд 14ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ
Согласно 2 закону Ньютона
На данную стенку в направлении оси х в некоторый момент времени действуют множество частиц, что можно выразить как
Учитывая, что сила Fx отнесенная к площади стенки S имеет смысл давления, получим
где V – объем сосуда.
Слайд 15ДАВЛЕНИЕ ИДЕАЛЬНОГО ГАЗА. ОСНОВНОЕ УРАВНЕНИЕ МКТ
Заметим, что в условиях теплового равновесия
где n – концентрация молекул газа в сосуде.
Соотношение
называется основным уравнением молекулярно-кинетической теории газов.
Слайд 16РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА
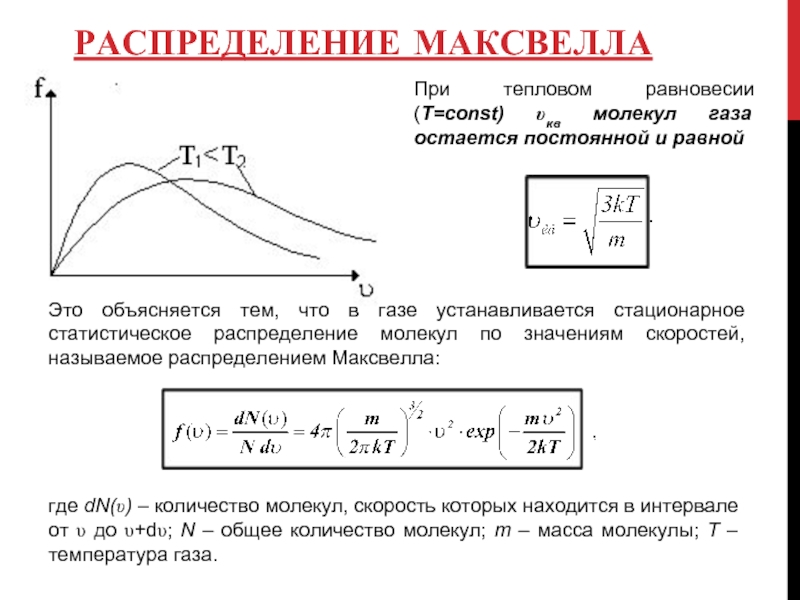
При тепловом равновесии (Т=cоnst) υкв молекул газа остается постоянной и
Это объясняется тем, что в газе устанавливается стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла:
где dN(υ) – количество молекул, скорость которых находится в интервале от υ до υ+dυ; N – общее количество молекул; m – масса молекулы; T – температура газа.
Слайд 17РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА
Т.о., f(υ) равна вероятности того, что величина скорости наугад выбранной
Знание f(υ) молекул газа позволяет вычислять средние значения любых функций скорости, например средней арифметической скорости <υ>
Слайд 19БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
Рассмотрим столб газа сечением S, находящийся при T=const в поле
dP = ‑ (ρ g dV)/S = ‑ ρ g dz.
Решив данное уравнение относительно P получим барометрическую формулу
Данное выражение определяет давление газа на высоте z, когда газ находится в поле силы тяжести, а Т=const.
Слайд 20РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
Пользуясь барометрической формулой и уравнением состояния идеального газа легко
где n0 концентрация молекул с нулевой потенциальной энергией Ep.
Данное выражение называют распределение Больцмана.
Согласно распределению Больцмана число частиц, обладающих определенными значениями потенциальной энергии определяется отношением величины потенциальной энергии и kT. Чем больше энергия теплового движения, тем более разупорядочена система частиц, значит, тем более однородно распределены частицы в пространстве. В случае
kT << Ep распределение частиц максимально упорядочено: плотность частиц максимальная в состоянии с минимальной потенциальной энергией, в то время как плотность частиц в других состояниях равна нулю.
Слайд 21ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО
Внутренняя энергия является важной характеристикой состояния системы и определяется как среднее значение полной энергии ее частиц. Выделяют следующие составляющие внутренней энергии:
- энергия поступательного, вращательного и колебательного движений атомов и молекул;
- энергия межмолекулярного взаимодействия;
- энергия связи атомов в молекулах (химическая энергия);
- энергия связи электронов в атомах;
- энергия связи атомных ядер и др.
Внутренняя энергия имеет следующие свойства:
- в состоянии теплового равновесия движение частиц системы таково, что в любой момент времени среднее значение полной энергии частиц с высокой степенью точности равняется внутренней энергии (статистические флуктуации очень малы);
- является функцией термодинамических параметров;
- обладает свойством аддитивности.
Слайд 22ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО
Внутренняя энергия идеального газа в равновесном состоянии является суммой энергий поступательного, вращательного и колебательного движений атомов и молекул. При нормальных условиях для вычисления внутренней энергии используют закон равнораспределения энергии по степеням свободы:
В состоянии теплового равновесия на каждую поступательную и вращательную степень свободы в среднем приходится энергия, равная
кТ / 2, а на колебательную – кТ.
Число степеней свободы i – это минимальное количество координат, однозначно определяющих положение механической системы в пространстве (или количество независимых движений, благодаря которым тело обладает энергией).
Слайд 23ВНУТРЕННЯЯ ЭНЕРГИЯ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО
Средняя энергия молекулы может быть представлена как
где
– количество степеней свободы молекулы.
Для идеального газа массой m внутренняя энергия может быть выражена как