Лекция 2
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия в жидких средах презентация
Содержание
- 1. Коррозия в жидких средах
- 2. К о р р о з и
- 3. - химическая реакция с металлом,
- 4. К о р р о з и
- 5. определяются предельной Р, V жидкого
- 6. Опасен и часто
- 7. перенос М от более
- 8. Электролитная коррозия Основа - теория
- 9. Устанавливаются равновесия (1)
- 10. УСЛОВИЯ ПРОТЕКАНИЯ ПАРАЛЛЕЛЬНЫХ РЕАКЦИЙ
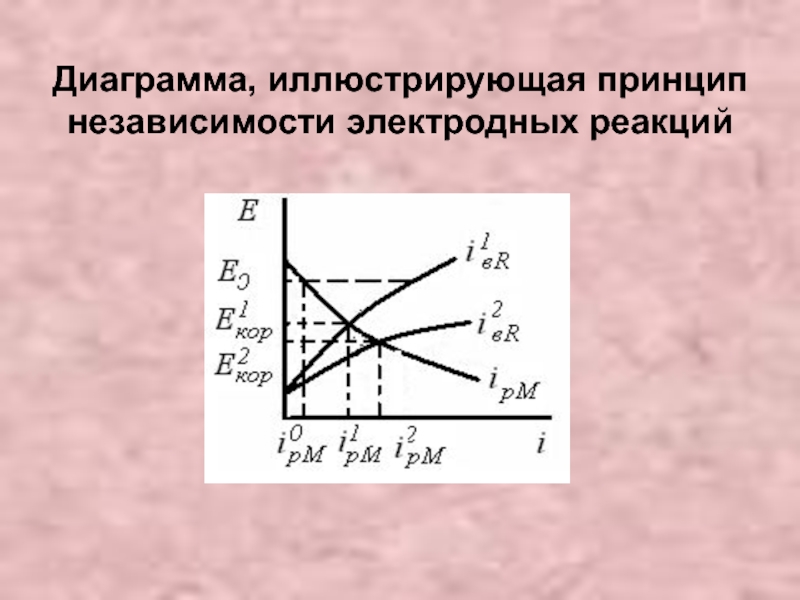
- 11. Диаграмма, иллюстрирующая принцип
- 12. Следствия из принципа По первому следствию при
- 13. Выражение скорости и потенциала коррозии
- 14. Подставив Екор в выражения для скорости получим:
- 15. Если катодная реакция лимитируется диффузией
- 16. Условие протекания коррозии:
- 17. Теория локальных гальванических элементов
- 18. Теорию подтверждали: - обнаруженные
- 20. Рис.2. Диаграмма при наличии
- 21. Точка пересечения исправленной катодной кривой
- 22. 2. Аналитический
- 23. jR= (рЕОх/R -
- 24. Недостатки ТЛГЭ
- 25. Модификационная теория Использует верную модель
- 26. 2. Разность Е между катодными и анодными
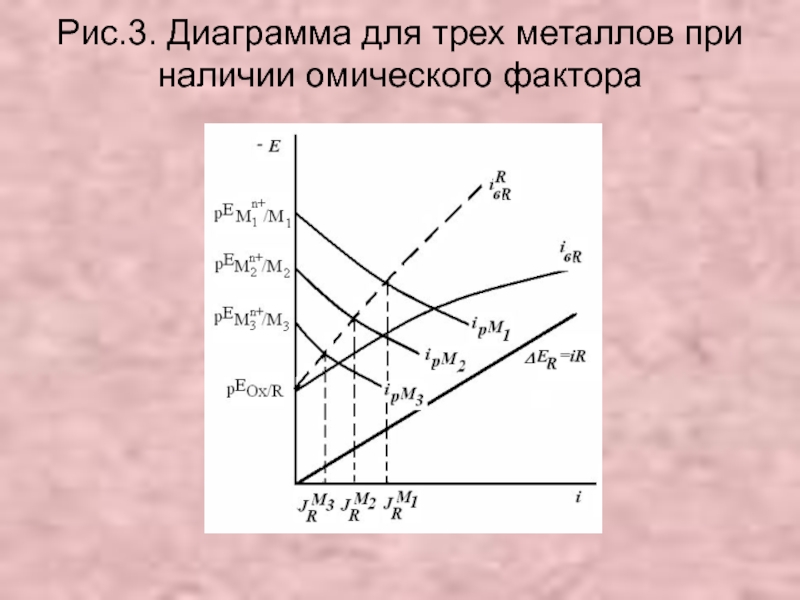
- 27. Рис.3. Диаграмма для трех металлов при наличии омического фактора .
- 28. Механизмы коррозии Го м о г е
- 29. Условие стационарности Екор имеет вид:
- 30. 2. Г е т е р о
- 31. Экстраполяция тафелевых участков на линию Екор
- 32. Гетерогенность
Слайд 2К о р р о з и я в
Обезвоженные апротонные органические растворители, жидкий бром, расплавленная сера и др.
Основными стадиями процесса являются:
- диффузия Ох к поверхности,
- его хемосорбция,
Слайд 3 - химическая реакция с металлом,
- десорбция
В зависимости от растворимости и защитных свойств пленки возможен кинетический, диффузионный или смешанный контроль. При наличии прослойки воды происходит электрохимическая коррозия.
Слайд 4К о р р о з и я в ж
Этот Ф/Х процесс происходит в теплоносителях, имеет ряд разновидностей и заключается либо в переходе твердого М в жидкий, либо наоборот.
Простой случай - непосредственное растворение твердого металла в жидком. Количество растворившегося М и скорость процесса
Слайд 5 определяются предельной Р, V жидкого М и скоростью его
Слайд 6 Опасен и часто встречается термический перенос массы
Имеет следующие разновидности: выравнивание концентраций металлических и неметаллических компонентов сплавов, погруженных в жидкий М;
Слайд 7 перенос М от более к менее напряженным участкам
Слайд 8Электролитная коррозия
Основа - теория коррозионного полиэлектрода, а также термодинамика,
Слайд 9 Устанавливаются равновесия (1) – (6):
МmOn + 2n H3O+ + 2 e ⇆ m M + 3n H2O (2)
MmOn + n H2O + 2n e ⇆ m M +2 nOH- (3)
М(ОН)n + n H3O+ +n e ⇆ M + 2n H2O (4)
M(OH)n + n e ⇆ M + n OH- (5)
Ox + z e ⇆ R (6)
Слайд 10УСЛОВИЯ ПРОТЕКАНИЯ ПАРАЛЛЕЛЬНЫХ РЕАКЦИЙ
Принцип независимости:
В отсутствие осложняющих обстоятельств кинетическое уравнение ( поляризационная кривая) для данной реакции не изменяется при протекании на электроде других электрохимических реакций.
Слайд 12Следствия из принципа
По первому следствию при заданном Е (Е=Е0) (рис.) скорость
Второе следствие относится к стационарному Екор, при котором скорости АР и КР взаимозависимы, но это обусловлено только изменением Екор (рис). Например, при , растворение металла сопряжено с первой катодной реакцией j1 ≡ , при в условиях изменения ПК катодной реакции j2≡ .
Реакции сопряжены за счет общего Екор.
Слайд 13Выражение скорости и потенциала коррозии
Если Екор удален от рЕ
и уравнения при ЗЭС в конц. растворе ( ψ1 = 0) имеют вид:
ipM = kM exp [(1- αM) nFE/(RT)] (7)
iвR = kOx [Ox] exp[-αOxzFE/(RT)] (8)
При Екор ipM= iвR; значит Екор (9):
Слайд 15 Если катодная реакция лимитируется диффузией Ох или при Екор
Слайд 16 Условие протекания коррозии:
рЕМn+/M < Екор < pEOx/R
По уравнению Нернста при τ=0
рЕМn+/M = ∞, т.к. [Mn+]=0
pEOx/R = ∞ , т.к. [R]=0
Следовательно, все металлы должны корродировать при малых τ.
Слайд 17Теория локальных гальванических элементов
При
Скорость процесса тем выше, чем больше разность потенциалов между электродами - движущая сила процесса.
Слайд 18Теорию подтверждали:
- обнаруженные катодные и анодные участки на
- снижение j по мере очистки металла от примеси.
Слайд 19 Предложены графический и аналитический
1. Графический расчет проводился без учета омического фактора и его иллюстрируют кривые Е – iрМ и Е –iвR на рис.2, позволяющие определить Екор и jмах:
Слайд 21 Точка пересечения исправленной катодной кривой Е –
= - = jR⋅R (10)
Чем больше R, тем выше неэквипотенциальность поверхности и меньше jR.
Слайд 22 2. Аналитический расчет
рЕ Ох/R - рЕ Мn+/М = ωк jR + ωа jR + RjR (11)
Отсюда следует выражение для jR:
Слайд 23
jR= (рЕОх/R - рЕМn+/М)/( ωк + ωа +
где ω - удельная поляризуемость при малой ΔЕ, когда зависимости Е – iрМ и Е- iвR прямолинейны.
Это недостаток подхода, т.к. в реальных условиях при ΔЕ больше 50 мВ следует использовать тафелевы зависимости.
Слайд 24Недостатки ТЛГЭ
Не
чистых металлов с однородной эквипотенциальной поверхностью ( Hg в HNO3),
электроположительных М , у которых примеси более электроотрицательные (Au в царской водке),
тот факт, что некоторые ЭП примеси
(Pb, Cd) тормозили кислотную коррозию Zn
Слайд 25Модификационная теория
Использует верную модель ЛГЭ ,но отличается от положениями:
1.
Слайд 262. Разность Е между катодными и анодными участками - следствие омического
Слайд 28Механизмы коррозии
Го м о г е н н о- э л
Реализуется на чистых М, поверхность которых однородна химически и структурно. Катодная и анодная реакции не связаны постоянно с ее определенными участками и могут мигрировать.
Sк = Sа =1/2Sобщ.
Слайд 29 Условие стационарности Екор имеет вид:
JpM =
Т.к. Sа = Sк, то при Екор ipM = iвR . При достаточной поляризации ipM ≈ iа и
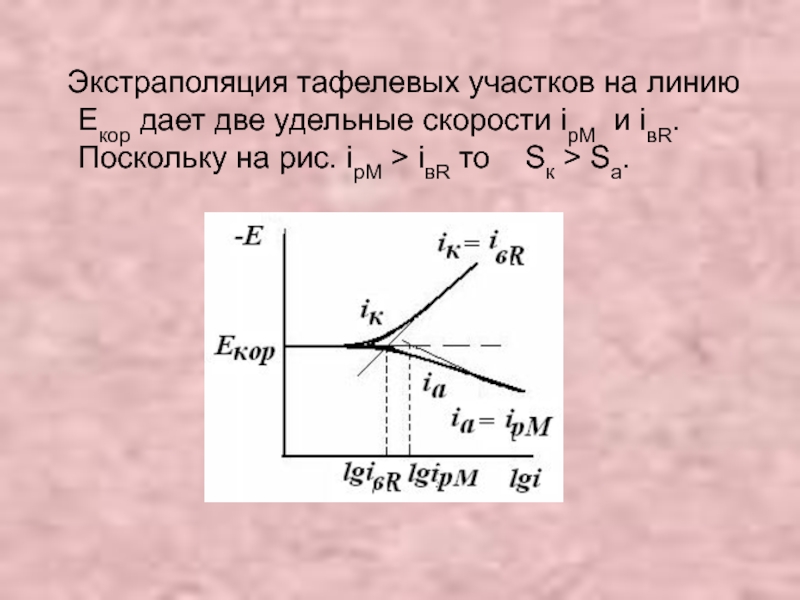
iвR ≈ iк. При экстраполяции прямых Е-lg iк и Е-lg iа на значение Е= Екор позволяет определить ipM и iвR. Критерий механизма - точка пересечения экстраполированных участков ПК отвечает стационарному Екор.
Слайд 302. Г е т е р о г е н н
Слайд 31 Экстраполяция тафелевых участков на линию Екор дает две удельные скорости
Слайд 32Гетерогенность
Различают
( температуры, давления, полей).