- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация электродов. (Лекция 4) презентация
Содержание
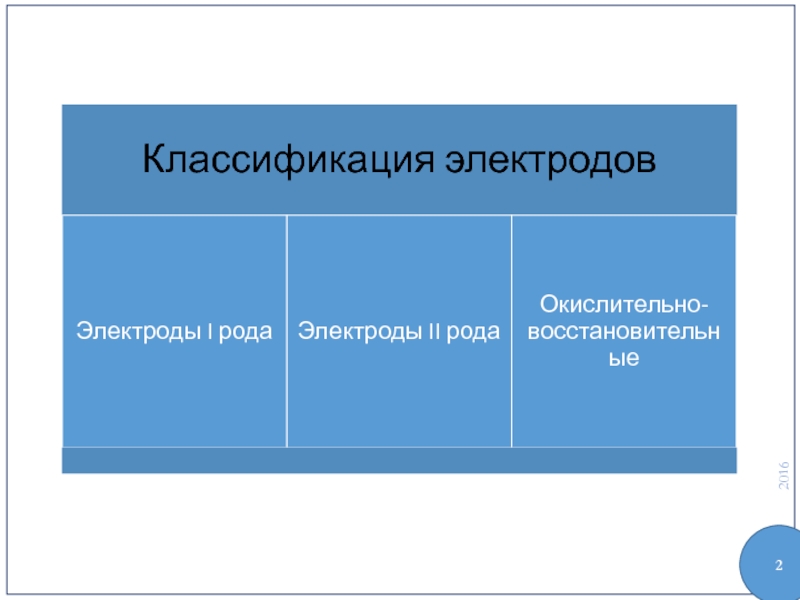
- 1. Классификация электродов. (Лекция 4)
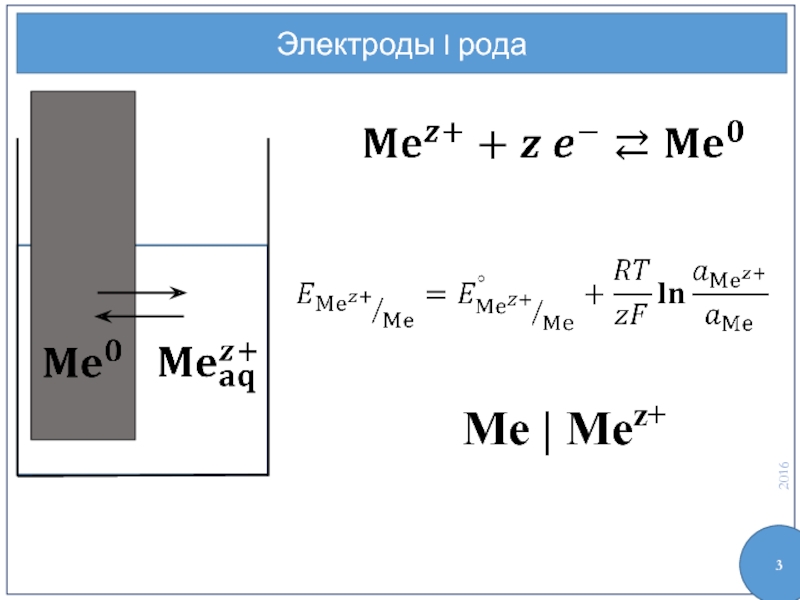
- 3. Электроды I рода Me | Mez+
- 4. Электроды I рода Cu в растворе CuSO4 Cu | Cu2+
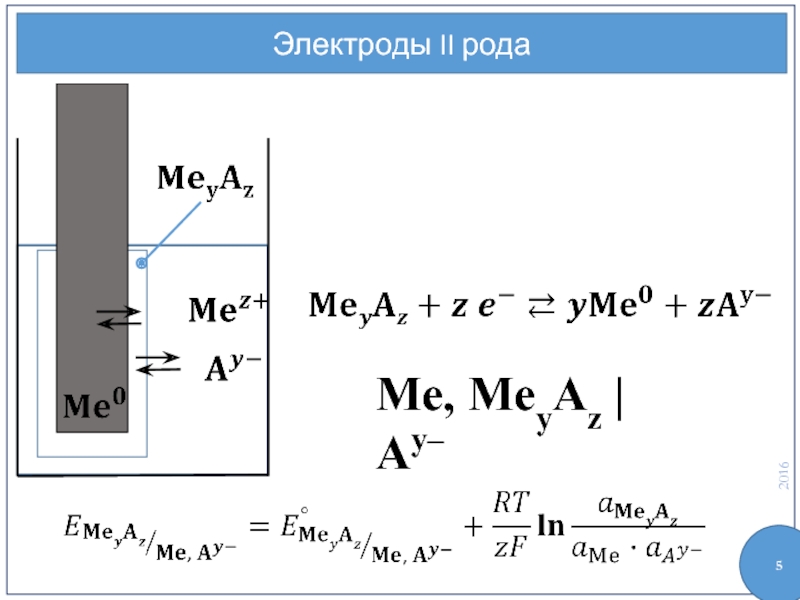
- 5. Электроды II рода Me, MeyAz | Ay–
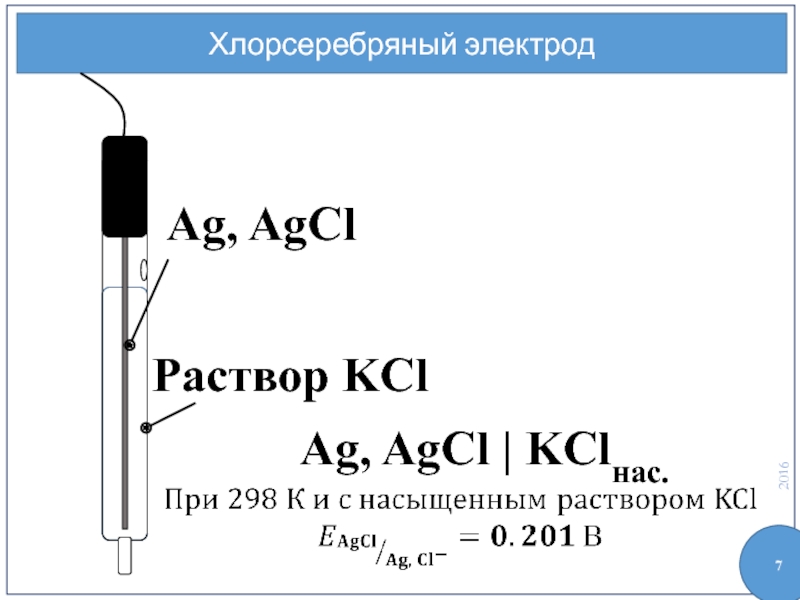
- 6. Хлорсеребряный электрод Ag, AgCl | Cl– — электрод сравнения
- 7. Хлорсеребряный электрод Ag, AgCl Раствор KCl Ag, AgCl | KClнас.
- 8. Электроды II рода Hg, HgO | OH– Оксидно-ртутный электрод
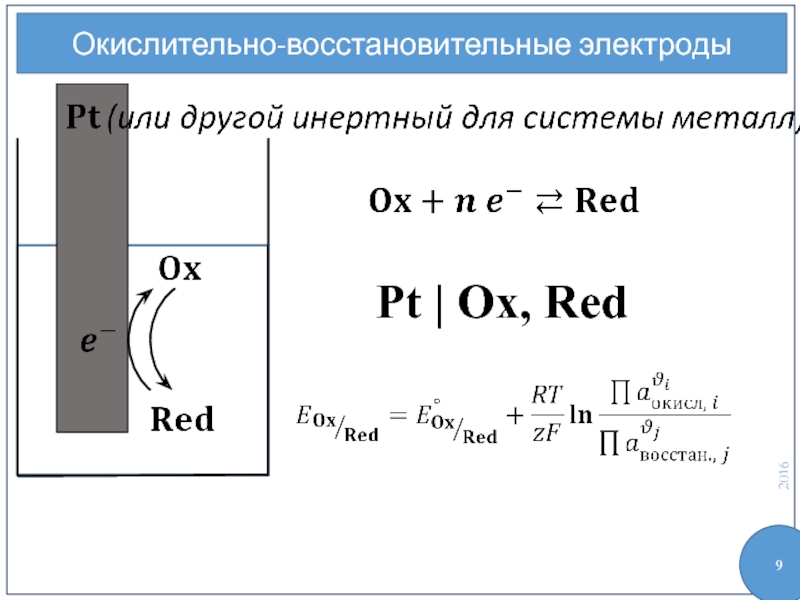
- 9. Окислительно-восстановительные электроды Pt | Ox, Red
- 10. Окислительно-восстановительные электроды Pt | Fe3+, Fe2+
- 11. Окислительно-восстановительные электроды
- 12. Хингидронный электрод — индикаторный электрод для измерения pH
- 13. Водородный электрод — индикаторный электрод для измерения pH
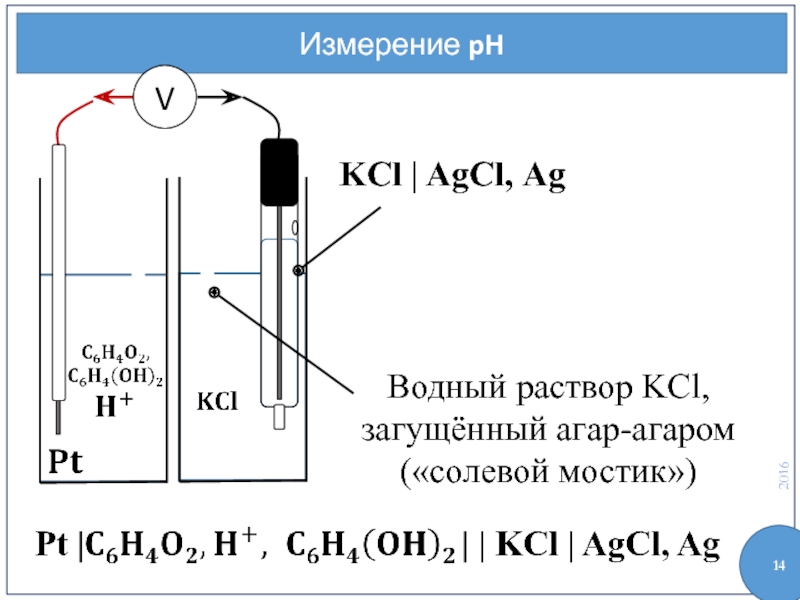
- 14. Измерение pH KCl | AgCl, Ag
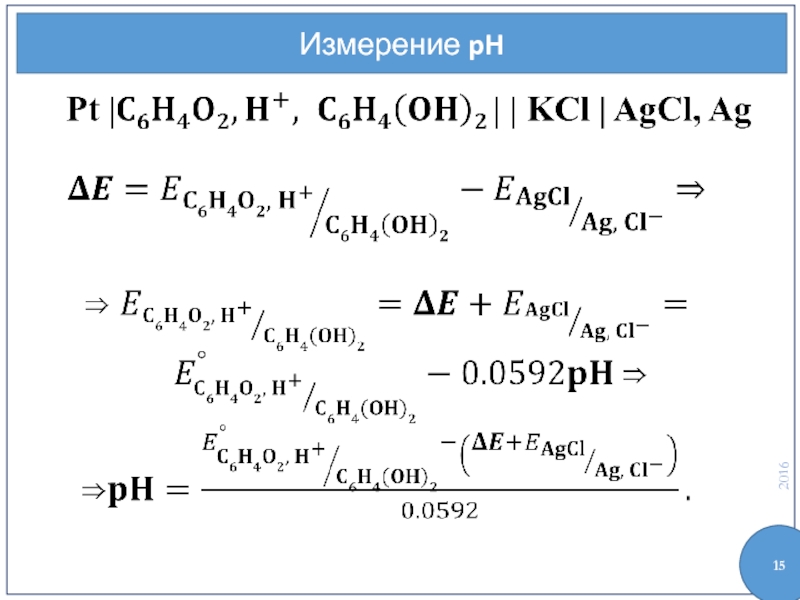
- 15. Измерение pH
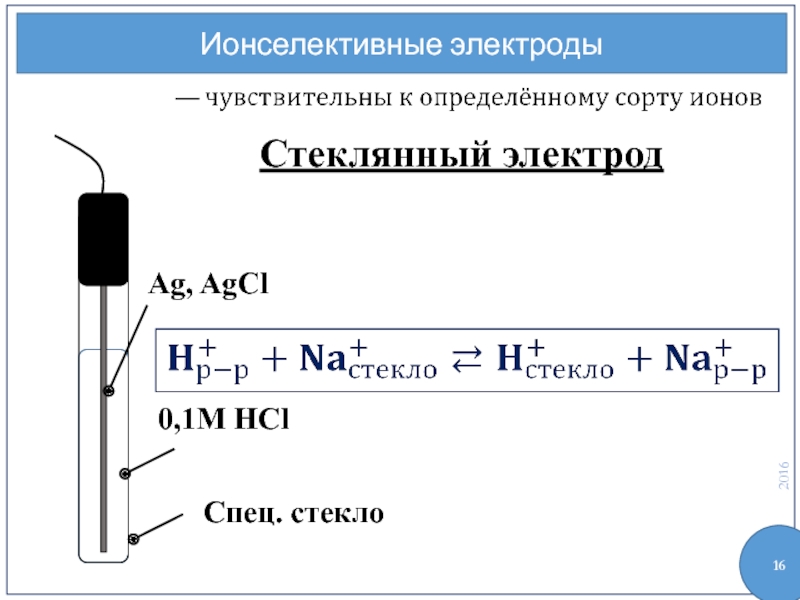
- 16. Ионселективные электроды Ag, AgCl 0,1M HCl Стеклянный электрод Спец. стекло
- 17. Стеклянный электрод
- 18. Ионселективные электроды Есть стеклянные электроды, селективные к
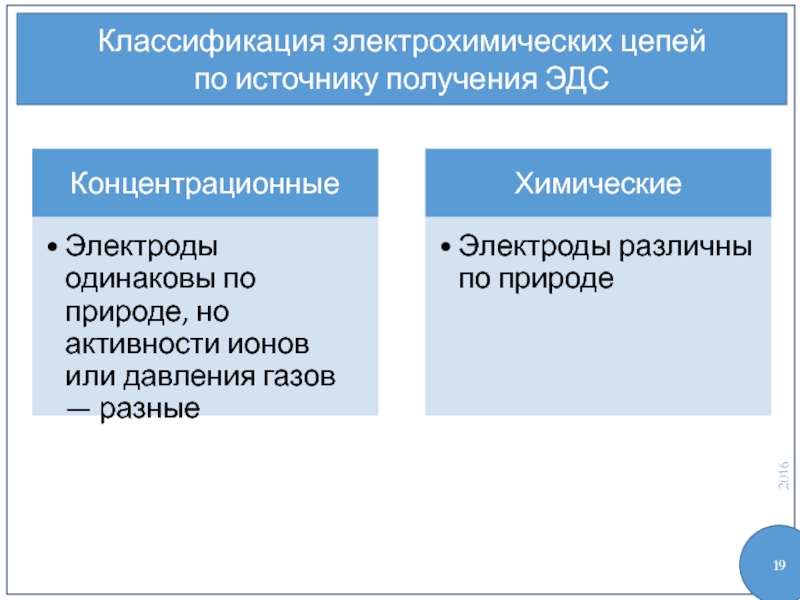
- 19. Классификация электрохимических цепей по источнику получения ЭДС
- 20. Химическая кинетика — изучает закономерности протекания химических процессов во времени
- 21. Основные понятия химической кинетики Скорость химической реакции — …
- 22. Основные понятия химической кинетики Если V (или
- 23. Основные понятия химической кинетики Скорость химической реакции общая и по веществу
- 24. Основные понятия химической кинетики Скорость химической реакции общая и по веществу
- 25. Основные понятия химической кинетики Реагируют только те
- 26. Основные понятия химической кинетики
- 27. Основные понятия химической кинетики k — константа
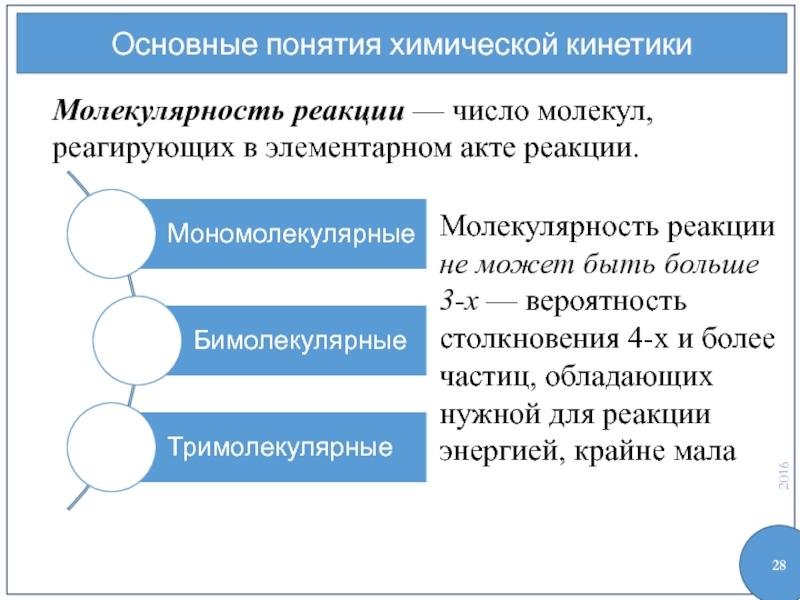
- 28. Основные понятия химической кинетики Молекулярность реакции —
- 29. Основные понятия химической кинетики Общий порядок реакции
- 30. Кинетика простых химических реакций Простые химические реакции — реакции, необратимо протекающие в одну стадию.
- 31. Кинетика простых химических реакций
- 32. Кинетика простых химических реакций
- 33. Кинетика простых химических реакций
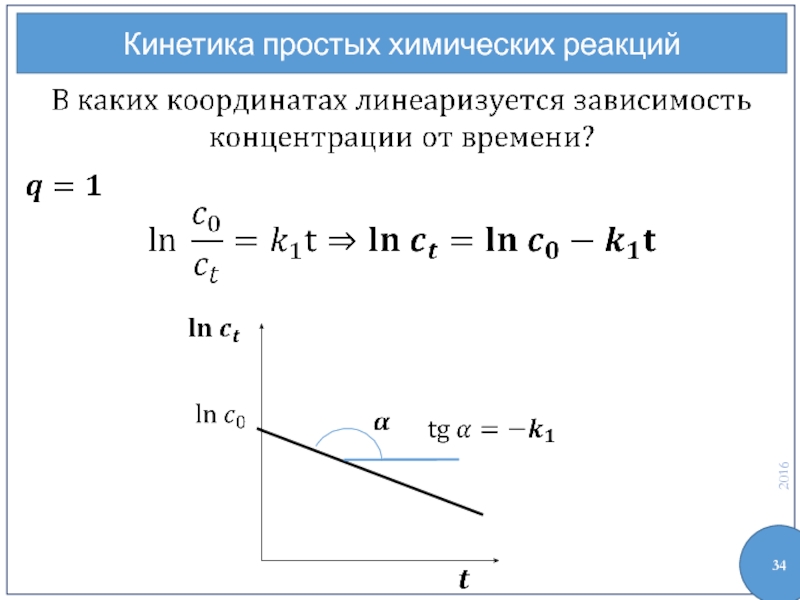
- 34. Кинетика простых химических реакций
- 35. Кинетика простых химических реакций
- 36. Кинетика простых химических реакций
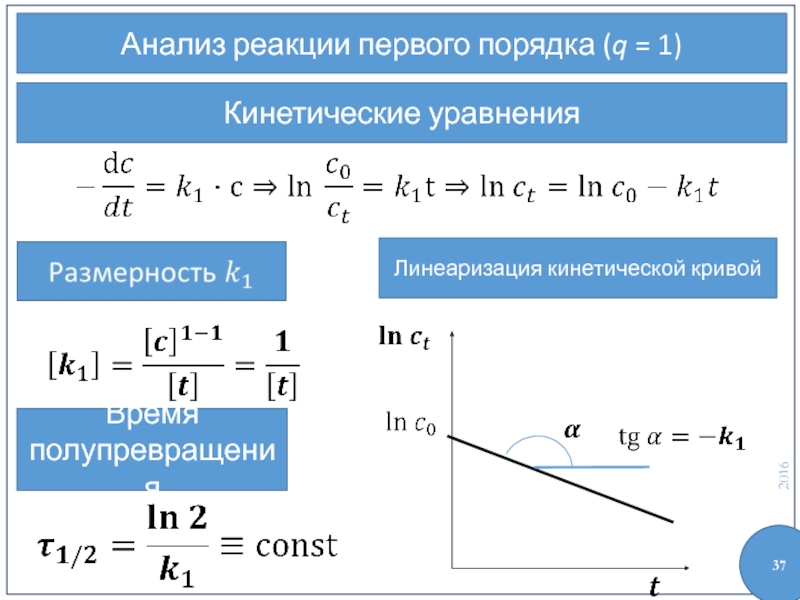
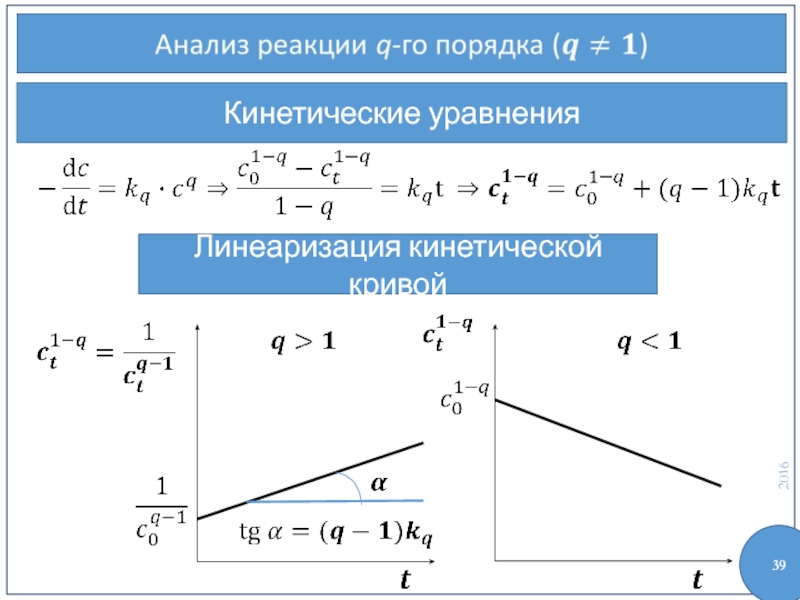
- 37. Анализ реакции первого порядка (q = 1)
- 38. Кинетические уравнения
- 39. Кинетические уравнения Линеаризация кинетической кривой
- 40. Кинетические уравнения Время полупревращения
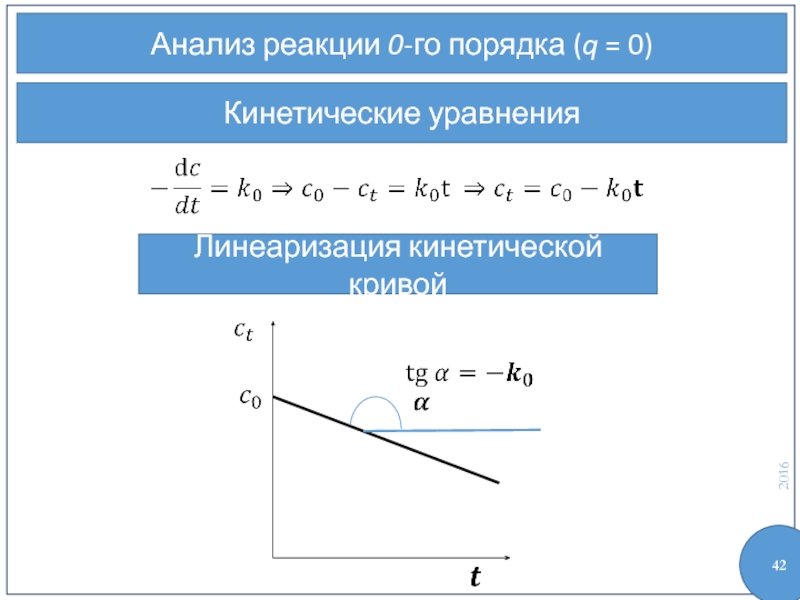
- 41. Анализ реакции 0-го порядка (q = 0) Кинетические уравнения
- 42. Анализ реакции 0-го порядка (q = 0) Кинетические уравнения Линеаризация кинетической кривой
- 43. Кинетические уравнения Время полупревращения
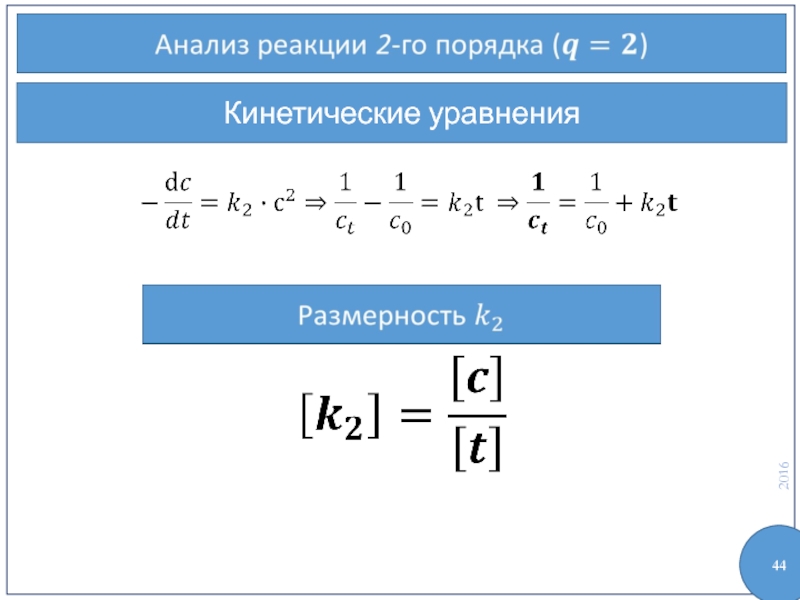
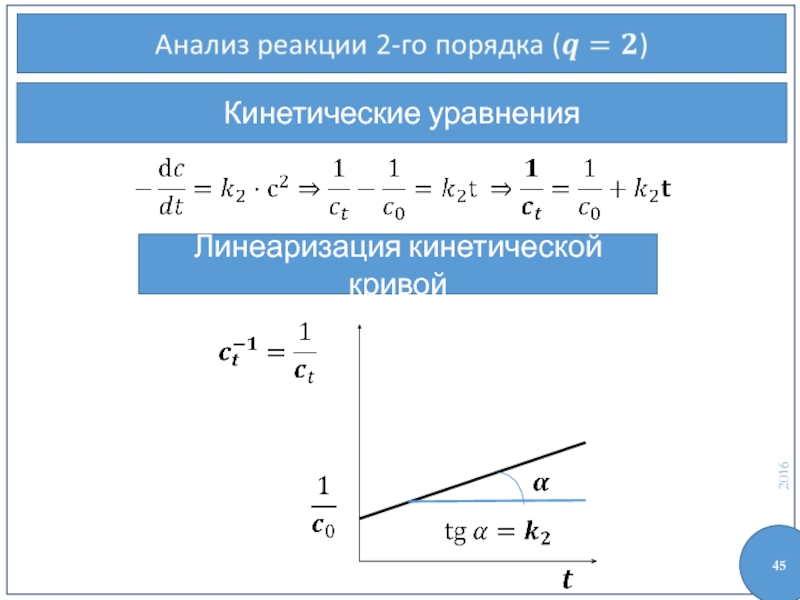
- 44. Кинетические уравнения
- 45. Кинетические уравнения Линеаризация кинетической кривой
- 46. Кинетические уравнения Время полупревращения
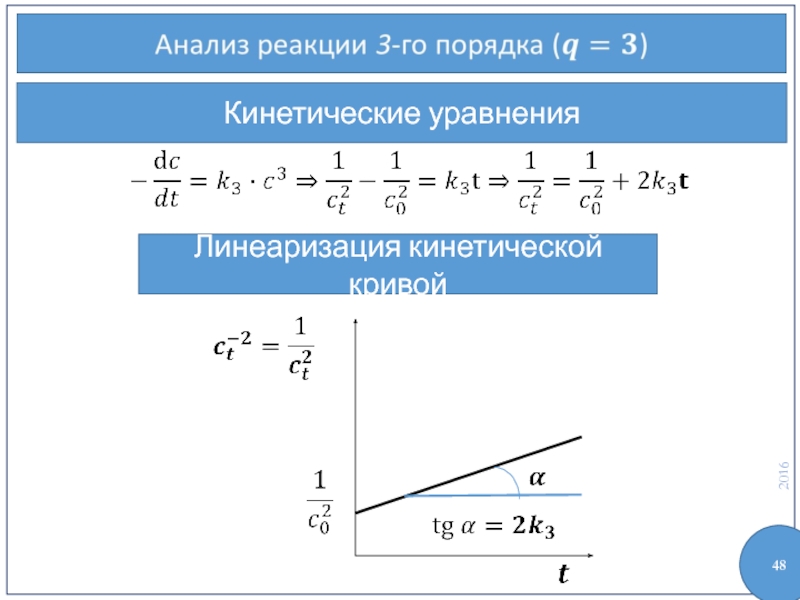
- 47. Кинетические уравнения
- 48. Кинетические уравнения Линеаризация кинетической кривой
- 49. Кинетические уравнения Время полупревращения
- 50. Влияние температуры на скорость реакции Правило Вант-Гоффа Соблюдается не для всех реакций!
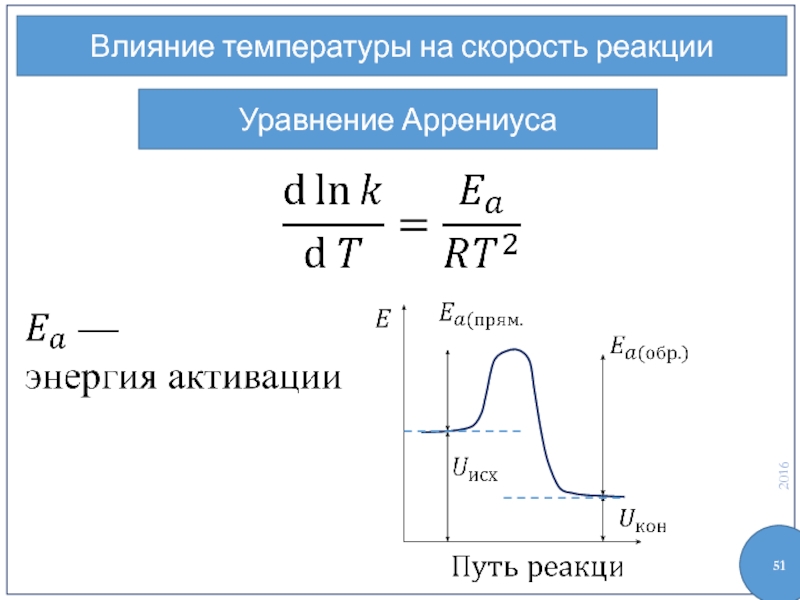
- 51. Влияние температуры на скорость реакции Уравнение Аррениуса
- 52. Влияние температуры на скорость реакции Уравнение Аррениуса
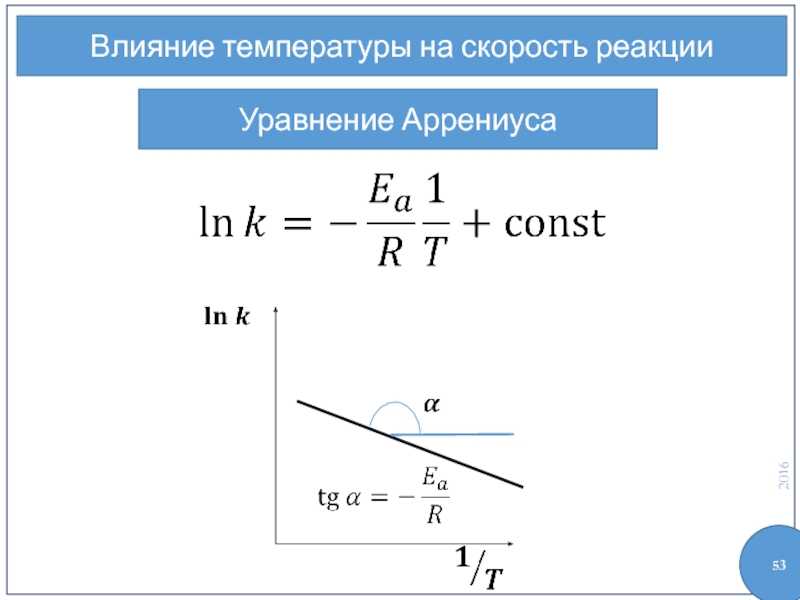
- 53. Влияние температуры на скорость реакции Уравнение Аррениуса
- 54. Влияние температуры на скорость реакции Уравнение Аррениуса
Слайд 18Ионселективные электроды
Есть стеклянные электроды, селективные к ионам: Na+, K+, Li+, Cs+,
Есть мембранные электроды, селективные к ионам: Ca2+, Mg2+, Pb2+, La3+, Cl–, Br–, I–, NO3– и др.
Слайд 22Основные понятия химической кинетики
Если V (или S) = const —
Скорость
Слайд 25Основные понятия химической кинетики
Реагируют только те молекулы, которые сталкиваются, поэтому скорость
— закон действующих масс
Слайд 27Основные понятия химической кинетики
k — константа скорости реакции — скорость реакции
Размерность k — зависит от общего порядка реакции!
Слайд 28Основные понятия химической кинетики
Молекулярность реакции — число молекул, реагирующих в элементарном
Молекулярность реакции не может быть больше 3-х — вероятность столкновения 4-х и более частиц, обладающих нужной для реакции энергией, крайне мала
Слайд 29Основные понятия химической кинетики
Общий порядок реакции может совпадать с молекулярностью, если
В общем случае частные порядки и стехиометрические коэффициенты принимают разные значения.
Слайд 30Кинетика простых химических реакций
Простые химические реакции — реакции, необратимо протекающие в