- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кинетическая модель гетерогенных химических процессов. (Темы 5.3 - 5.4) презентация
Содержание
- 1. Кинетическая модель гетерогенных химических процессов. (Темы 5.3 - 5.4)
- 2. Темы 5.3 - 5.4
- 3. Тема 5.3.1 Гетерогенный химический процесс с текучими фазами
- 4. Условия гетерогенного процесса параметры состояния каждой из
- 5. Способы межфазного взаимодействия в системах
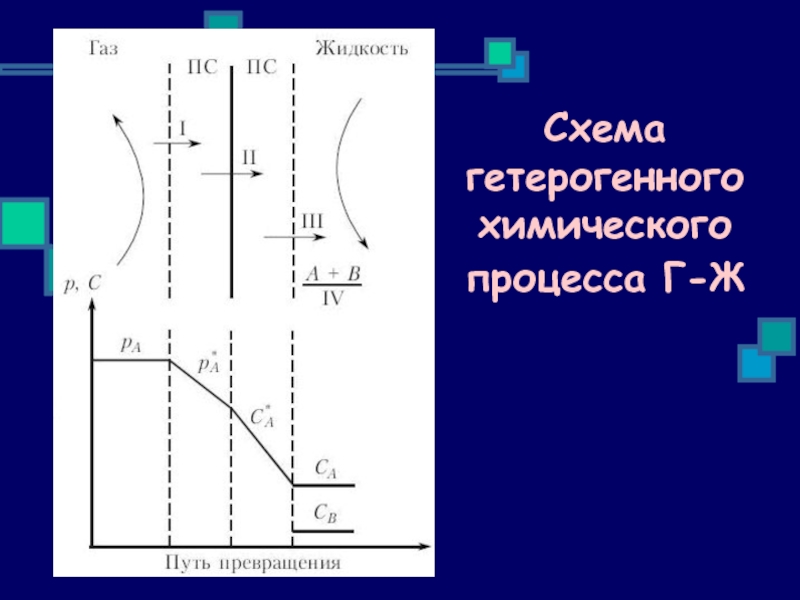
- 6. Схема гетерогенного химического процесса Г-Ж
- 7. Этапы гетерогенного химического процесса Г-Ж
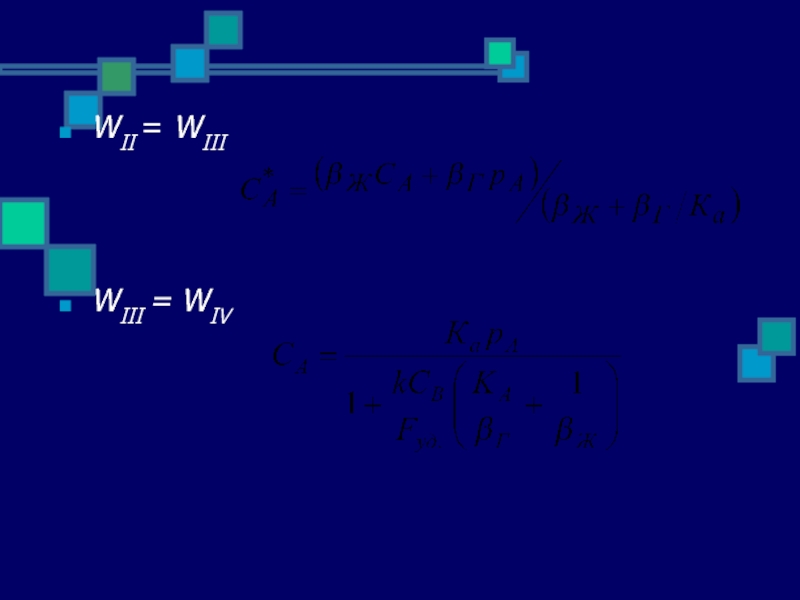
- 8. WII = WIII
- 9. Зависимость концентрации компонента А в жидкой фазе
- 10. Кинетический режим - определяющей стадией является реакция
- 11. Зависимость наблюдаемой скорости превращения WН от
- 12. Тема 5.3.2 Гетерогенный химический процесс с твердым реагентом
- 13. «Сжимающаяся сфера» В результате превращения образуются
- 14. «Сжимающееся ядро» Кроме газообразных и жидких
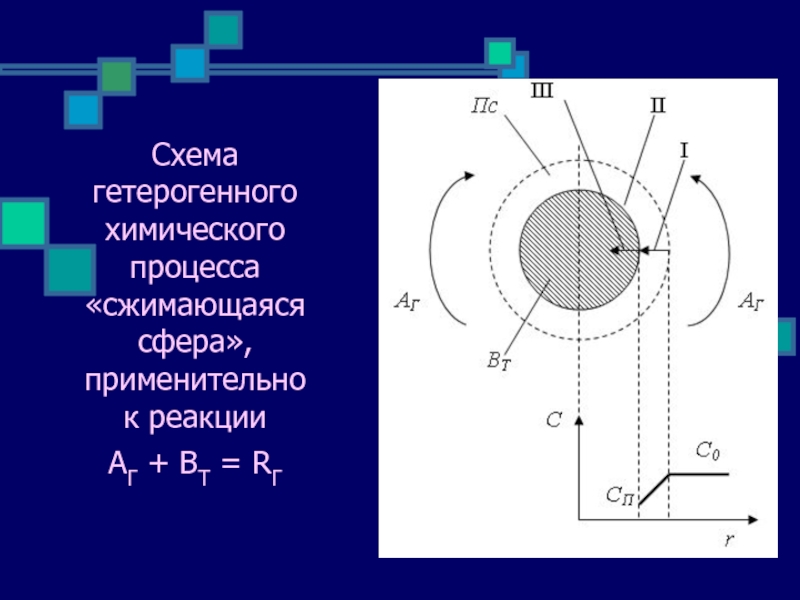
- 15. Схема гетерогенного химического процесса «сжимающаяся сфера», применительно
- 16. Стадии процесса «сжимающаяся сфера» Этап I.
- 17. Скорость уменьшения размера твёрдой частицы намного медленнее
- 18. Наблюдаемая скорость превращения для реакции первого порядка
- 19. Изменение количества твёрдого компонента NВ в единицу
- 20. Время полного превращения (при τ= τк и
- 21. Зависимость степени превращения от изменения радиуса частицы
- 22. Анализ гетерогенного процесса «сжимающаяся сфера» Если
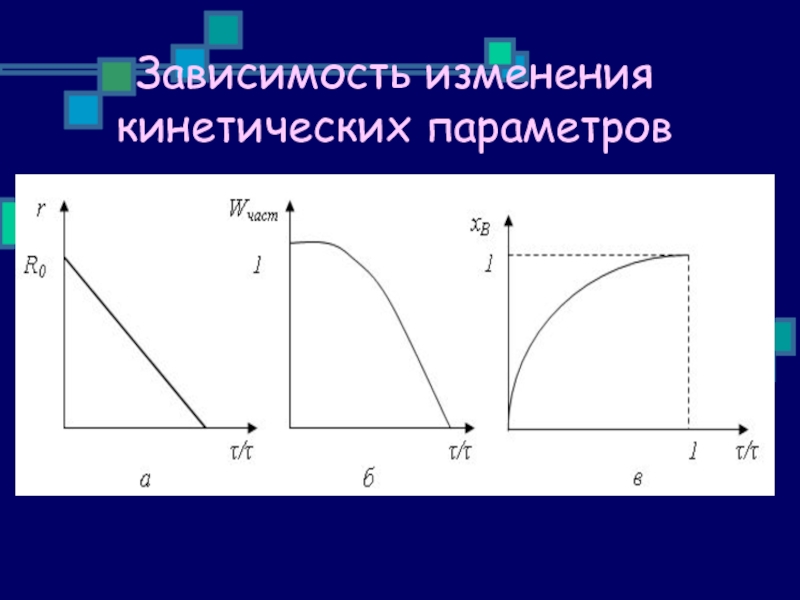
- 23. Зависимость изменения кинетических параметров
- 24. Тема 5.4 Гетерогенный химический процесс с твёрдым катализатором
- 25. Катализ — изменение скорости химической реакции в
- 26. Процессы адсорбции и десорбции – необходимые стадии
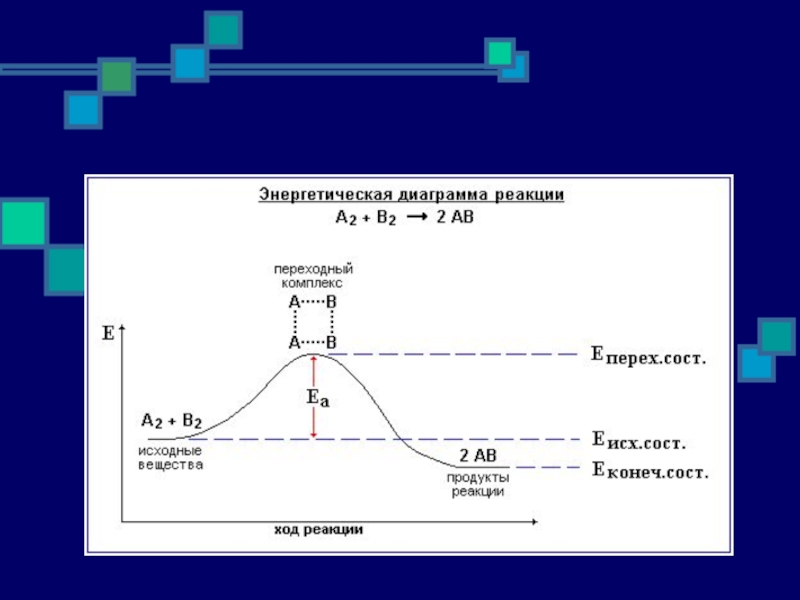
- 27. Активный комплекс - непрерывно изменяющееся переходное состояние,
- 29. Энергетический барьер реакции - разность между значениями
- 30. Промежуточное соединение, в которое входит катализатор, превращается
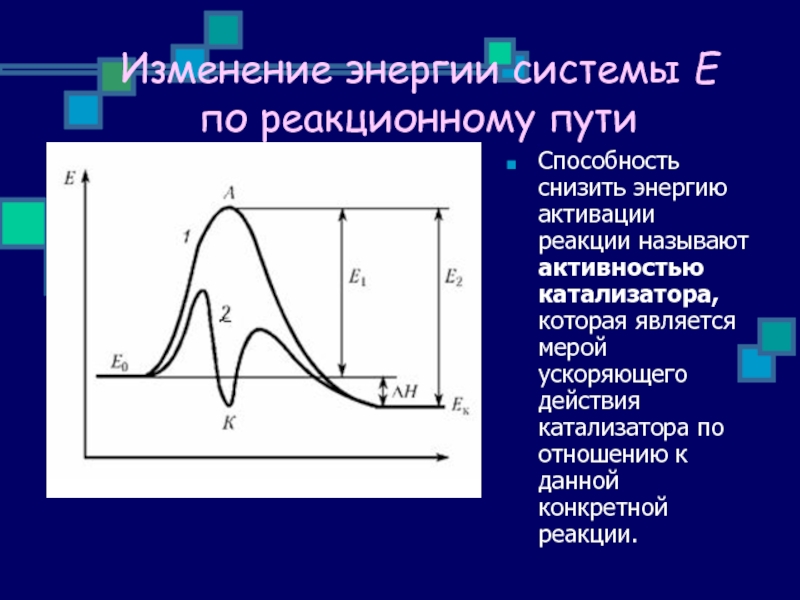
- 31. Изменение энергии системы Е по реакционному пути
- 32. В простых реакциях катализатор не влияет на
- 33. По фазовому состоянию каталитические реакции подразделяют на
- 34. Промышленные твердые катализаторы- сложная смесь (контактная масса),
- 35. Показатели, характеризующие эксплуатационную ценность промышленных катализаторов
- 36. Показатели, характеризующие эксплуатационную ценность промышленных катализаторов
Слайд 2
Темы 5.3 - 5.4
5.3 Кинетическая модель гетерогенных химических процессов:
Гетерогенный химический
Гетерогенный химический процесс с твердым реагентом
5.4 Гетерогенный химический процесс с твердым катализатором
Слайд 4Условия гетерогенного процесса
параметры состояния каждой из фаз (температура, давление, катализатор, концентрации)
параметры
транспортные свойства веществ (диффузия, теплопроводность, вязкость)
Слайд 5
Способы межфазного взаимодействия в системах Г-Ж и Ж-Ж
а) барботаж – диспергирование
б) орошение – диспергирование жидкости в виде капель в объёме движущегося газа;
в) пленочное течение – образование текущей жидкой плёнки на поверхности насадки; газ проходит в свободном пространстве;
г) газожидкостной поток – возмущенные потоки газа и жидкости движутся в одном направлении.
Слайд 7
Этапы гетерогенного химического процесса Г-Ж
этап I – перенос компонента А из
этап II – перенос компонента А через поверхность раздела фаз в жидкость;
этап III – перенос компонента А от поверхности раздела через жидкостной пограничный слой в объём жидкости;
этап IV – реакция между А и В в жидкости.
Слайд 9Зависимость концентрации компонента А в жидкой фазе от параметров системы
Уравнение
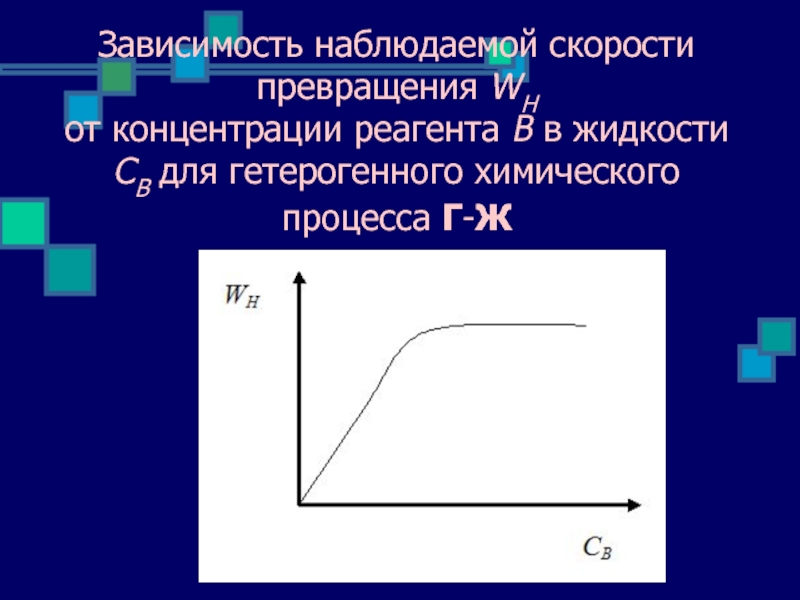
Слайд 10Кинетический режим - определяющей стадией является реакция с максимальной движущей силой
WН = - k Kа pА CВ
Диффузионный режим - определяющей стадией является массоперенос вещества А с максимальной движущей силой при
(СА близка к нулю)
WН = - β0 Kа pА
Слайд 11Зависимость наблюдаемой скорости превращения WН от концентрации реагента В в жидкости
Слайд 13«Сжимающаяся сфера»
В результате превращения образуются только газообразные и жидкие продукты,
Размеры твёрдого реагента постепенно уменьшаются вплоть до исчезновения
Слайд 14«Сжимающееся ядро»
Кроме газообразных и жидких образуется твёрдый продукт, остающийся на
Реакция протекает на поверхности ядра, в результате чего оно уменьшается
Размер твёрдой частицы практически не меняется
Слайд 15Схема гетерогенного химического процесса «сжимающаяся сфера», применительно к реакции АГ +
Слайд 16Стадии процесса «сжимающаяся сфера»
Этап I. Перенос реагента А из потока
Этап II. Реакция А с твёрдым В на поверхности частицы.
Этап III. Уменьшение размера частицы и удаление продуктов реакции в газовую фазу.
Слайд 17Скорость уменьшения размера твёрдой частицы намного медленнее скорости распространения концентраций в
Поток компонента А зависит от поверхности частицы радиусом Fr и разности концентрации А в потоке С0 и у поверхности СП
WI = - β Fr (С0 – СП)
Скорость реагирования А определяется скоростью его превращения на поверхности W(СП) и величиной поверхности частицы Fr
WII= W(СП) Fr
Слайд 19Изменение количества твёрдого компонента NВ в единицу времени
νВ = νА =
Количество прореагировавшего тонкого поверхностного слоя толщиной dr, содержащего dNВ = n0 Fr dr
Изменение размера частицы во времени
Слайд 20Время полного превращения (при τ= τк и r=0)
τк = R0 n0/(Кн
Зависимость радиуса частицы от времени
r = R0 (1 – τ/τк)
Зависимость изменения со временем скорости превращения, отнесённой к одной частице
Wчаст = WнS = - КнС04πr2 =
= -4πR02КнС0(1 – τ/τк)2
Слайд 21Зависимость степени превращения от изменения радиуса частицы
Зависимость степени превращения от времени
Слайд 22Анализ гетерогенного процесса «сжимающаяся сфера»
Если k
Если k >> β, то k/β → ∞, то процесс протекает в диффузионном режиме, а массоперенос является лимитирующей стадией
Слайд 25Катализ — изменение скорости химической реакции в присутствии веществ (катализаторов), многократно
Ускоряющее действие катализатора состоит в понижении энергии активации реакции в результате изменения реакционного пути.
Слайд 26Процессы адсорбции и десорбции – необходимые стадии гетерогенных каталитических процессов.
Если
Слайд 27Активный комплекс - непрерывно изменяющееся переходное состояние, в котором после соударения
Комплекс распадается, когда энергия колебательного движения химических связей, определяющая избыточную энергию молекулы, превышает некоторое предельное значение
Слайд 29Энергетический барьер реакции - разность между значениями средней энергии активных комплексов
Снижения энергетического барьера реакции можно достигать снижением энергетического уровня активных комплексов.
Путем снижения энергетического барьера и ускорения реакции является катализ
Слайд 30Промежуточное соединение, в которое входит катализатор, превращается далее в продукты реакции
Хотя при этом реакционный путь становится многостадийным и удлиняется, снижение энергии активных комплексов приводит к увеличению скорости реакции.
Катализатор может способствовать также достижению необходимой для взаимодействия ориентации молекул.
Слайд 31Изменение энергии системы Е по реакционному пути
Способность снизить энергию активации
Слайд 32В простых реакциях катализатор не влияет на равновесие системы, так как
В сложных реакциях катализатор не только ускоряет реакцию, но также влияет на селективность протекания превращения.
Способность ускорять только одну реакцию из нескольких возможных при многомаршрутных реакциях определяет селективность катализатора.
Слайд 33По фазовому состоянию каталитические реакции подразделяют на гомогенные, микрогетерогенные и гетерогенные.
В гомогенном и микрогетерогенном катализе катализатор находится в реакционной системе в молекулярно растворенном состоянии и образует с реагирующим веществом одну фазу.
В микрогетерогенном катализе катализатор — большие полимерные молекулы.
В гомогенных процессах катализатор действует на молекулярном уровне и вероятность столкновения молекул реагирующих веществ с молекулами катализатора весьма значительная.
Слайд 34Промышленные твердые катализаторы- сложная смесь (контактная масса), в составе которой выделяют
Носителями являются термостойкие, инертные, пористые вещества, на которые различными способами наносят катализирующее вещество.
Активаторы, или промоторы — вещества, повышающие каталитические свойства основного катализатора.
Слайд 35Показатели, характеризующие эксплуатационную ценность промышленных катализаторов
1) активность — мера ускоряющего
2) избирательность (селективность) — способность из нескольких реакций предпочтительно ускорять целевую
3) устойчивость к ядам — инертность к примесям — контактным ядам в сырье;
Слайд 36Показатели, характеризующие эксплуатационную ценность промышленных катализаторов
4) термостойкость — способность сохранять
5) регенерируемость — способность восстанавливать свою активность после многократной регенерации, особенно после выжига кокса с поверхности.
6) механическая прочность, хорошая теплопроводность, доступность, стоимость и др.