- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Идеальный газ. Давление газа. Средняя кинетическая энергия поступательного движения молекул. Концентрация молекул презентация
Содержание
- 1. Идеальный газ. Давление газа. Средняя кинетическая энергия поступательного движения молекул. Концентрация молекул
- 2. Идеальный газ Давление газа Средняя кинетическая
- 3. Основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) Уравнение Менделеева - Клапейрона Законы:
- 4. Все тела состоят из мельчайших частиц
- 5. Дополнительно для МКТ газа В любом, даже
- 6. При отсутствии внешних сил молекулы газа распределяются
- 7. Тепловое движение Хаотическое движение молекул тела
- 8. Идеальный газ – простейшая физическая модель реального
- 10. Давление газа – это результат соударений большого
- 12. Основное уравнение молекулярно-кинетической теории (уравнение Клаузиуса) Это
- 13. Давление идеального газа p пропорционально
- 14. Через среднюю кинетическую энергию молекулы это
- 15. Возникают вопросы: Каким образом можно
- 16. Такой величиной в физике является температура. Зависимость давления газа от температуры при V = const.
- 17. Английский физик У. Кельвин (Томсон) в 1848 г. предложил
- 19. Давление идеального газа определяется кинетической энергией его молекул. Распределение молекул по скоростям. T2 > T1.
- 20. Характерными параметрами распределения Максвелла являются наиболее вероятная
- 23. Таким образом, давление разреженного газа в сосуде
- 24. Объединяя эти соотношения пропорциональности, можно записать:
- 25. Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической
- 27. Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
- 29. Давление смеси газов на стенки сосуда будет
- 30. уравнение состояния идеального газа. Соотношение
- 31. В итоге получим: Произведение
- 32. Уравнение, устанавливающее связь между давлением, объемом и
- 33. Клапейрон Бенуа Поль Эмиль (26.I.1799–28.I.1864) Французский физик,
- 34. Менделеев Дмитрий Иванович (8.II.1834–2.II.1907) Русский ученый-энциклопедист..
- 35. Если температура газа равна Tн = 273,15 К (0 °С), а
- 36. И последнее, но очень важное: Для постоянной
- 38. Т.е. для двух любых состояний газа:
- 39. Задание не для слабонервных : Попытайтесь рассчитать
- 40. Нормальные условия: (напоминаю в последний раз!)
- 41. Закон Авогадро: один моль любого газа при
- 42. Сравним результат: Никто не ощутил приступа
- 43. После такой загрузки требуется хороший отдых!!! Удачи!!!
Слайд 2Идеальный газ
Давление газа
Средняя кинетическая энергия поступательного движения молекул
Концентрация молекул
Понятия и
Слайд 3
Основное уравнение молекулярно-кинетической теории
(уравнение Клаузиуса)
Уравнение Менделеева - Клапейрона
Законы:
Слайд 4
Все тела состоят из мельчайших частиц – атомов и молекул.
Атомы
Молекулы различных веществ по-разному взаимодействуют между собой. Взаимодействие это существенно зависит от типа молекул и от расстояний между ними. В частности, зависимостью молекулярных сил от межмолекулярных расстояний объясняется качественное различие разных агрегатных состояний тел.
Основные положения современной МКТ вещества
Слайд 5Дополнительно для МКТ газа
В любом, даже очень малом, объеме газа число
Размеры молекул малы по сравнению с расстояниями между ними. Диаметры молекул большинства газов заключены в пределах от 2⋅10-8 до 3⋅10-8 см, в то же время при н.у. расстояние между молекулами в газе составляет 3⋅10-7 см, т.е. в 10 раз превосходит молекулярный диаметр.
Взаимодействие молекул со своими соседями существенно только в момент соударения, в остальное же время силами взаимодействия между ними можно пренебречь.
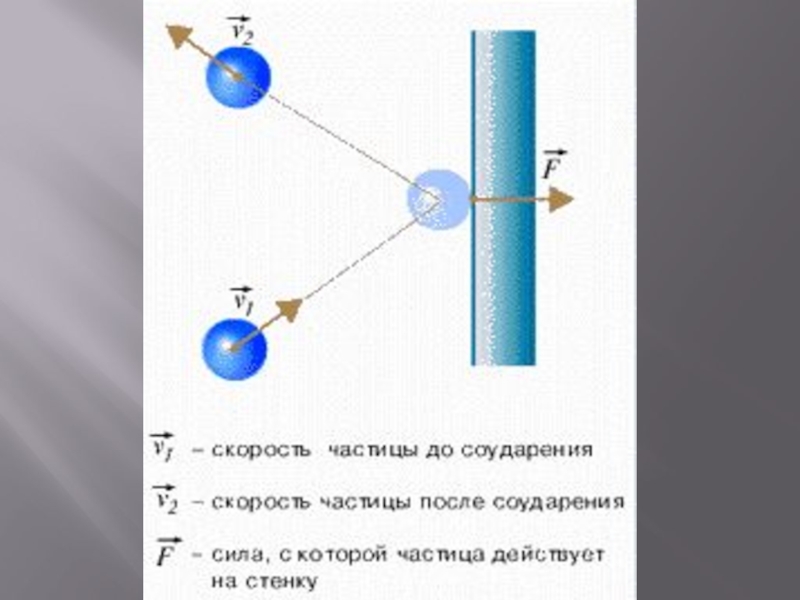
Соударения молекул со стенками сосуда, так же как и между собой, являются абсолютно упругими, т.е. при соударениях кинетическая энергия не превращается в другие виды энергии.
Слайд 6При отсутствии внешних сил молекулы газа распределяются равномерно по всему объему,
Направления скоростей молекул распределены хаотично, т.е. в газе отсутствуют какие-либо избирательные направления движения молекул, все направления движения равновероятны.
по абсолютной величине скорости движения молекул могут быть любыми.
Дополнительно для МКТ газа
Слайд 7Тепловое движение
Хаотическое движение молекул тела называется тепловым движением.
Тепловое движение
Взаимодействие между молекулами – потенциальной энергией взаимодействия Еп.
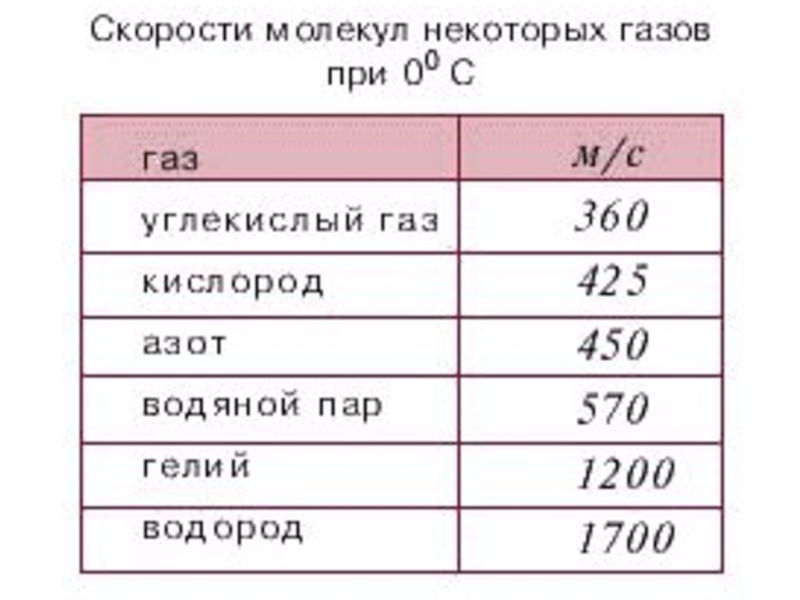
В случае достаточно разреженных газов энергией межмолекулярного взаимодействия можно пренебречь. Это означает, что физические свойства разреженных газов не должны зависеть от их химической природы (от масс молекул).
Слайд 8Идеальный газ – простейшая физическая модель реального газа. Газ считается идеальным, если
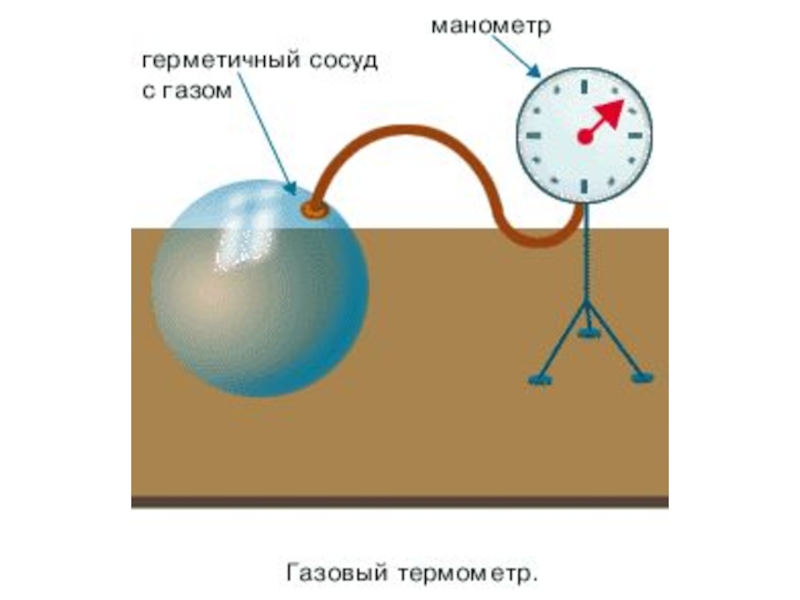
Слайд 10Давление газа – это результат соударений большого числа молекул о стенки
Слайд 12Основное уравнение молекулярно-кинетической теории
(уравнение Клаузиуса)
Это уравнение устанавливает связь между давлением p
Слайд 13
Давление идеального газа p пропорционально произведению массы молекулы m0, концентрации молекул
р = 1/3 ∙ n∙ m0∙ v2
Слайд 14
Через среднюю кинетическую энергию молекулы это уравнение записывают в виде
р =
Давление газа численно равно двум третям средней кинетической энергии поступательного движения всех молекул, заключенных в единице объема.
Слайд 15Возникают вопросы:
Каким образом можно на опыте изменять среднюю кинетическую энергию
Какую физическую величину нужно изменить, чтобы изменилась средняя кинетическая энергия?
Слайд 16Такой величиной в физике является температура.
Зависимость давления газа от температуры при
Слайд 17Английский физик У. Кельвин (Томсон) в 1848 г. предложил использовать точку нулевого давления
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K. Например, комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293,15 К.
Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Слайд 19Давление идеального газа определяется кинетической энергией его молекул.
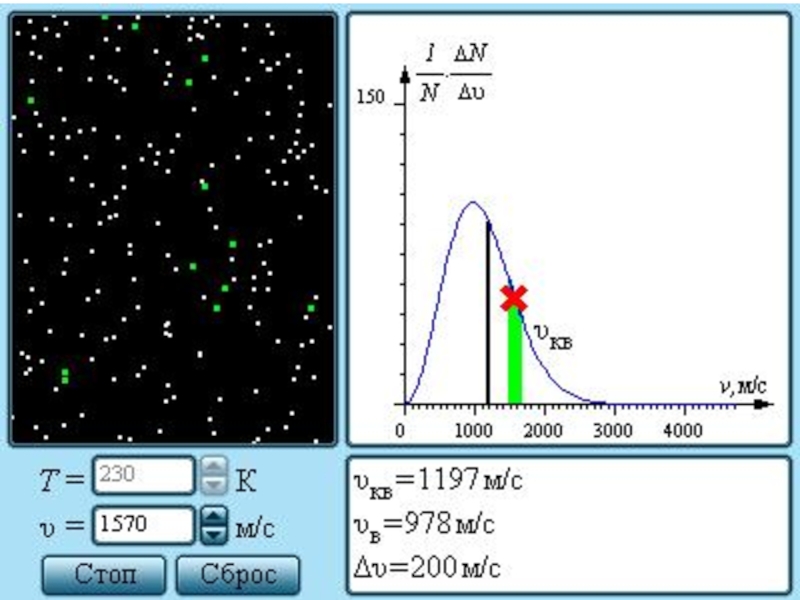
Распределение молекул по скоростям.
Слайд 20Характерными параметрами распределения Максвелла являются наиболее вероятная скорость υв, соответствующая максимуму
С ростом температуры максимум кривой распределения смещается в сторону больших скоростей, при этом υв и υкв увеличиваются.
Слайд 23Таким образом, давление разреженного газа в сосуде постоянного объема V изменяется
p ~ T
С другой стороны, опыт показывает, что при неизменных объеме V и температуре T давление газа изменяется прямо пропорционально отношению количества вещества ν в данном сосуде к объему V сосуда
где N – число молекул в сосуде, NA – постоянная Авогадро,
n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда).
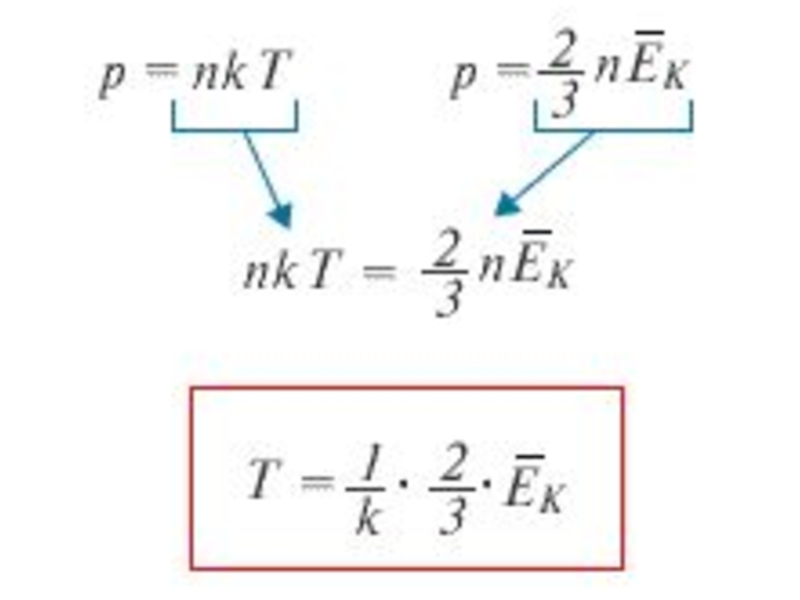
Слайд 24Объединяя эти соотношения пропорциональности, можно записать: p = nkT, где k – некоторая
Слайд 25Сравнивая соотношения p = nkT с основным уравнением молекулярно-кинетической теории газов, можно получить:
Слайд 27Таким образом, температура есть мера средней кинетической энергии поступательного движения молекул.
Слайд 29Давление смеси газов на стенки сосуда будет складываться из парциальных давлений
Слайд 30уравнение состояния идеального газа.
Соотношение
может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν.
Для этого нужно использовать равенства
Здесь N – число молекул в сосуде, NA – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа.
Слайд 31В итоге получим:
Произведение постоянной Авогадро NA на постоянную Больцмана k
Ее численное значение в СИ : R = 8,31 Дж/моль·К.
Соотношение
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид: pV=RT.
Слайд 32Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено
оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Менделеева–Клапейрона.
Слайд 33Клапейрон Бенуа Поль Эмиль
(26.I.1799–28.I.1864)
Французский физик, член Парижской АН (1858). Окончил Политехническую
Слайд 34Менделеев Дмитрий Иванович
(8.II.1834–2.II.1907)
Русский ученый-энциклопедист.. В 1874 вывел общее уравнение состояния
Слайд 35Если температура газа равна Tн = 273,15 К (0 °С), а давление pн = 1 атм = 1,013·105 Па, то говорят,
Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный V0 = 0,0224 м3/моль = 22,4 дм3/моль.
Это утверждение называется
законом Авогадро.
Слайд 38Т.е. для двух любых состояний газа:
Есть величина постоянная!!!
(Поправьте крыши – у
Слайд 39Задание не для слабонервных :
Попытайтесь рассчитать чему равно соотношение
для одного моля
(подсказка на следующей страничке - ЯнСтМ☺)
Слайд 40Нормальные условия:
(напоминаю в последний раз!)
температура газа Tн = 273,15 К (0 °С),
а давление
Что, не знаете какой объём подставить?!
Слайд 41Закон Авогадро:
один моль любого газа при нормальных условиях занимает один и
(или 22,4 литра на моль!)
Слайд 42Сравним результат:
Никто не ощутил приступа дежа-вю? Эта цифра сегодня уже мелькала!
Точно,
R = NA k =