№6
по курсу «Анализ и контроль
качества лекарственных средств»
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) презентация
Содержание
- 1. Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
- 2. Жидкостная хроматография метод разделения, в котором подвижная
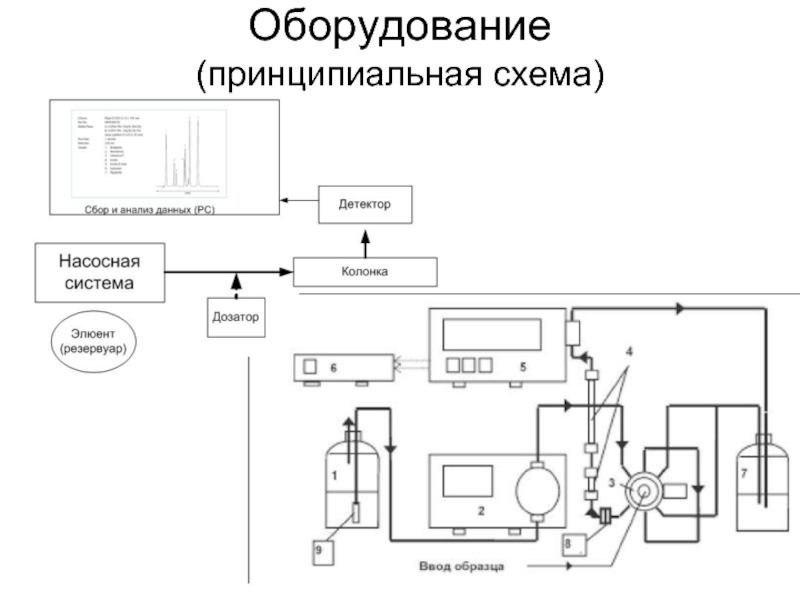
- 4. Оборудование (принципиальная схема)
- 5. Варианты проведения ЖХ 1. Изократический режим –
- 6. Хроматографические колонки Стальные трубки внутренним диаметром
- 7. Неподвижные фазы Общие требования: 1. Для обеспечения
- 8. Неподвижные фазы Классификация: 1. Полярные фазы (для
- 9. Выбор подвижной фазы для нормально-фазовой хроматографии
- 10. Неподвижные фазы 2. Среднеполярные фазы (для обращенно-фазовой
- 11. Неподвижные фазы 3. Неполярные фазы (для обращенно-фазовой
- 13. Принципы разделения 1. Полярные фазы –
- 14. Принципы разделения 2. Средне- и неполярные фазы:
- 15. Механизмы удерживания
- 16. Закономерности удерживания в обращенно-фазовой ВЭЖХ Вытеснительная модель
- 17. Влияние рН ПФ и температуры На неполярных
- 18. Детекторы в ЖХ 1. Детектор спектрофотометрический (область
- 19. 2. Детектор на основе диодной матрицы –
- 20. СФ-детектор Детектор на основе диодной матрицы
- 21. Флуориметрический детектор Селективный детектор, основанный на измерении
- 22. Рефрактометрический детектор Основан на измерении величины преломления света элюата (универсальный детектор)
- 23. Электрометрические детекторы 1. Амперометрический детектор (детекция органических
- 24. Масс-спектрометрическое детектирование Универсальный (полный ионный ток) и селективный (сканирование индивидуальных масс ионов) детектор
- 26. Масс-спектрометрическое детектирование 1. Ионизация образца (ПФ + разделенные вещества) Принципы: 1.1. электрораспылительная (ESI)
- 28. Примеры ионизации
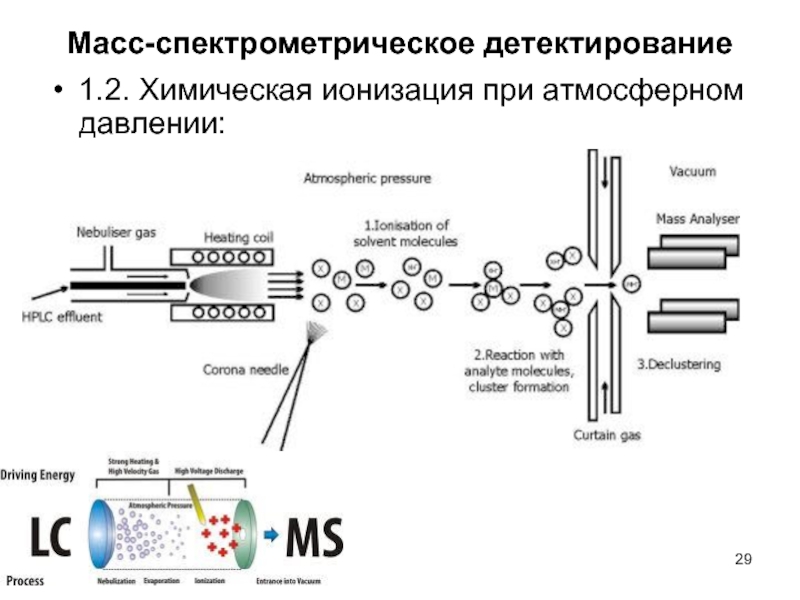
- 29. Масс-спектрометрическое детектирование 1.2. Химическая ионизация при атмосферном давлении:
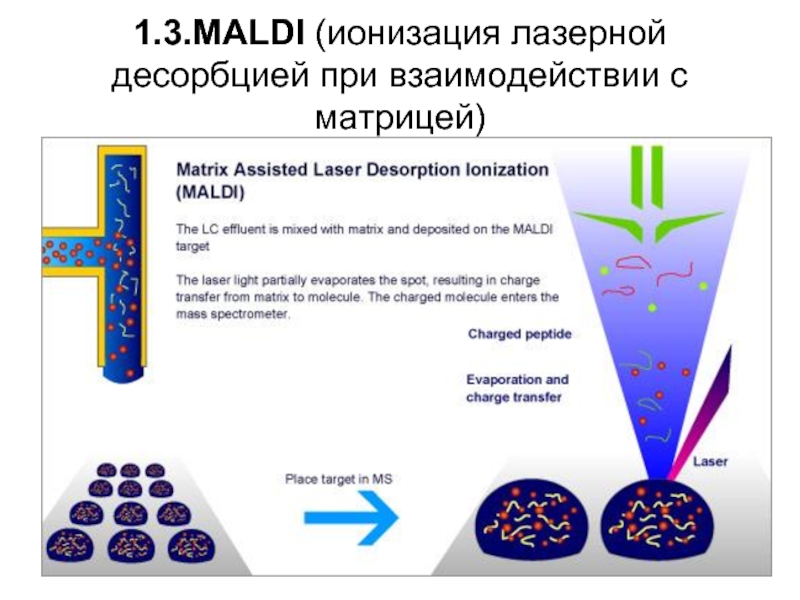
- 30. 1.3.MALDI (ионизация лазерной десорбцией при взаимодействии с матрицей)
- 31. MALDI-TOF (ионизация лазерной десорбцией при взаимодействии с матрицей и времяпролетным детектированием)
- 32. Масс-анализаторы А. непрерывные масс-анализаторы 1. Магнитный и
- 33. Масс-спектрометрическое детектирование Достоинства: 1. Высочайшая чувствительность органических
- 34. Сравнение различных типов детекторов
- 35. Применение ВЭЖХ в фармацевтическом анализе 1. Идентификация
- 36. Применение ВЭЖХ в фармацевтическом анализе 1.2. Идентификация по времена удерживания и спектрам поглощения пиков.
- 37. Применение ВЭЖХ в фармацевтическом анализе 1.3. Идентификация
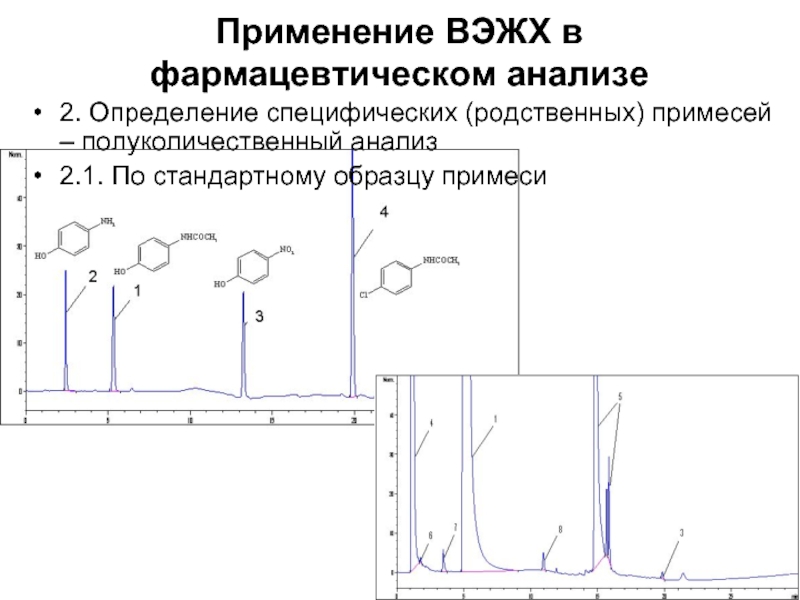
- 38. Применение ВЭЖХ в фармацевтическом анализе 2. Определение
- 39. 2. Определение специфических (родственных) примесей – полуколичественный
- 40. 2. Определение специфических (родственных) примесей – полуколичественный анализ 2.3. Методом внутренней нормализации
- 41. Определение специфических (родственных) примесей 2.4. Количественное определение (например, токсичные примеси) – методом градуировочного графика
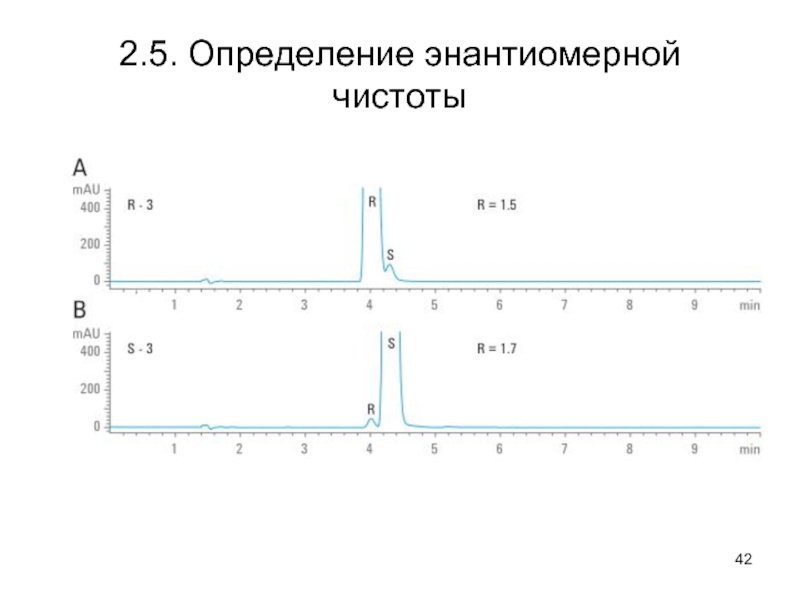
- 42. 2.5. Определение энантиомерной чистоты
- 43. Применение ВЭЖХ в фармацевтическом анализе 3. Определение
- 44. Капиллярный электрофорез Метод капиллярного электрофореза (КЭ) основан
- 45. Капиллярный электрофорез МЭКХ - вариант капиллярного электрофореза,
- 46. После подачи к концам капилляра высокого напряжения
- 47. Основные параметры КЭ 1. Время миграции (tм)
- 49. Механизм ЭОП
- 50. Электроосмотический поток Уникальной особенностью ЭОП является плоский
- 51. Капилляры для разделения Подавляющее большинство разделений в
- 52. Ввод образца Проба может быть введена в
- 53. Детектирование
- 54. Пример разделения неорганических ионов (КЭ) 1 –
- 56. Термические методы анализа Основаны на установлении зависимостей
- 69. БЛАГОДАРЮ ЗА ВНИМАНИЕ!
Слайд 1Хроматографические методы анализа и их применение для контроля качества лекарственных средств
(продолжение)
Лекция
Слайд 2Жидкостная хроматография
метод разделения, в котором подвижная фаза представляет собой жидкость, а
неподвижная – твердую или жидкую фазу (не смешивающуюся с подвижной фазой).
Различают:
А. колоночную (низкого и высокого давления – ВЭЖХ или ЖХВД) и планарную (ТСХ) хроматографии.
Б. по полярности неподвижной/подвижной фаз и по механизму удерживания/разделения:
- прямо-фазовую ЖХ (НФ – полярная, ПФ – неполярные жидкости)
- обращенно-фазовую ЖХ (НФ – неполярная или среднеполярная, ПФ – полярные жидкости).
- ионообменная или ионная.
- эксклюзионная (гель-хроматография).
Различают:
А. колоночную (низкого и высокого давления – ВЭЖХ или ЖХВД) и планарную (ТСХ) хроматографии.
Б. по полярности неподвижной/подвижной фаз и по механизму удерживания/разделения:
- прямо-фазовую ЖХ (НФ – полярная, ПФ – неполярные жидкости)
- обращенно-фазовую ЖХ (НФ – неполярная или среднеполярная, ПФ – полярные жидкости).
- ионообменная или ионная.
- эксклюзионная (гель-хроматография).
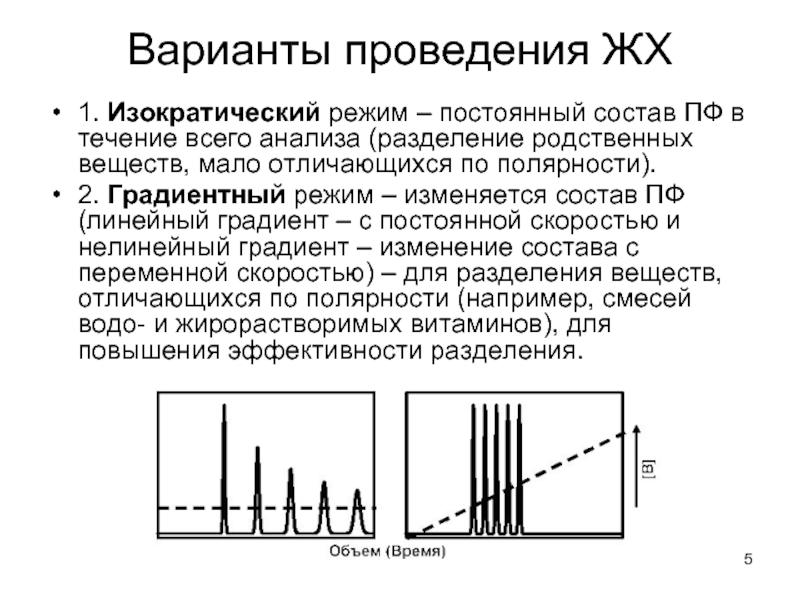
Слайд 5Варианты проведения ЖХ
1. Изократический режим – постоянный состав ПФ в течение
всего анализа (разделение родственных веществ, мало отличающихся по полярности).
2. Градиентный режим – изменяется состав ПФ (линейный градиент – с постоянной скоростью и нелинейный градиент – изменение состава с переменной скоростью) – для разделения веществ, отличающихся по полярности (например, смесей водо- и жирорастворимых витаминов), для повышения эффективности разделения.
2. Градиентный режим – изменяется состав ПФ (линейный градиент – с постоянной скоростью и нелинейный градиент – изменение состава с переменной скоростью) – для разделения веществ, отличающихся по полярности (например, смесей водо- и жирорастворимых витаминов), для повышения эффективности разделения.
Слайд 6Хроматографические колонки
Стальные трубки внутренним диаметром 2-5 мм, длиной 5-30 см,
с пористыми фильтрами с обоих концов. Для защиты аналитической колонки используются сменные предколонки (длиной 1-2 см).
Слайд 7Неподвижные фазы
Общие требования:
1. Для обеспечения высокой эффективности разделения – размер частиц
сорбента должен быть четко установленного размера (1,8 – 10 мкм), четко сферической формы.
2. Должен быть устойчивым к повышенному давлению (нехрупким), к химическим веществам (устойчивость при рН 2-8) и температуре (до 60-80оС).
3. Обладать высокой удельной поверхностью (60-300 м2/г) и определенным размером пор (10-300 нм).
4. Обратимая сорбция разделенных соединений.
2. Должен быть устойчивым к повышенному давлению (нехрупким), к химическим веществам (устойчивость при рН 2-8) и температуре (до 60-80оС).
3. Обладать высокой удельной поверхностью (60-300 м2/г) и определенным размером пор (10-300 нм).
4. Обратимая сорбция разделенных соединений.
Слайд 8Неподвижные фазы
Классификация:
1. Полярные фазы (для прямофазной ЖХ) – немодифицированные силикагели, аминопропилсилилсиликагели,
диольные производные силилсиликагеля, иониты (HILIC)
Слайд 10Неподвижные фазы
2. Среднеполярные фазы (для обращенно-фазовой ЖХ) – химически модифицированные силикагели
с привитыми цианопропильными (СN), пентафторбензильными (PFP), фенильными (Ph), фенил-гексильными группами.
Слайд 11Неподвижные фазы
3. Неполярные фазы (для обращенно-фазовой ЖХ) – химически модифицированные силикагели
с привитыми октильными (С8), октадецильными (С18), фенильными и октадецильными (С18-Ph), и др.
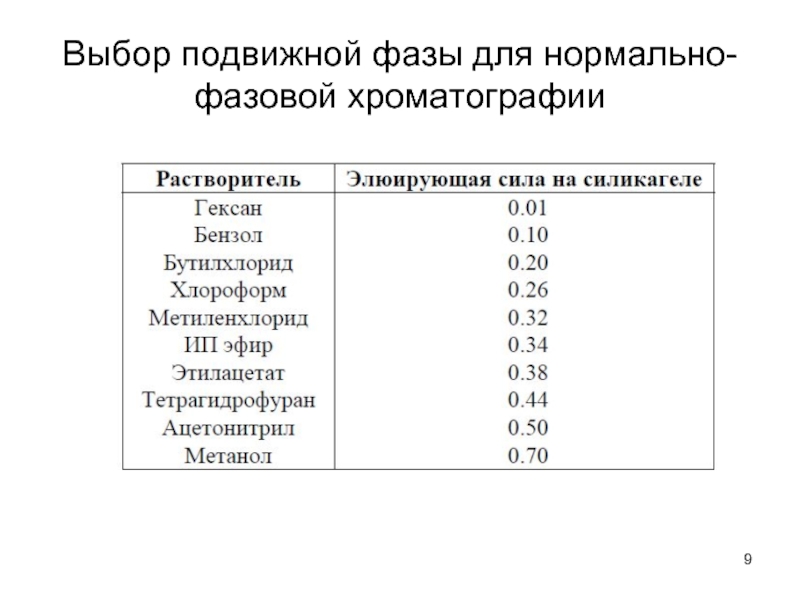
Слайд 13Принципы разделения
1. Полярные фазы –
1.1. для разделения неполярных и малополярных
веществ (слабо адсорбируются НФ) – малополярные элюенты (гексан (гептан) + низкая доля полярного растворителя, дихлорметан + низкая доля полярного растворителя).
1.2. для разделения полярных веществ (сильно адсорбируются НФ) – высокая доля полярных растворителей (метанол, ацетонитрил, вода), необходимо устанавливать рН (от 2 до 9), добавлять буферный раствор (ионная сила).
1.2. для разделения полярных веществ (сильно адсорбируются НФ) – высокая доля полярных растворителей (метанол, ацетонитрил, вода), необходимо устанавливать рН (от 2 до 9), добавлять буферный раствор (ионная сила).
Слайд 14Принципы разделения
2. Средне- и неполярные фазы:
2.1. Для разделения неполярных веществ используются
ПФ с высоким (40-100%) содержанием органического растворителя (ацетонитрил, метанол, тетрагидрофуран).
2.2. Для разделения ионизируемых органических веществ (кислот, оснований, амфолитов, ионов) необходимо использовать буферные растворы (рН 2-8 или для ряда колонок – 1-10).
2.3. Для разделения органических ионов и сильнополярных веществ – прибавляют ион-парные реагенты (алкилсульфонаты, четвертичные аммониевые соли).
2.2. Для разделения ионизируемых органических веществ (кислот, оснований, амфолитов, ионов) необходимо использовать буферные растворы (рН 2-8 или для ряда колонок – 1-10).
2.3. Для разделения органических ионов и сильнополярных веществ – прибавляют ион-парные реагенты (алкилсульфонаты, четвертичные аммониевые соли).
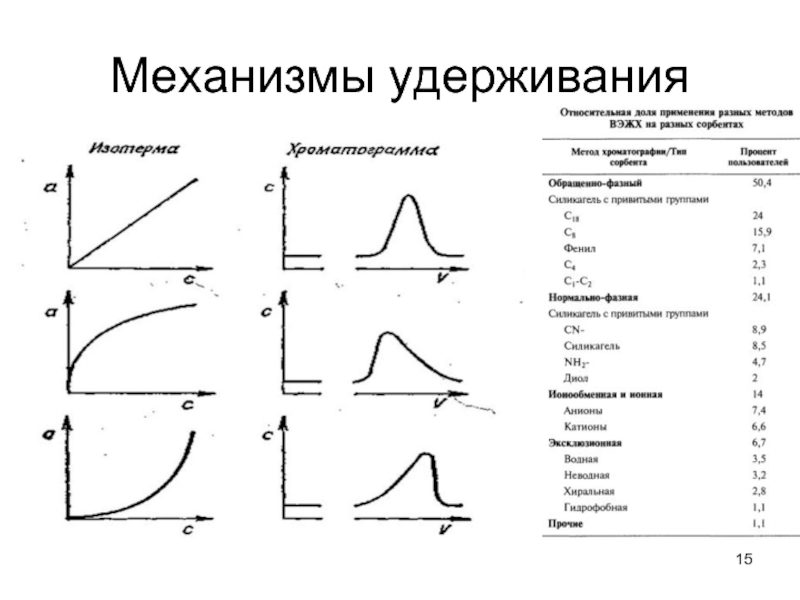
Слайд 16Закономерности удерживания в обращенно-фазовой ВЭЖХ
Вытеснительная модель удерживания:
1. Из ПФ на
поверхности неполярного/среднеполярного сорбента адсорбируется органический компонент (метанол, ацетонитрил).
2. При введении органического вещества оно вытесняет с поверхности сорбента часть молекул органического модификатора. Данный процесс обратимый и при движении новой порции ПФ органический модификатор вновь вытесняет сорбат.
2. При введении органического вещества оно вытесняет с поверхности сорбента часть молекул органического модификатора. Данный процесс обратимый и при движении новой порции ПФ органический модификатор вновь вытесняет сорбат.
Слайд 17Влияние рН ПФ и температуры
На неполярных фазах за счет дисперсионных взаимодействий
лучше удерживаются неионизированные молекулы. При ионизации молекул удерживание при прочих равных условиях уменьшается.
Температура незначительно влияет на удерживание органических молекул в водно-органических фазах. При повышении температуры уменьшается вязкость ПФ и давление на колонке (возможно работать на более высоких скоростях ПФ).
Температура незначительно влияет на удерживание органических молекул в водно-органических фазах. При повышении температуры уменьшается вязкость ПФ и давление на колонке (возможно работать на более высоких скоростях ПФ).
Слайд 18Детекторы в ЖХ
1. Детектор спектрофотометрический (область длин волн – УФ 190-360
нм (дейтериевая лампа), видимая – 360-900 нм – галогеновая лампа) – работает при фиксированных длинах волн (от 1 до 10 и более) – двумерная хроматография.
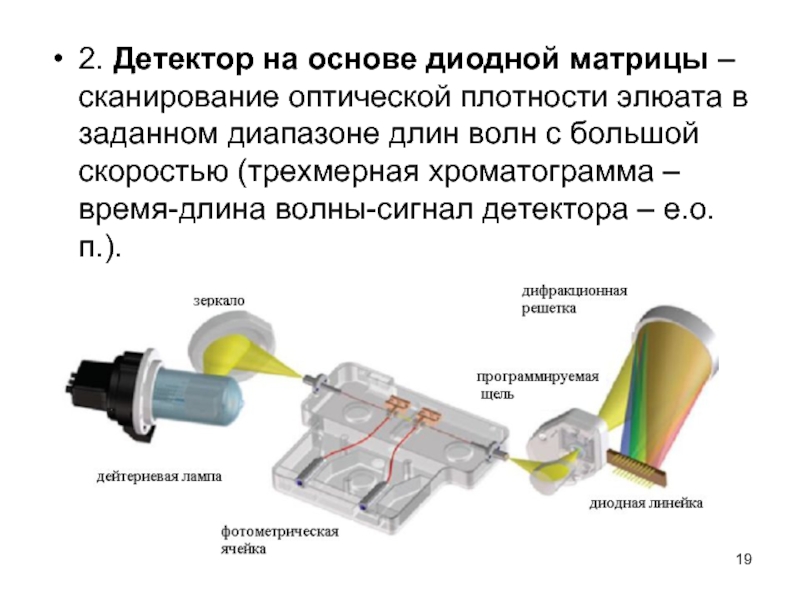
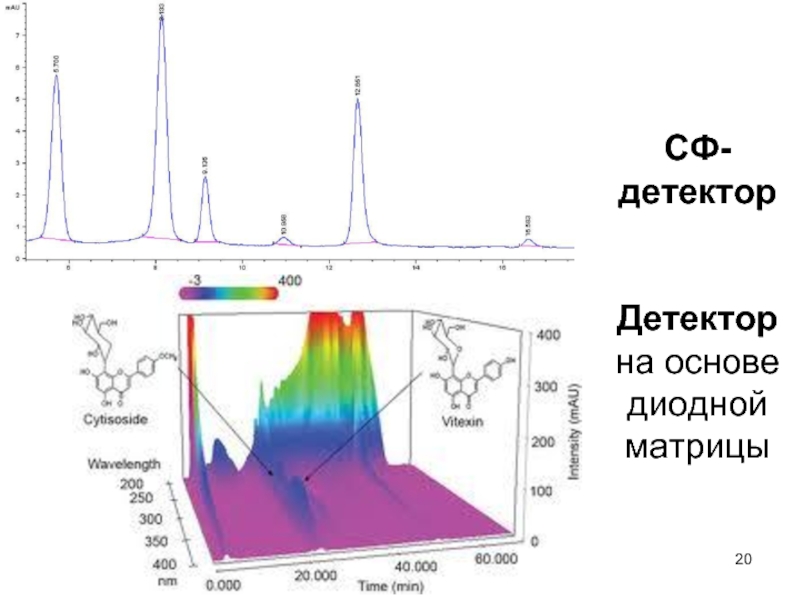
Слайд 192. Детектор на основе диодной матрицы – сканирование оптической плотности элюата
в заданном диапазоне длин волн с большой скоростью (трехмерная хроматограмма – время-длина волны-сигнал детектора – е.о.п.).
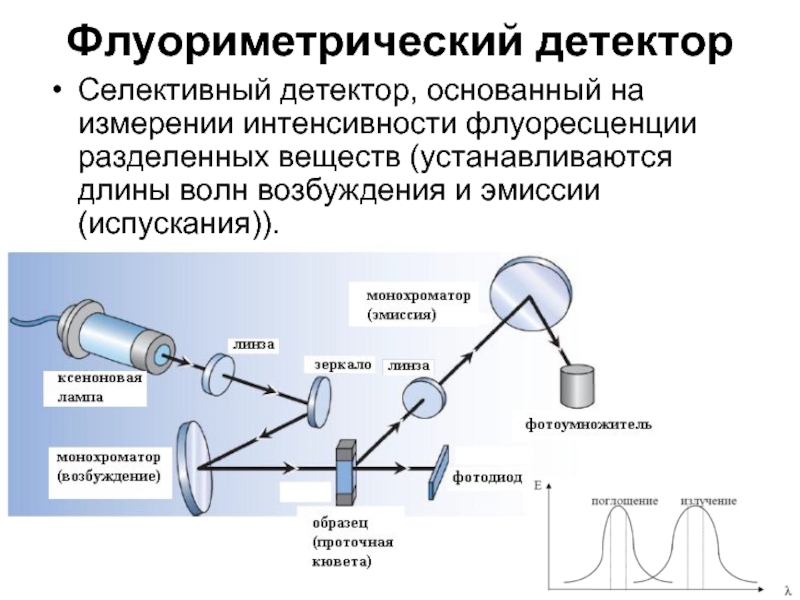
Слайд 21Флуориметрический детектор
Селективный детектор, основанный на измерении интенсивности флуоресценции разделенных веществ (устанавливаются
длины волн возбуждения и эмиссии (испускания)).
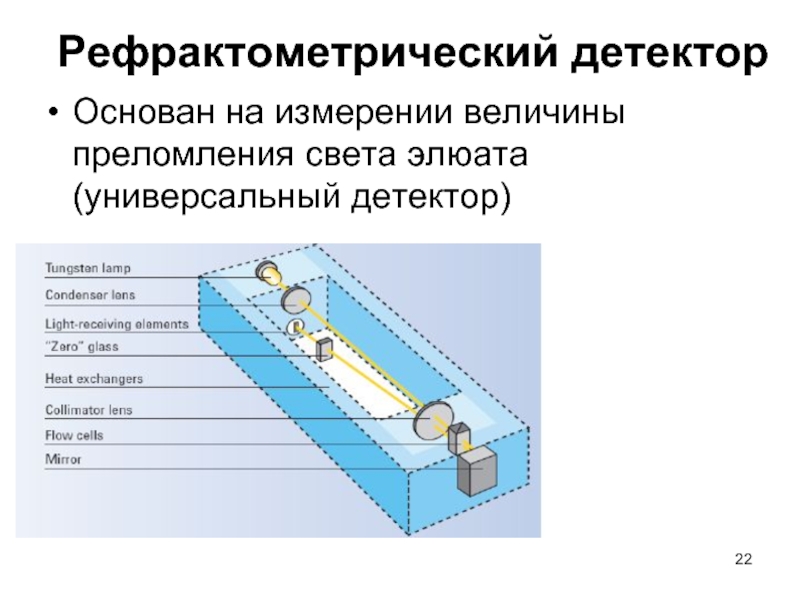
Слайд 22Рефрактометрический детектор
Основан на измерении величины преломления света элюата (универсальный детектор)
Слайд 23Электрометрические детекторы
1. Амперометрический детектор (детекция органических веществ, обладающих ОВ-свойствами) – может
быть комплексный с ферментативными реакциями.
2. Кондуктометический детектор (детекция ионов, основанная на измерении проводимости подвижной фазы).
3. Кулонометрический детектор.
2. Кондуктометический детектор (детекция ионов, основанная на измерении проводимости подвижной фазы).
3. Кулонометрический детектор.
Слайд 24Масс-спектрометрическое детектирование
Универсальный (полный ионный ток) и селективный (сканирование индивидуальных масс ионов)
детектор
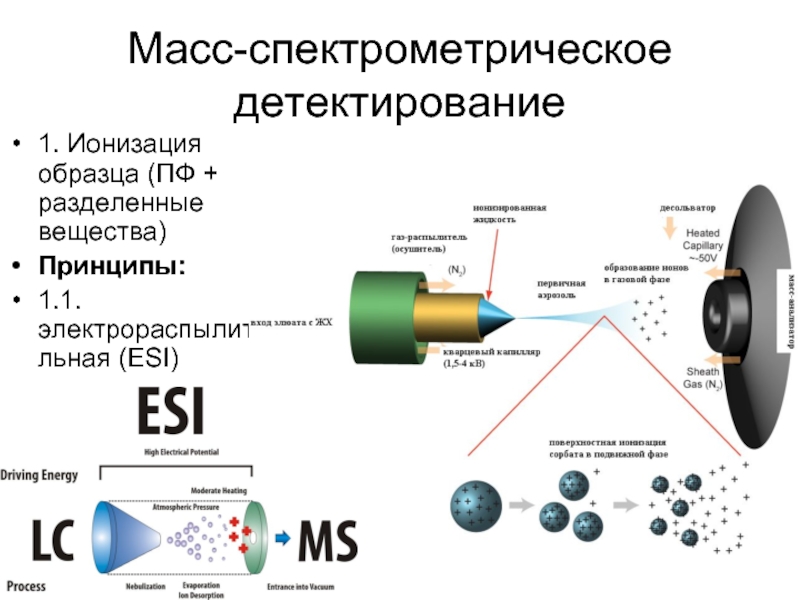
Слайд 26Масс-спектрометрическое детектирование
1. Ионизация образца (ПФ + разделенные вещества)
Принципы:
1.1. электрораспылительная (ESI)
Слайд 31MALDI-TOF (ионизация лазерной десорбцией при взаимодействии с матрицей и времяпролетным детектированием)
Слайд 32Масс-анализаторы
А. непрерывные масс-анализаторы
1. Магнитный и электростатический секторный масс-анализатор (Sector)
2. Квадрупольный масс-анализатор (Quadrupole mass
analyzer)
Б. импульсные масс-анализаторы
1. Времяпролётный масс-анализатор (Time-of-flight mass spectrometry)
2. Ионная ловушка (Ion trap)
3. Квадрупольная линейная ловушка (Quadrupole ion trap)
4. Масс-анализатор ионно-циклотронного резонанса с Фурье-преобразованием (Fourier transform ion cyclotron resonance)
5. Орбитрэп (Orbitrap)
Б. импульсные масс-анализаторы
1. Времяпролётный масс-анализатор (Time-of-flight mass spectrometry)
2. Ионная ловушка (Ion trap)
3. Квадрупольная линейная ловушка (Quadrupole ion trap)
4. Масс-анализатор ионно-циклотронного резонанса с Фурье-преобразованием (Fourier transform ion cyclotron resonance)
5. Орбитрэп (Orbitrap)
Слайд 33Масс-спектрометрическое детектирование
Достоинства:
1. Высочайшая чувствительность органических веществ, биополимеров (10-15 г/пробе).
2. Высокая специфичность
детекции (последовательная масс-спектрометрия (дочерних ионов)).
3. Метод сбора информации о структуре молекул (точность установления молярных масс – до 0,0001-0,000001 а.е.м.).
4. Широкий линейный диапазон – 106-107.
5. Наличие баз данных по масс-спектрам огромного числа органических веществ (для ГХ/МС).
6. Основной детектор при проведении биоэквивалентных испытаний, допинг-контроля, судебно-химической экспертизы, исследования метаболизма, генеза БАВ и др.
Недостатки:
1. Сложность и высокая стоимость оборудования и расходных материалов.
2. Необходимо дополнительное обучение непосредственно масс-спектрометрии и интерпретации спектров.
3. Метод сбора информации о структуре молекул (точность установления молярных масс – до 0,0001-0,000001 а.е.м.).
4. Широкий линейный диапазон – 106-107.
5. Наличие баз данных по масс-спектрам огромного числа органических веществ (для ГХ/МС).
6. Основной детектор при проведении биоэквивалентных испытаний, допинг-контроля, судебно-химической экспертизы, исследования метаболизма, генеза БАВ и др.
Недостатки:
1. Сложность и высокая стоимость оборудования и расходных материалов.
2. Необходимо дополнительное обучение непосредственно масс-спектрометрии и интерпретации спектров.
Слайд 35Применение ВЭЖХ в фармацевтическом анализе
1. Идентификация веществ
1.1. Сравнение времен удерживания со
стандартным веществом
Раствор сравнения
Испытуемый раствор
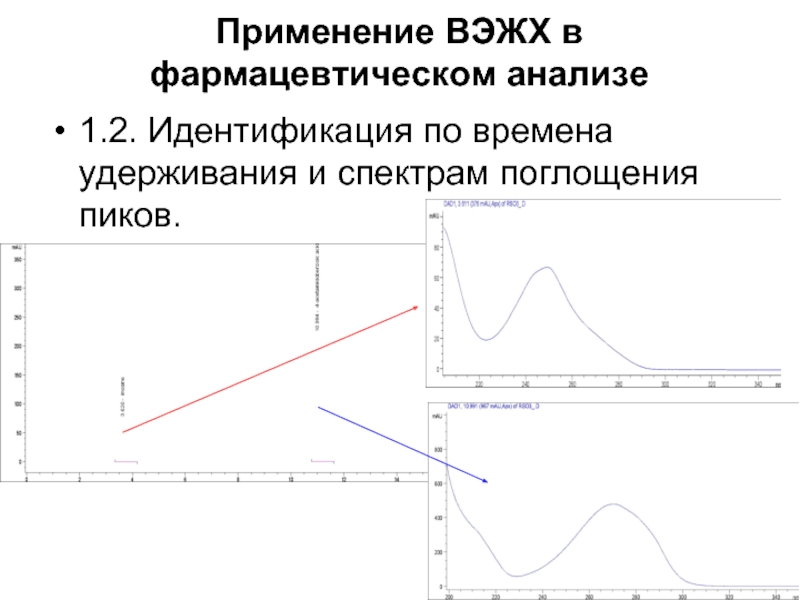
Слайд 36Применение ВЭЖХ в фармацевтическом анализе
1.2. Идентификация по времена удерживания и спектрам
поглощения пиков.
Слайд 37Применение ВЭЖХ в фармацевтическом анализе
1.3. Идентификация веществ (образцов) по хроматографическому профилю
(наличие определенного числа пиков с относительными временами удерживания по любому из компонентов) – растительные экстракты, ЛС сложного состава.
Слайд 38Применение ВЭЖХ в фармацевтическом анализе
2. Определение специфических (родственных) примесей – полуколичественный
анализ
2.1. По стандартному образцу примеси
2.1. По стандартному образцу примеси
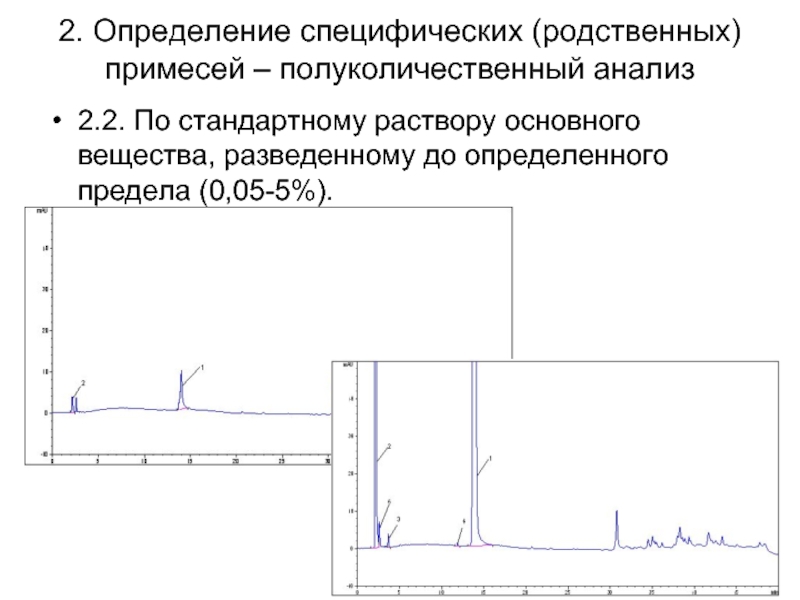
Слайд 392. Определение специфических (родственных) примесей – полуколичественный анализ
2.2. По стандартному раствору
основного вещества, разведенному до определенного предела (0,05-5%).
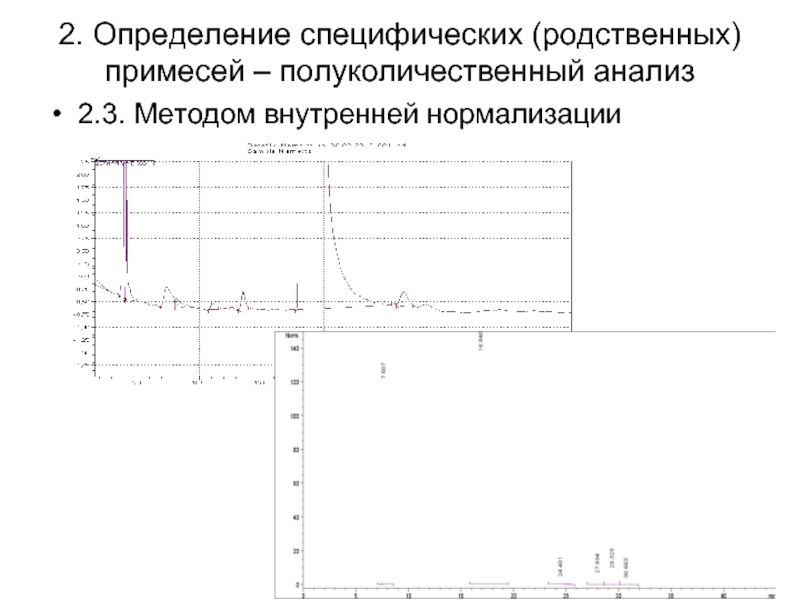
Слайд 402. Определение специфических (родственных) примесей – полуколичественный анализ
2.3. Методом внутренней нормализации
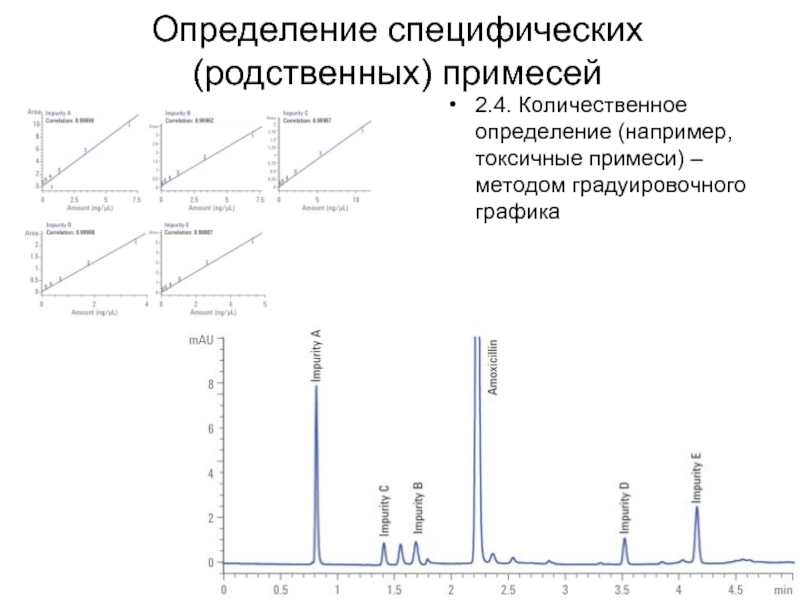
Слайд 41Определение специфических (родственных) примесей
2.4. Количественное определение (например, токсичные примеси) – методом
градуировочного графика
Слайд 43Применение ВЭЖХ в фармацевтическом анализе
3. Определение основных показателей готовых лекарственных средств
– однородность дозированных единиц, тест «Растворение», количественное определение стабилизаторов, консервантов, красителей и др.
4. Определение пластификаторов в упаковочных материалах.
5. Определение остаточных количеств пестицидов (гербицидов, инсектицидов) в ЛРС, продуктах из ЛРС.
6. Определение остаточных количеств активных фармацевтических ингредиентов на оборудовании (контроль отмывки оборудования), в сточных водах.
4. Определение пластификаторов в упаковочных материалах.
5. Определение остаточных количеств пестицидов (гербицидов, инсектицидов) в ЛРС, продуктах из ЛРС.
6. Определение остаточных количеств активных фармацевтических ингредиентов на оборудовании (контроль отмывки оборудования), в сточных водах.
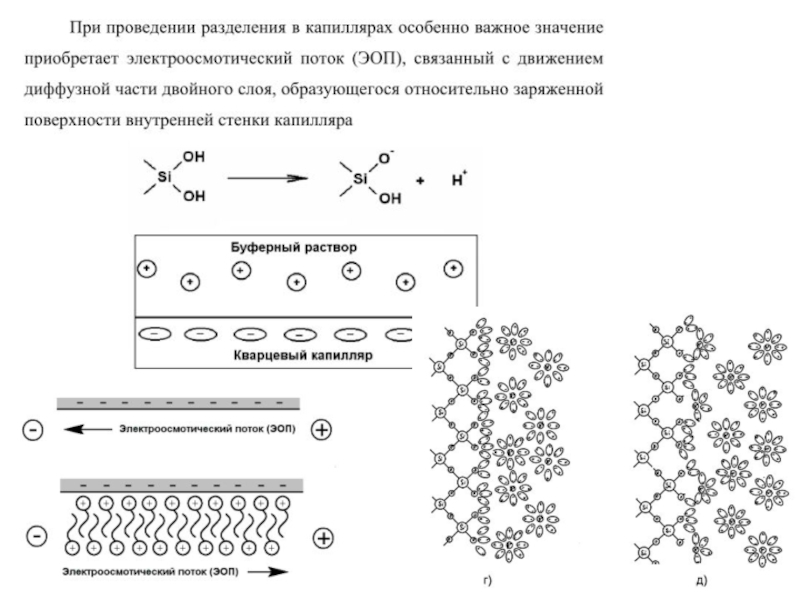
Слайд 44Капиллярный электрофорез
Метод капиллярного электрофореза (КЭ) основан на разделении заряженных компонентов сложной
смеси в кварцевом капилляре под действием приложенного электрического поля за счёт подачи высокого напряжения к концам капилляра.
Наиболее распространёнными вариантами метода КЭ являются: 1 капиллярный зонный электрофорез (КЗЭ)
2. мицеллярная электрокинетическая хроматография (МЭКХ).
КЗЭ - метод разделения, реализуемый в капиллярах и основанный на различии в электрокинетических подвижностях заряженных частиц как в водных, так и в неводных электролитах.
Наиболее распространёнными вариантами метода КЭ являются: 1 капиллярный зонный электрофорез (КЗЭ)
2. мицеллярная электрокинетическая хроматография (МЭКХ).
КЗЭ - метод разделения, реализуемый в капиллярах и основанный на различии в электрокинетических подвижностях заряженных частиц как в водных, так и в неводных электролитах.
Слайд 45Капиллярный электрофорез
МЭКХ - вариант капиллярного электрофореза, который позволяет проводить разделение соединений
ионного и нейтрального характера при использовании ПАВ. Разделение электро-нейтральных соединений осуществляется благодаря введению в состав ведущего электролита поверхностно-активных веществ - мицеллообразователей. Чаще всего используют анионный ПАВ (например, ДДС) в концентрациях, превышающих критическую концентрацию мицелообразования, что приводит к формированию так называемой «псевдостационарной фазы», и аналиты распределяются между мицеллой и буферным электролитом согласно их гидрофобности.
Слайд 46После подачи к концам капилляра высокого напряжения (до 30 кВ), компоненты
смеси начинают двигаться по капилляру с разной скоростью, зависящей в первую очередь от заряда и величины ионного радиуса и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой, при этом качественной характеристикой вещества является параметр удерживания (время миграции), а количественной – высота или площадь пика, пропорциональная концентрации вещества.
Слайд 47Основные параметры КЭ
1. Время миграции (tм) - время, необходимое компоненту для
прохождения им эффективной длины капилляра (Lэфф) от зоны ввода пробы (начала капилляра) до зоны детектирования;
2. Электроосмотический поток (ЭОП) - течение жидкости в капилляре под действием приложенного электрического поля. Время, необходимое жидкости для преодоления эффективной длины капилляра вследствие возникающего ЭОП, называют временем ЭОП (tэоп) и экспериментально определяют из электрофореграммы по времени миграции нейтрального компонента – маркера ЭОП.
3. Подвижность ЭОП (μэоп) - представляет собой отношение скорости ЭОП к напряженности электрического поля. Скорость ЭОП положительна при направлении движения жидкости от входного участка капилляра к детектору и отрицательна при обратном направлении. В свою очередь, скорость ЭОП вычисляют по формуле:
νэоп= Lэфф / tэоп.
2. Электроосмотический поток (ЭОП) - течение жидкости в капилляре под действием приложенного электрического поля. Время, необходимое жидкости для преодоления эффективной длины капилляра вследствие возникающего ЭОП, называют временем ЭОП (tэоп) и экспериментально определяют из электрофореграммы по времени миграции нейтрального компонента – маркера ЭОП.
3. Подвижность ЭОП (μэоп) - представляет собой отношение скорости ЭОП к напряженности электрического поля. Скорость ЭОП положительна при направлении движения жидкости от входного участка капилляра к детектору и отрицательна при обратном направлении. В свою очередь, скорость ЭОП вычисляют по формуле:
νэоп= Lэфф / tэоп.
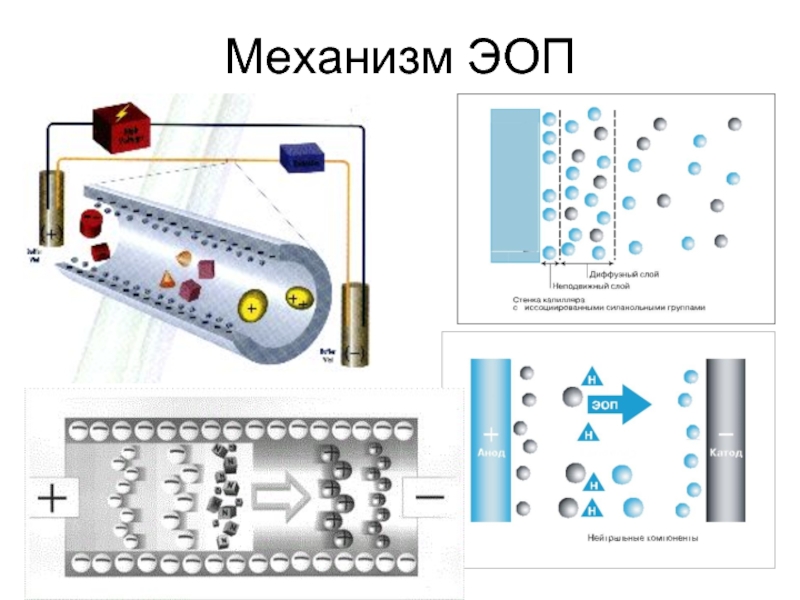
Слайд 50Электроосмотический поток
Уникальной особенностью ЭОП является плоский профиль потока в капилляре. Такой
профиль выгоден, поскольку уменьшается размывание зон разделяемых веществ. Следует отметить, что эффективность разделения в капиллярном электрофорезе прямо пропорциональна, а время анализа – обратно пропорционально напряжению, приложенному к электродам. Разделение в КЭ может быть выполнено как с положительной, так и отрицательной полярностью электродов. Зная значения рКа для компонентов пробы, можно выбрать буфер с подходящим значением рН и полярность электродов, чтобы образец двигался в сторону детектора. Скорость миграции зависит от напряженности электрического поля, которая обычно составляет 200-400 В/см.
Слайд 51Капилляры для разделения
Подавляющее большинство разделений в КЭ проводят с использованием кварцевых
капилляров имеющих внешнее полимерное покрытие, обычно - полиимидное, улучшающее их механическую прочность, и значительно реже полимерные капилляры, например из тефлона. Внутренний диаметр капилляров колеблется в пределах от 25 до 200 микрон, а длина капилляра в зависимости от поставленной задачи – от нескольких сантиметров до 1 метра. Поскольку внешнее полиимидное покрытие непрозрачно в УФ-области, то участок покрытия удаляют и создают окно для УФ-детектирования. Капилляр закрепляется в специальной пластиковой кассете.
Надежное термостатирование капилляра является основным условием получения воспроизводимых времен миграции определяемого соединения и площади результирующего пика, что важно для количественного анализа. Используют капилляры с внутренним диаметром 25-50 мкм, что является компромиссным решением между достаточно высокой чувствительностью и эффективностью разделения.
Надежное термостатирование капилляра является основным условием получения воспроизводимых времен миграции определяемого соединения и площади результирующего пика, что важно для количественного анализа. Используют капилляры с внутренним диаметром 25-50 мкм, что является компромиссным решением между достаточно высокой чувствительностью и эффективностью разделения.
Слайд 52Ввод образца
Проба может быть введена в капилляр электрофоретическим, электрокинетическим или вытеснительным
способом. Объем вводимой пробы не превышает 2 нл, относительное стандартное отклонение составляет 0,03-0,04. При электрофоретическом вводе пробы, к концам капилляра прикладывается высокое напряжение на фиксированный промежуток времени, при этом входной конец капилляра погружают в раствор пробы. Ионы пробы перемещаются в капилляр пропорционально их электрофоретической подвижности. В случае электрокинетического ввода, компоненты пробы попадают в капилляр за счет комбинации электроэндоосмотического давления и электрофоретической подвижности. Вытеснительный ввод пробы достигается либо за счет создания избыточного внешнего давления инертного газа, приложенного к резервуару с образцом, либо за счет создания вакуума на выходе из капилляра или путем изменения уровня/высоты резервуара, содержащего образец, относительно резервуара с буферным раствором на выходе из капилляра (так называемое гравитационное введение пробы).
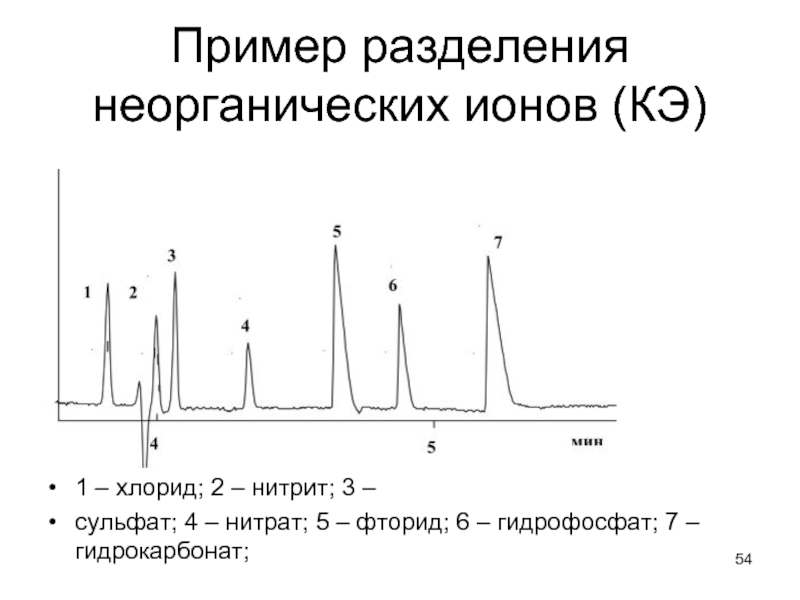
Слайд 54Пример разделения неорганических ионов (КЭ)
1 – хлорид; 2 – нитрит; 3
–
сульфат; 4 – нитрат; 5 – фторид; 6 – гидрофосфат; 7 – гидрокарбонат;
сульфат; 4 – нитрат; 5 – фторид; 6 – гидрофосфат; 7 – гидрокарбонат;
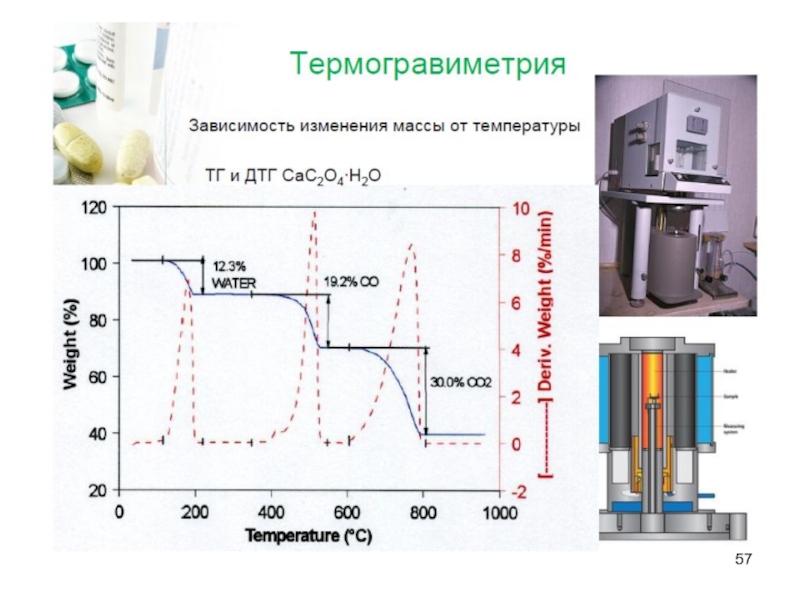
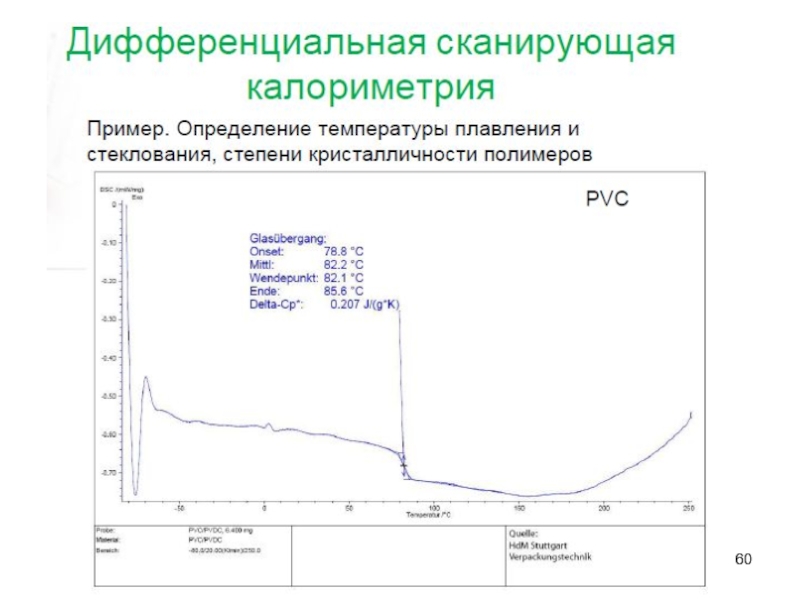
Слайд 56Термические методы анализа
Основаны на установлении зависимостей различных физических или физико-химических свойств
веществ от температуры (градиента температуры).
А – Термогравиметрия
Б – Дифференциальный термический анализ
В – Дифференциальная сканирующая калориметрия
А – Термогравиметрия
Б – Дифференциальный термический анализ
В – Дифференциальная сканирующая калориметрия