- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химия поверхностных явлений презентация
Содержание
- 1. Физико-химия поверхностных явлений
- 2. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ - явления, связанные с существованием
- 3. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Толщина поверхностного слоя определяется радиусом действия поверхностных сил .
- 4. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Поверхностные слои неоднородны в масштабе
- 5. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ В поверхностных слоях наблюдаются специфические химические эффекты, вплоть до изменения валентности.
- 6. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ Особыми свойствами обладают и родственные
- 7. Поверхностные явления Внутри жидкости силы
- 8. Поверхностные явления Увеличение площади поверхности раздела
- 9. Поверхностное натяжение σ — это работа, необходимая
- 10. Поверхностное натяжение Поверхностное натяжение зависит от:
- 11. Методы определения поверхностного натяжения Методы определения поверхностного
- 12. Капиллярный метод Метод измерения капиллярного поднятия основан
- 13. Методы определения поверхностного натяжения Динамические методы связаны
- 14. Метод бегущих волн При возмущении жидкости
- 15. Когезия Взаимодействие (сцепление) молекул, атомов, ионов внутри одной фазы называют КОГЕЗИЕЙ.
- 16. Когезия. Работа когезии Работа когезии определяется затратой
- 17. Когезия Когезия отражает межмолекулярное взаимодействие внутри гомогенной
- 18. Когезия В уравнение Ван-дер-Ваальса для реальных газов
- 19. Когезия Так как мольный объем жидкостей при
- 20. Адгезия Межфазное взаимодействие, или взаимодействие между приведенными
- 21. Работа адгезии Адгезия является самопроизвольным процессом. Работа
- 22. Работа адгезии Чтобы получить соотношение между работой
- 23. Работа адгезии Для начального и конечною
- 24. Смачивание Мерой С. обычно служит
- 25. СОРБЦИЯ
- 26. Медико-биологическое значение темы: 1. Усвоение
- 27. Примеры сорбция жидкостей на твердой поверхности; сорбция
- 28. Сорбция-изменение концентрации одного или нескольких компонентов в
- 29. Процессы, протекающие в объеме твердого сорбента Данные
- 30. Адсорбция Адсорбция – самопроизвольное изменение концентрации компонента
- 31. Основные понятия Вещество, на поверхности которого происходит
- 32. Физическая адсорбция Физическая адсорбция обусловлена молекулярными или ван-дер-ваальсовыми силами.
- 33. Химическая адсорбция Химическая адсорбция или хемосорбция обусловлена
- 34. Количественно адсорбция может выражаться через различные величины:
- 35. Абсолютная адсорбция Значение А не совпадает с
- 36. Уравнение Гиббса
- 37. Уравнение Гиббса для разбавленных растворов и идеальных
- 38. Уравнение изотермы адсорбции Полученное Гиббсом уравнение изотермы
- 39. Поверхностная активность Способность растворенного вещества изменять поверхностное
- 40. Правило Траубе-Дюкло: При удлинении цепи на группу
- 41. ПАВ, ПИВ, ПНВ Поверхностно-активные вещества (ПАВ): уменьшают
- 42. Изотерма поверхностного
- 43. Поверхностно-активные вещества (ПАВ): уменьшают σ растворителя таким
- 44. Строение молекулы ПАВ: Молекула ПАВ состоит из:
- 45. АДСОРБЦИЯ НА ГРАНИЦЕ РАСТВОР-ГАЗ
- 46. Расчет изотермы адсорбции Г= ƒ(с) Для расчета
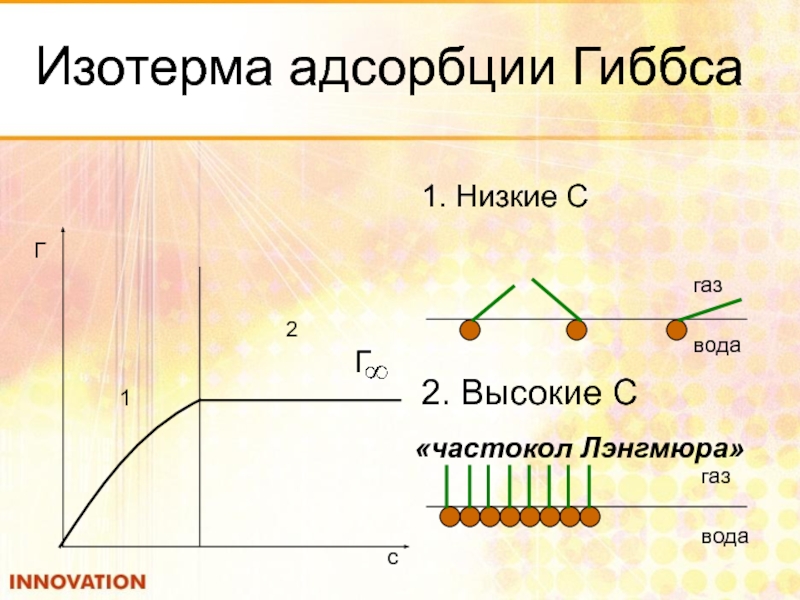
- 47. Изотерма адсорбции Гиббса 1. Низкие С
- 48. Уравнение Шишковского Для построения изотермы поверхностного натяжения
- 49. Переход от уравнения Гиббса к уравнению Ленгмюра
- 50. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО-ГАЗ
- 51. Адсорбция твердыми телами Величина адсорбции зависит от:
- 52. Теории адсорбции Основной задачей теории адсорбции является
- 53. Уравнение Фрейндлиха А = x/m = k
- 54. Уравнение Фрейндлиха для адсорбции из раствора на
- 55. Константы адсорбции Показатель с участием константы 1/n
- 56. Определение констант в уравнении Фрейндлиха lg A
- 57. Теория Ленгмюра Зависимость адсорбции газа на твёрдой
- 58. Теория Ленгмюра Согласно данной теории локализационную адсорбцию
- 59. Теория Ленгмюра Предположим, что на поверхности 1м2
- 60. Теория Ленгмюра Скорость процесса десорбции определится по
- 61. Уравнение Ленгмюра А = А
- 62. Для нахождения констант А ∞ и
- 63. Изотерма адсорбции Ленгмюра с Г
- 64. Определение площади молекулы и толщины слоя При
- 65. Применение теории Ленгмюра Несмотря на то, что
- 66. Теория полимолекулярной адсорбции БЭТ (Брунауер, Эммет, Теллер)
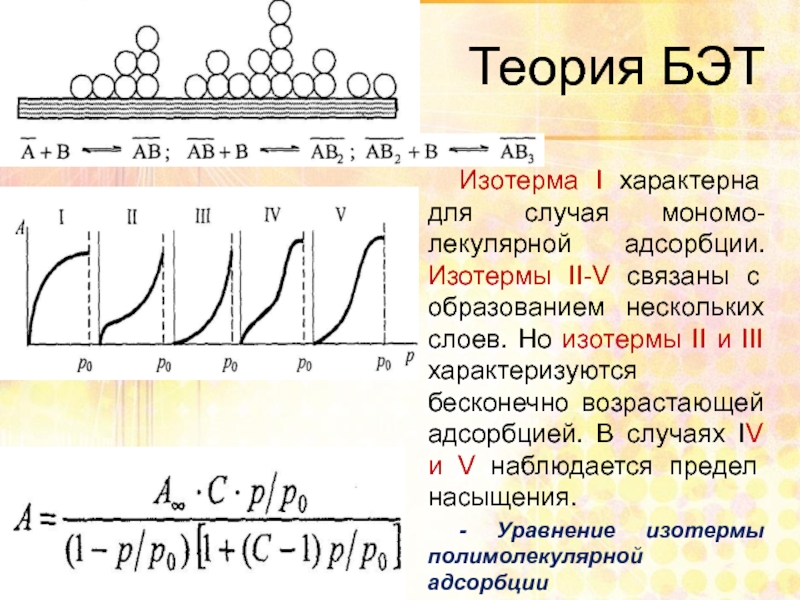
- 67. Теория БЭТ Изотерма І характерна для
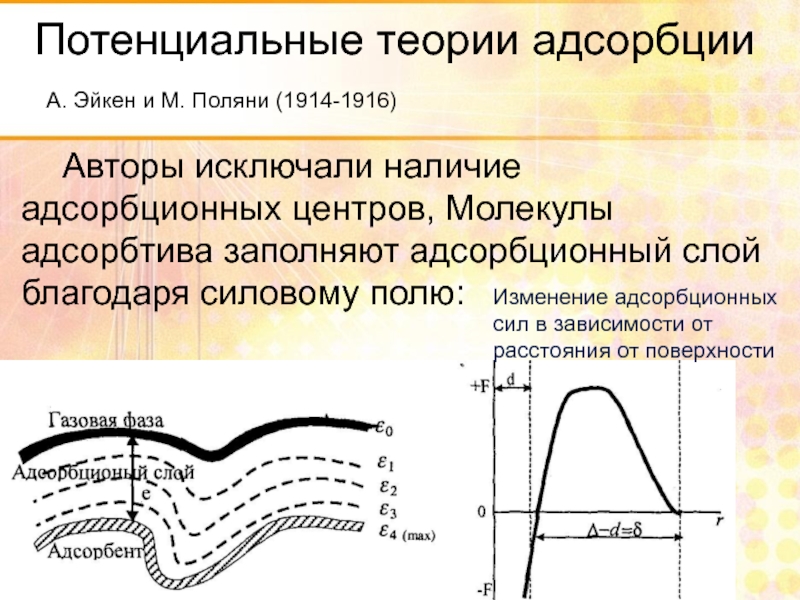
- 68. Потенциальные теории адсорбции А. Эйкен и
- 69. Потенциальные теории адсорбции Данное адсорбционное поле характеризует
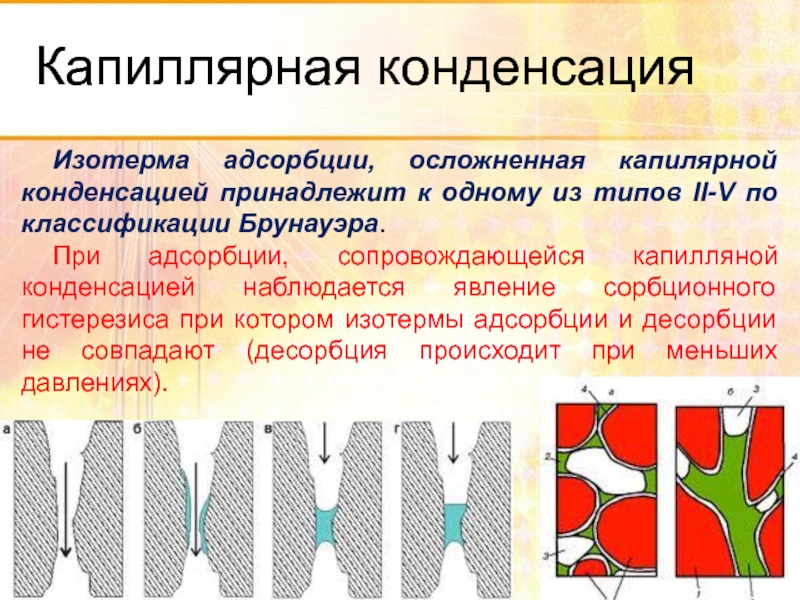
- 70. Капиллярная конденсация Адсорбция паров пористыми телами может
- 71. Капиллярная конденсация Изотерма адсорбции, осложненная капилярной конденсацией
- 72. Капиллярная конденсация Изотермы капиллярной конденсации А=ƒ(p/p0) используют
- 73. АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – РАСТВОР
- 74. Молекулярная адсорбция При молекулярной адсорбции из растворов
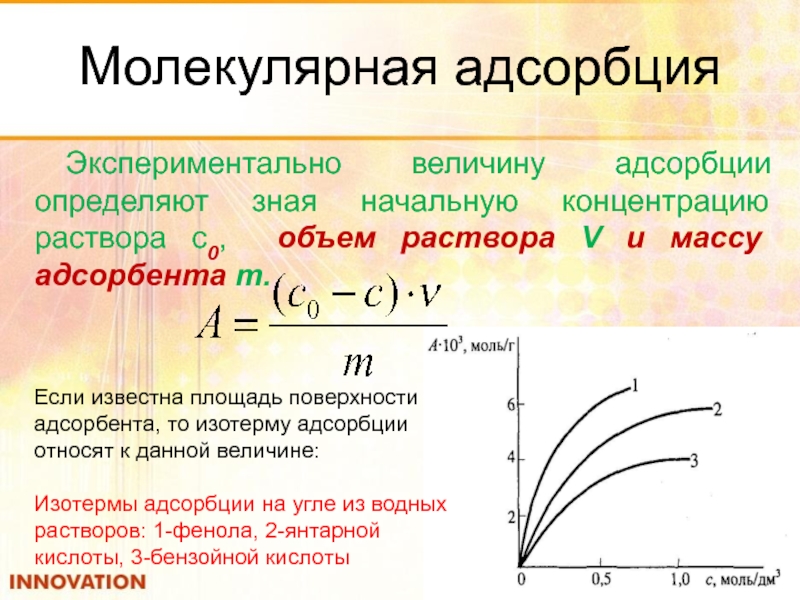
- 75. Молекулярная адсорбция Экспериментально величину адсорбции определяют зная
- 76. Правило уравнивания полярностей (Ребиндера) Вещество С будет
- 77. Молекулярная адсорбция Так, при адсорбции алифатических карбоновых
- 78. Вывод Из приведенного выше подтверждается тот факт,
- 79. Адсорбция электролитов Адсорбция из водных растворов
- 80. Уравнение Никольского Процессы ионного обмена на твердой поверхности характеризуются уравнением Б.П.Никольского:
- 81. Обменная адсорбция представляет собой процесс обмена ионов
- 82. Избирательная адсорбция Избирательная адсорбция не сопровождается выделением
- 83. Правило Панета-Фаянса Из раствора адсорбируются те ионы,
- 84. Ионообменная адсорбция Ионообменная адсорбция – процесс, в
- 85. Хроматография Хроматография - динамический метод анализа, основанный на многократно повторяющихся процессах сорбции и десорбции.
- 86. Хроматография – физико-химический метод, используется
- 87. Из истории хроматографии Михаил Семёнович Цвет
- 88. капиллярная газовая хроматография (КГХ), высокоэффективная жидкостная хроматография
- 89. «Никакое другое открытие не оказало на исследования
- 90. Принцип хроматографического разделения веществ
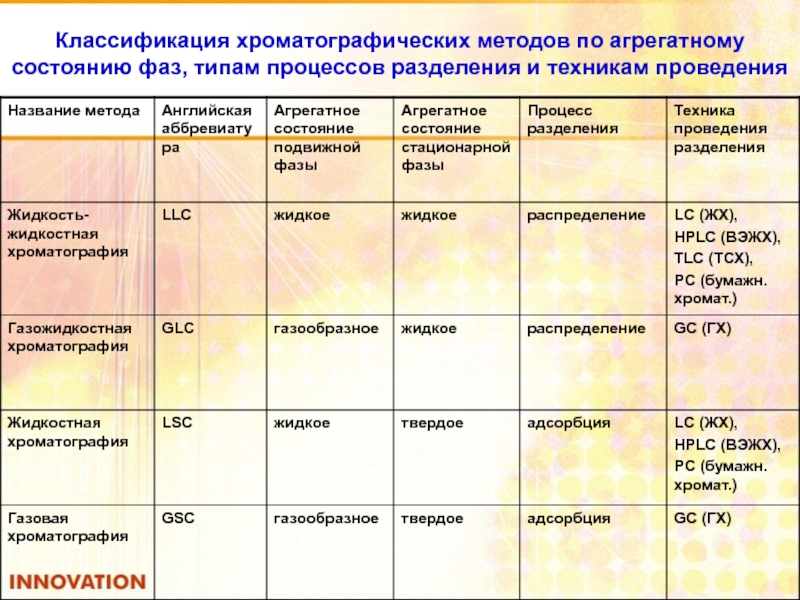
- 91. Классификация методов хроматографии По типу агрегатного
- 92. Классификация хроматографических методов по агрегатному состоянию фаз, типам процессов разделения и техникам проведения
- 93. Колоночная хроматография стационарная фаза находится в колонке;
- 94. Хроматограмма Хроматографический пик – концентрация пробы в
- 95. Правильная запись данных ГЖХ Номер (шифр) эксперимента
- 96. Газо-жидкостная хроматография (ГЖХ) Газо-жидкостная хроматография используется для
- 97. Аппаратурное оформление метода ГЖХ 1 – баллон
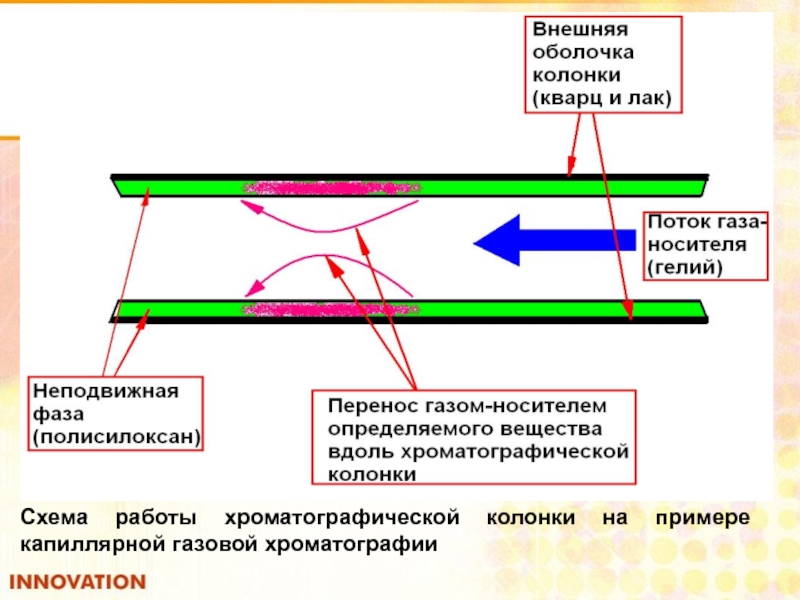
- 98. Схема работы хроматографической колонки на примере капиллярной газовой хроматографии
- 99. Идентификация методом ГЖХ Для идентифицикации соединения в
- 100. Количественный анализ с использованием метода ГЖХ Wx
- 101. Характеристики вещества, получаемые в хроматографическом методе Время
- 102. ВЭЖХ Agilent Technologies
- 103. ВЭЖХ Милихром
- 104. ВЭЖХ HP
- 105. ВЭЖХ Люмекс
- 106. ВЭЖХ Чешский прибор
- 107. ГЖХ “Agilent Technologies”
- 108. ХМС НР
- 109. Энтеросорбция Метод лечения различных заболеваний, основанный на
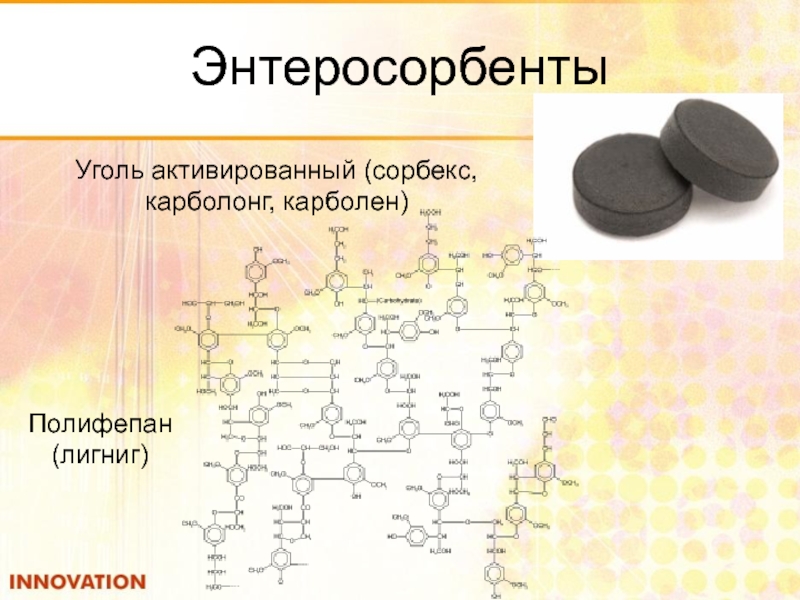
- 110. Энтеросорбенты ЭСБ – препараты медицинского назначения,
- 111. Энтеросорбенты Полифепан (лигниг) Уголь активированный (сорбекс, карболонг, карболен)
- 112. Энтеросорбенты Смекта Кремнийорганический сорбент Энтеросгель
- 113. Энтеросорбция Энтеросорбция является составной частью эфферентной терапии (от
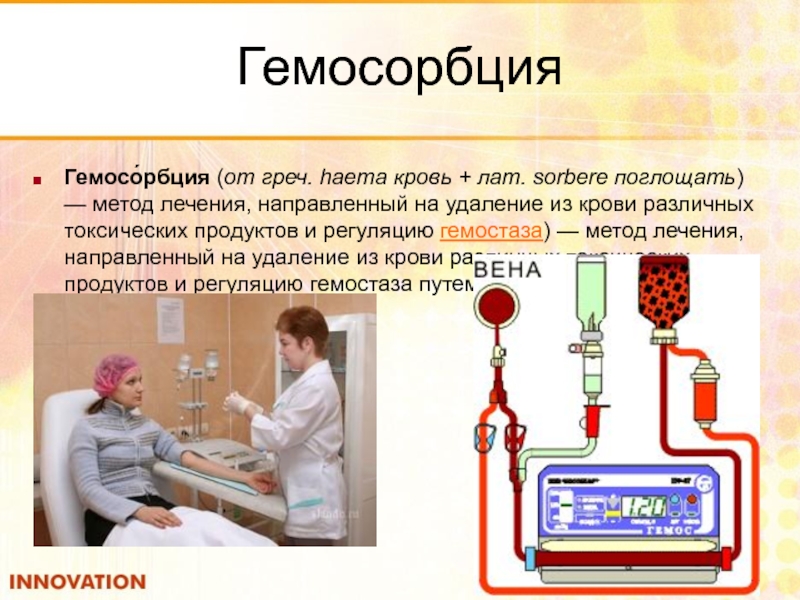
- 114. Гемодиализ Гемодиализ (от гемо- (от гемо- и др.-греч. (от гемо- и др.-греч. διάλυσις — разложение, отделение) — метод внепочечного очищения крови (от гемо- и др.-греч. διάλυσις —
- 115. Перитонеальный диализ Перитонеальный диализ(анат. peritoneum брюшина:
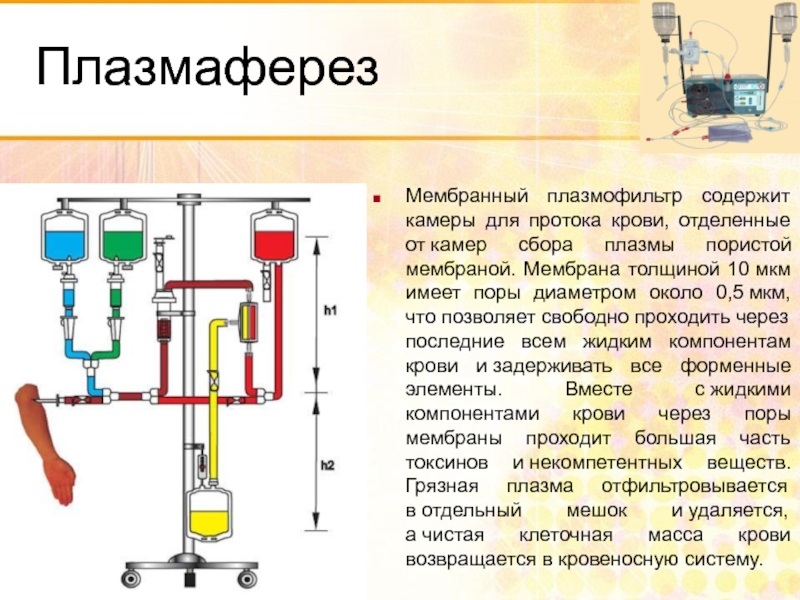
- 116. Плазмаферез Мембранный плазмофильтр содержит камеры для протока
- 117. Гемосорбция Гемосо́рбция (от греч. haema кровь + лат.
Слайд 2ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- явления, связанные с существованием межфазных границ. В области контакта
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ ИЗУЧАЮТСЯ КОЛЛОИДНОЙ ХИМИЕЙ
Слайд 3ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
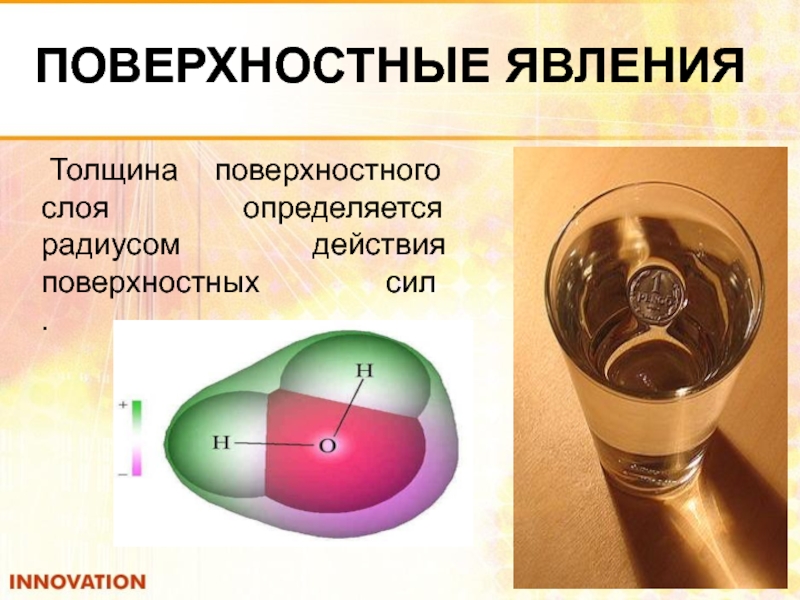
Толщина поверхностного слоя определяется радиусом действия поверхностных сил
.
Слайд 4ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Поверхностные слои неоднородны в масштабе молекулярных размеров, отличаются от объёмных
Слайд 5ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
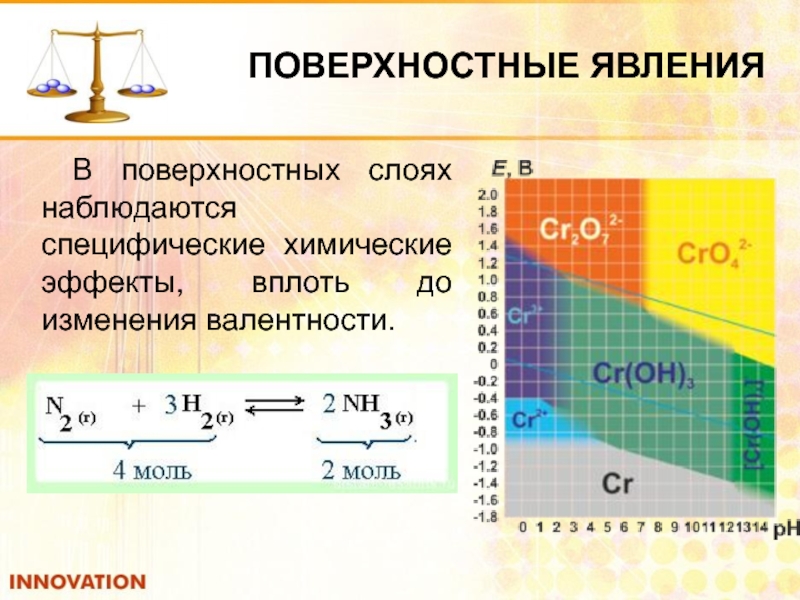
В поверхностных слоях наблюдаются специфические химические эффекты, вплоть до изменения
Слайд 6ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Особыми свойствами обладают и родственные поверхностным слоям малые объекты -
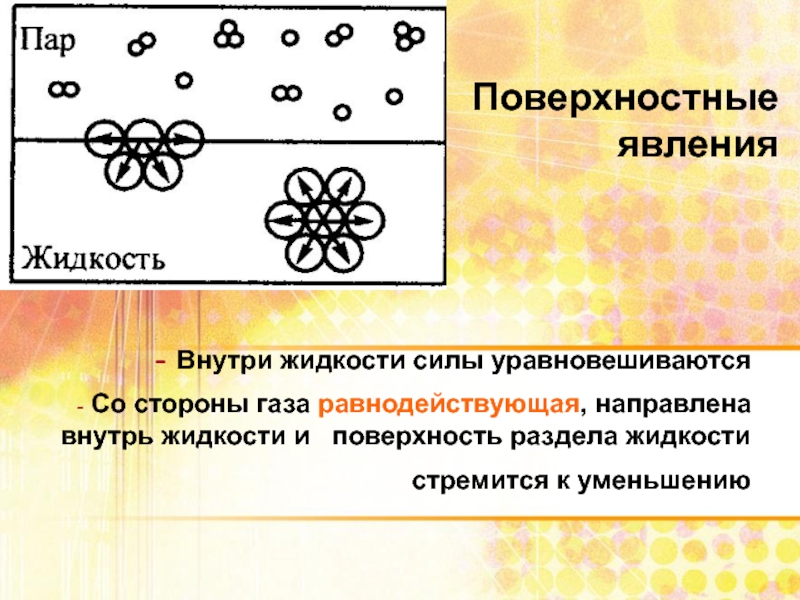
Слайд 7Поверхностные явления
Внутри жидкости силы уравновешиваются
Со стороны газа равнодействующая,
Слайд 8Поверхностные явления
Увеличение площади поверхности раздела фаз связано с переходом молекул
-dW=σ·dS
σ- коэффициент пропорциональнолсти, называемый поверхнолстным натяжением.
Физический смысл σ заключается в том, что он численно равен работе образования единицы поверхности.
Слайд 9Поверхностное натяжение σ — это работа, необходимая для создания 1 м2
Поверхностное натяжение — это избыточная энергия, отнесённая к единице площади поверхности раздела фаз σ= Е/ S
ПОВЕРХНОСТНАЯ ЭНГЕРГИЯ
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
Слайд 10Поверхностное натяжение
Поверхностное натяжение зависит от:
природы жидкости
σ(Н2О)=72,8 Дж/м2; σ(сыворотки крови)=45,4 Дж/м2).
температуры.
давления.
концентрации растворенного вещества.
Слайд 11Методы определения поверхностного натяжения
Методы определения поверхностного натяжения делятся на статические и
Статические методы:
Метод поднятия в капилляре
Метод Вильгельми
Метод лежачей капли
Метод определения по форме висячей капли.
Метод вращающейся капли
Слайд 12Капиллярный метод
Метод измерения капиллярного поднятия основан на определении разности уровней жидкостиМетод измерения
h — высота поднятия столба жидкости
θ— угол смачивания жидкостью стенки капилляра
g — ускорение свободного падения
ρ— плотность жидкости
ρ0— плотность газовой фазы
r0 — радиус капилляра
Слайд 13Методы определения поверхностного натяжения
Динамические методы связаны с разрушением поверхностного слоя. Динамические
Динамические методы:
Метод дю Нуи (метод отрыва кольца).
Сталагмометрический, или метод счета капель.
Метод максимального давления пузырька.
Метод осциллирующей струи
Метод стоячих волн
Метод бегущих волн
Слайд 14Метод
бегущих волн
При возмущении жидкости пластиной «лежащей» на её поверхности, по
σ— поверхностное натяжение;
ρ— плотность жидкости;
λ — длина волны;
γ— вынуждающая частота;
g — ускорение свободного падения.
Слайд 15Когезия
Взаимодействие (сцепление) молекул, атомов, ионов внутри одной фазы называют КОГЕЗИЕЙ.
Слайд 16Когезия. Работа когезии
Работа когезии определяется затратой энергии па обратимый изотермический разрыв
Слайд 17Когезия
Когезия отражает межмолекулярное взаимодействие внутри гомогенной фазы, поэтому ее могут характеризовать
Внутреннее давление жидкостей можно оценить с помощью уравнение Ван-дер-Ваальса. Молекулы в жидкостях находятся значительно ближе друг к другу, чем в газах, и ван-дер-ваальсовы силы межмолекулярного взаимодействия в них являются преобладающими, что и определяет жидкое агрегатное состояние.
Слайд 18Когезия
В уравнение Ван-дер-Ваальса для реальных газов (р+а/V2)(V-b)=RT
где р— внешнее давление;
V — мольный объем газа;
а — постоянная, характеризующая межмолекулярное взаимодействие,
b — постоянная, отражающая собственный объем моля молекул.
Внутреннее давление, oпределяем соотношением:
рвн=а/ V2
Слайд 19Когезия
Так как мольный объем жидкостей при нормальных условиях в тысячи раз
A(V-b)/V2=RT
или рвн =RT/(V— b)
Слайд 20Адгезия
Межфазное взаимодействие, или взаимодействие между приведенными в контакт поверхностями конденсированных тел
Различают адгезию между двумя жидкостями, между жидкостью и твердым телом и между двумя твердыми телами.
Слайд 21Работа адгезии
Адгезия является самопроизвольным процессом. Работа адгезии Wa, характеризующая прочность адгезионной
Ws=Was
Слайд 22Работа адгезии
Чтобы получить соотношение между работой адгезии и поверхностными натяжениями взаимодействующих
ΔG+Wa=0 или Wa=-ΔG
Слайд 23Работа адгезии
Для начального и конечною состояний системы имеем
где σ2,1, σ 3,1, σ2,3- соответственно поверхностное натяжение второго и третьего тела на границе с газом и межфазное натяжение на границе второго тела с третьим. Изменение энергии Гиббса системы в процессе адгезии равно
ΔG=Gкон-Gнач=σ2,3-σ2,1-σ3,1 Wа =σ 2,1 +σ 3,1 -σ 2,3
Уравнение Дюпре отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение. В то же время чем больше работа адгезии, т. е. межфазное взаимодействие, тем меньше межфазное натяжение. Межфазное натяжение станет равным нулю, когда исчезнет межфазная поверхность, что происходит при полном растворении фаз.
Слайд 24Смачивание
Мерой С. обычно служит краевой угол (или угол С.) в между
Смачивание-явление, возникающее при соприкосновении жидкости с поверхностью твердого тела или другой жидкости
Слайд 26Медико-биологическое значение темы:
1. Усвоение питательных и лекарственных веществ
2. Перенос О2
3. Действие ферментов
4. Детоксикация организма:
а) Гемосорбция - очистка крови
б) Лимфосорбция - очистка лимфы.
5. Поглощение ядовитых веществ в желудочно-кишечном тракте.
6. Хроматография:
- разделение смесей;
- очистка лекарственных препаратов;
- количественное определение витаминов, гормонов;
- диагностика заболеваний
Слайд 27Примеры
сорбция жидкостей на твердой поверхности;
сорбция газов на твердыми или жидкими поверхностями;
поверхностные
CaO + CO2 = CaCO3
Процессы, завершающиеся в поверхностном слое можно разделить на адсобцию и поверхностные химические реакции
Слайд 28Сорбция-изменение концентрации одного или нескольких компонентов в гетерогенной системе
Сорбция – процесс
Сорбент – поглотитель
Сорбтив – поглощаемое вещество
Адсорбция – поглощение поверхностью сорбента
Абсорбция – поглощение всем объемом сорбента
Слайд 29Процессы, протекающие в объеме твердого сорбента
Данные процессы можно разделить на:
Абсорбцию;
Хемосорбцию;
Капиллярную конденсацию.
Слайд 30Адсорбция
Адсорбция – самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению
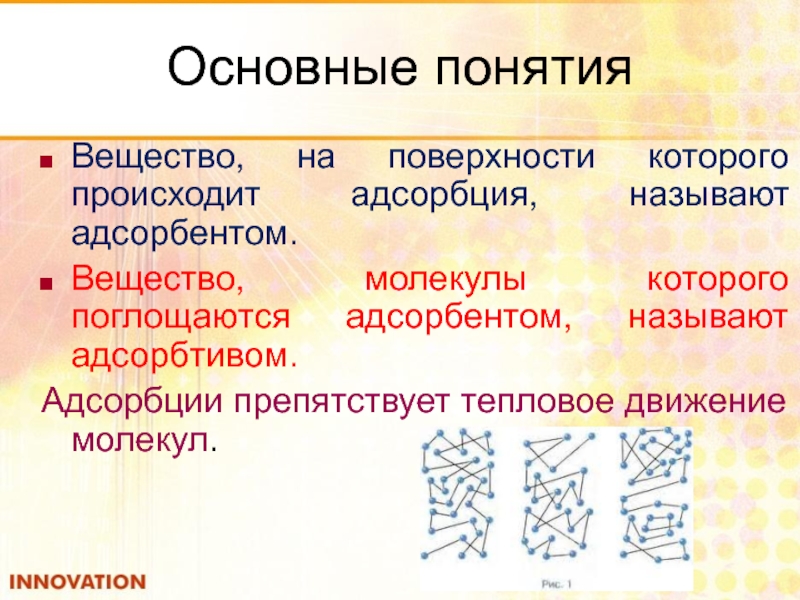
Слайд 31Основные понятия
Вещество, на поверхности которого происходит адсорбция, называют адсорбентом.
Вещество, молекулы которого
Адсорбции препятствует тепловое движение молекул.
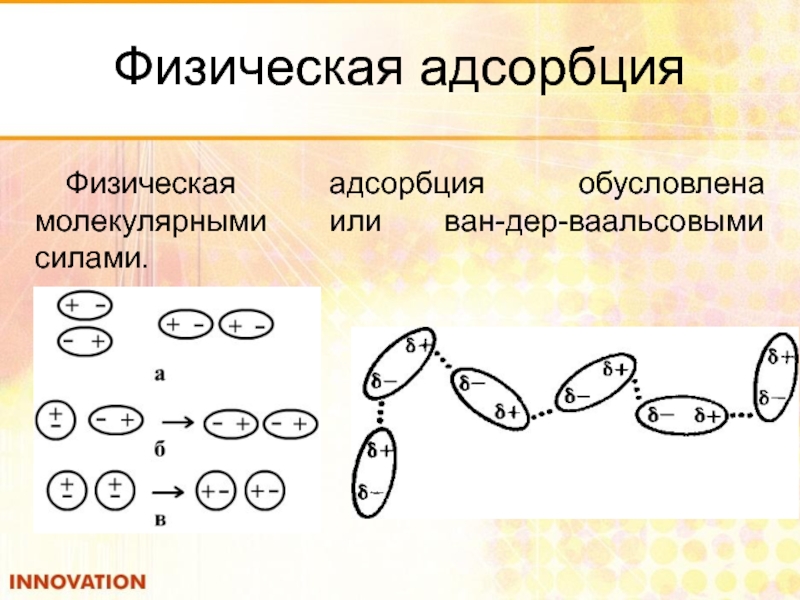
Слайд 32Физическая адсорбция
Физическая адсорбция обусловлена молекулярными или ван-дер-ваальсовыми силами.
Слайд 33Химическая адсорбция
Химическая адсорбция или хемосорбция обусловлена химическими силами. При такой адсорбции
Скорость химической адсорбции увеличивается с повышением температуры.
Слайд 34Количественно адсорбция может выражаться через различные величины:
1) Через предложенную Гиббсом величину
2) Величиной А, представляющей собой количество адсорбтива в объеме адсорбционного слоя и приходящееся на единицу поверхности адсорбента. Для пористых твердых адсорбентов адсорбцию относят к единице массы адсорбента.
Слайд 35Абсолютная адсорбция
Значение А не совпадает с величиной адсорбции Г т.к. оно
Однако количество адсорбтива в объеме является очень маленькой величиной, то:
А ~ Г
Слайд 36Уравнение Гиббса
С вещества в поверхностном слое < С вещества в объёме фазы
<0 Г > 0, т.е. ↑с ↓σ (ПАВ)
С вещества в поверхностном слое > С вещества в объёме фазы
Г - количество адсорбированного вещества [моль/м2]
а – равновесная активность вещества в объеме раствора [моль/л]
R - универсальная газовая постоянная = 8,31 Дж/моль.град(К)
- поверхностная активность растворенного вещества.
Слайд 37Уравнение Гиббса для разбавленных растворов и идеальных газов
Г - количество адсорбированного вещества [моль/м2]
с – концентрация вещества в объеме раствора [моль/л]
R - универсальная газовая постоянная = 8,31 Дж/моль.град(К)
Для разбавленных растворов а ~ с
Г - количество адсорбированного вещества [моль/м2]
р – равновесное давление газа, Па
R - универсальная газовая постоянная = 8,31 Дж/моль.град(К)
Для газообразных веществ:
Слайд 38Уравнение изотермы адсорбции
Полученное Гиббсом уравнение изотермы адсорбции справедливо для любых составов
Жидкость – газ;
Газ – твердое тело;
Жидкость – твердое тело;
Жидкость – жидкость.
Слайд 39Поверхностная активность
Способность растворенного вещества изменять
поверхностное натяжение – поверхностная
активность (g)
Мера поверхностной активности:
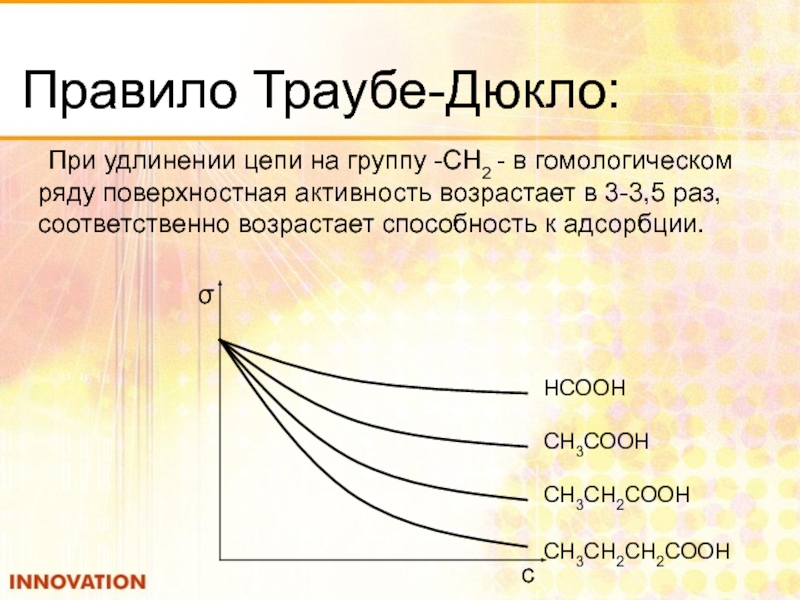
Слайд 40Правило Траубе-Дюкло:
При удлинении цепи на группу -СН2 - в гомологическом ряду
НСООН
СН3СООН
СН3СН2СООН
СН3СН2СН2СООН
σ
с
Слайд 41ПАВ, ПИВ, ПНВ
Поверхностно-активные вещества (ПАВ): уменьшают σ растворителя.
σ раствора
ПАВ: спирты, органические кислоты, сложные эфиры, белки, холестерин, жиры, липиды, мыла.
Поверхностно-инактивные вещества (ПИВ): увеличивают σ растворителя.
σ раствора > σ растворителя; g < О.
ПИВ: неорганические кислоты, основания, соли, глицерин, α - аминокислоты.
Поверхностно-неактивные вещества (ПНВ): не изменяют поверхностное натяжение растворителя.
σ раствора = σ растворителя; g = О.
ПНВ: сахароза.
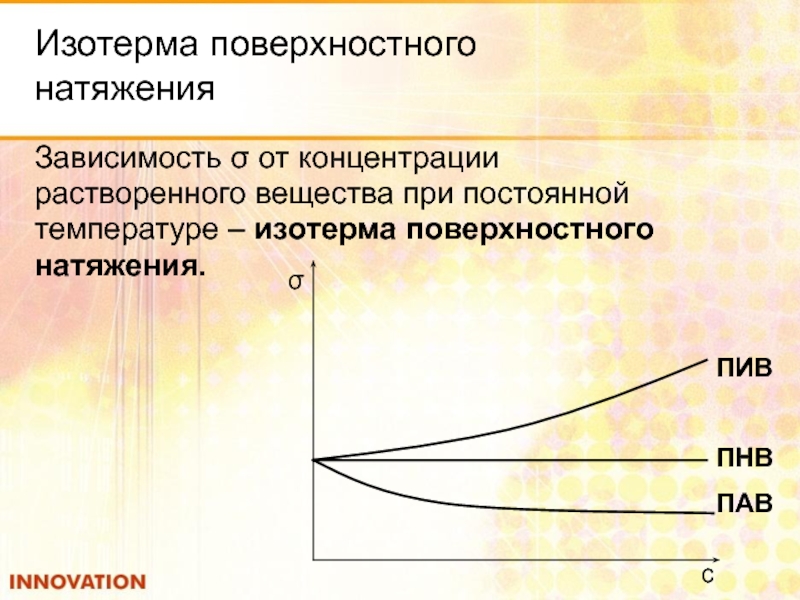
Слайд 42Изотерма поверхностного
Зависимость σ от концентрации
растворенного вещества при постоянной
температуре – изотерма поверхностного
натяжения.
ПИВ
ПНВ
ПАВ
σ
с
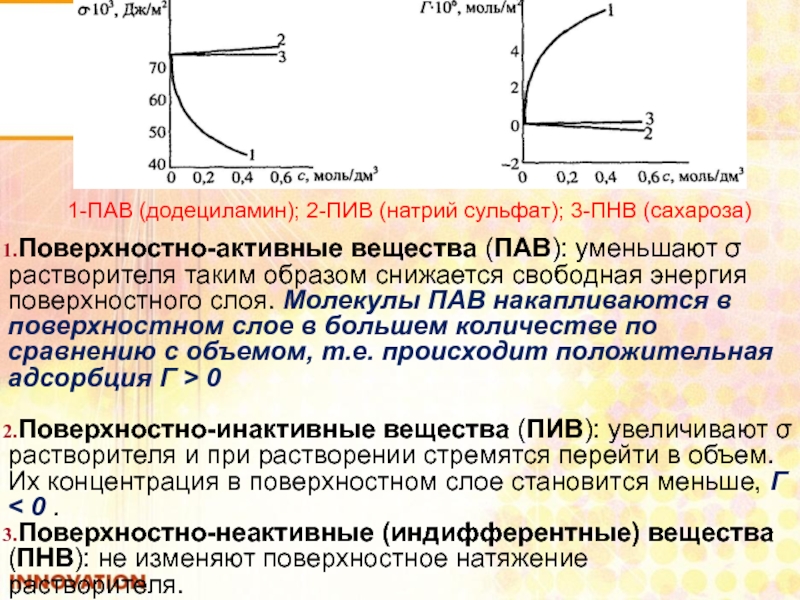
Слайд 43Поверхностно-активные вещества (ПАВ): уменьшают σ растворителя таким образом снижается свободная энергия
Поверхностно-инактивные вещества (ПИВ): увеличивают σ растворителя и при растворении стремятся перейти в объем. Их концентрация в поверхностном слое становится меньше, Г < 0 .
Поверхностно-неактивные (индифферентные) вещества (ПНВ): не изменяют поверхностное натяжение растворителя.
1-ПАВ (додециламин); 2-ПИВ (натрий сульфат); 3-ПНВ (сахароза)
Слайд 44Строение молекулы ПАВ:
Молекула ПАВ состоит из:
неполярной гидрофобной углеводородной группы (“хвост”)
полярной гидрофильной группы (“голова”):
-ОН, -СООН, -С(О)-О,-NН2; -SО3H.
“хвост” “голова”
Слайд 46Расчет изотермы адсорбции
Г= ƒ(с)
Для расчета изотермы адсорбции необходимо построить зависимость σ
В точках кривой σ=ƒ(с), отвечающих различным концентра-циям проводим касательные, по тангенсам угла наклона которых определяем значение dσ/dс. Подставляя данные в уравнение Гиббса получаем значения величин адсорбции, по которым строим изотерму Г= ƒ(с).
1-изотерма поверхностного натяжения, 2-изотерма адсорбции
Слайд 48Уравнение Шишковского
Для построения изотермы поверхностного натяжения можно воспользоваться уравнением Шишковского (используют
σ=σ0-a ln (1+bc)
Δσ=σ0-σ=a ln (1+bc)
a, b – эмпирические постоянные, σ, σ0 – поверхностное натяжение раствора и растворителя. b называют удельной капиллярной постоянной.
Слайд 49Переход от уравнения Гиббса к уравнению Ленгмюра
Продифференцировав уравнение Шишковского по концентрации
dσ/dc=ab/(1+bc)
и
Обозначив a/RT через Г∞, а b через К имеем уравнение Ленгмюра:
Слайд 51Адсорбция твердыми телами
Величина адсорбции зависит от:
Размера поверхности адсорбента
чем > Sповерхности,
2. Температуры (↑t ↓Г ).
3. Типа сорбента, его сродства к растворителю.
- гидрофильные сорбенты (силикагель SiO2, глина, пористое стекло) для адсорбции полярных веществ из неполярных (неводных) растворителей.
- гидрофобные сорбенты (активированный уголь, графит, тальк) для адсорбции неполярных веществ из полярных растворителей.
4. Заряда адсорбента и адсорбтива.
5. Концентрации адсорбтива.
Слайд 52Теории адсорбции
Основной задачей теории адсорбции является моделирование и математическое описание процесса
ƒ(A, p, T)=0 или ϕ(Г, с, Т)=0
Слайд 53Уравнение Фрейндлиха
А = x/m = k · p1/n
х – количество вещества
m – масса адсорбента
p – равновесное давление газа в системе
V адсорбции = V десорбции
к – константа Фрейндлиха, к = А при р = 1
n – эмпирическая константа.
Слайд 54Уравнение Фрейндлиха для адсорбции из раствора на твердом адсорбенте
Г = x/m
х – количество вещества адсорбтива (моль)
m – масса адсорбента
С – равновесная концентрация, при которой
v адсорбции = v десорбции
КФ – константа Фрейндлиха, КФ = Г при С = 1
n – эмпирическая константа, 0,1–0,6.
Слайд 55Константы адсорбции
Показатель с участием константы 1/n (n) является правильной дробью и
0,2-1 для адсорбции из газовой среды;
0,1-0,5 для адсорбции из раствора.
Константы k и 1/n (n) определяют путем подстановки данных в линейную форму уравнения Фрейндлиха:
lg A = lg k + 1/n lg c
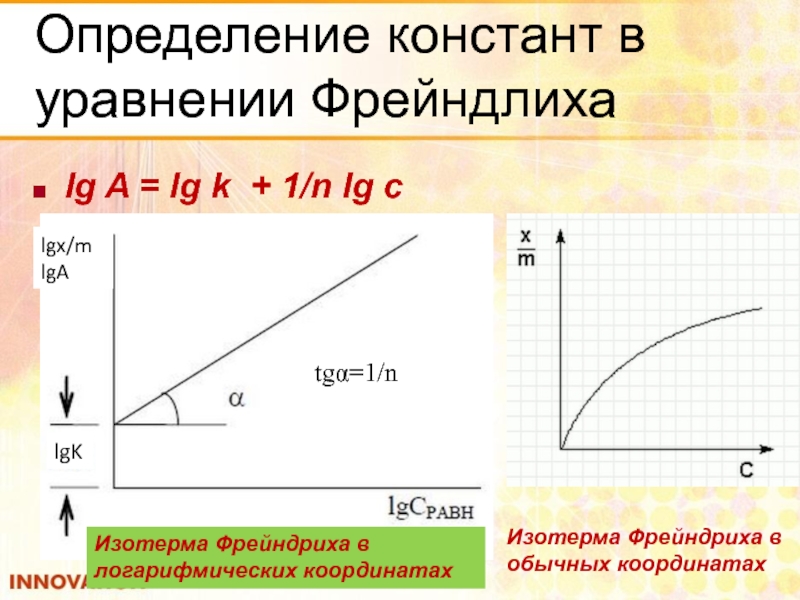
Слайд 56Определение констант в уравнении Фрейндлиха
lg A = lg k + 1/n
lgx/m
lgA
lgK
tgα=1/n
Изотерма Фрейндриха в
обычных координатах
Изотерма Фрейндриха в
логарифмических координатах
Слайд 57Теория Ленгмюра
Зависимость адсорбции газа на твёрдой поверхности от давления газа
1) На каждом абсорбционном месте на поверхности адсорбента может находиться только одна молекула или адсорбция является локализованной на адсорбционных центрах.
2) Адсорбция является молекулярной, т.е. осуществляется только в одном слое.
3) Адсорбционная поверхность является однородной. Это означает, что все адсорбционные места на поверхности адсорбента по своим свойствам не отличаются друг от друга.
4) Между адсорбированными молекулами отсутствует взаимодействие.
5) Адсорбция есть процессом обратимым.
Слайд 58Теория Ленгмюра
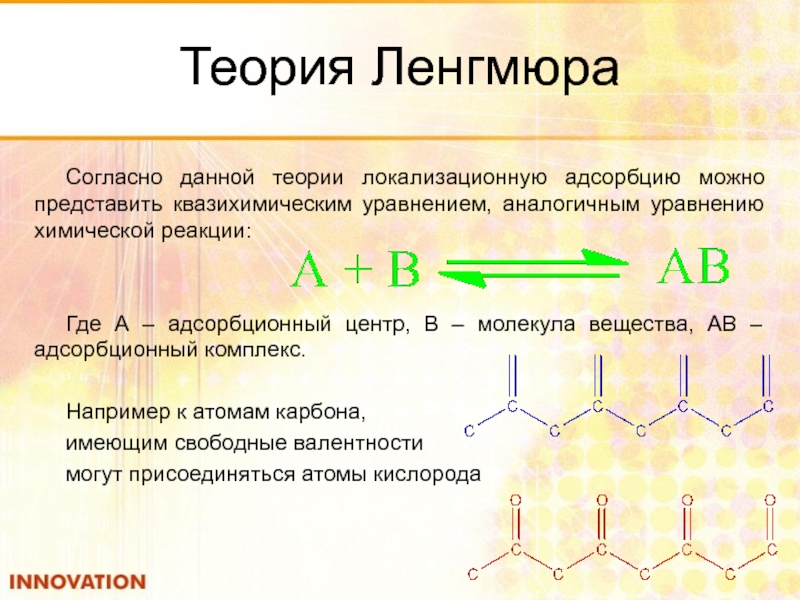
Согласно данной теории локализационную адсорбцию можно представить квазихимическим уравнением, аналогичным
Где А – адсорбционный центр, В – молекула вещества, АВ – адсорбционный комплекс.
Например к атомам карбона,
имеющим свободные валентности
могут присоединяться атомы кислорода
Слайд 59Теория Ленгмюра
Предположим, что на поверхности 1м2 часть Θ занята адсорбированными молекулами,
Скорость адсорбции составит:
ω1 = k1P(1 – Θ),
где P – давление адсорбата;
k1 – константа скорости адсорбции;
1- Θ – доля свободных мест.
Слайд 60Теория Ленгмюра
Скорость процесса десорбции определится по уравнению:
ω2 = k2Θ,
Θ – доля адсорбционных мест занятых
молекулами адсорбата
Для условий равновесия можно записать:
ω1 = ω2 или k1Р(1 – Θ) = k2Θ, откуда можно получить, что: Θ=A/A∞=k1c/(k1c+k 2), или
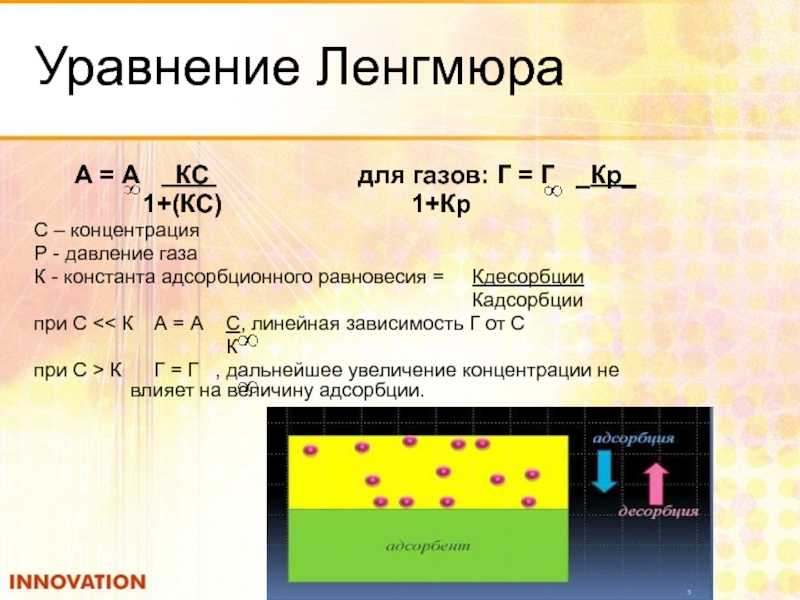
Слайд 61Уравнение Ленгмюра
А = А КС
1+(КС) 1+Кр
С – концентрация
Р - давление газа
К - константа адсорбционного равновесия = Кдесорбции
Кадсорбции
при С << К А = А С, линейная зависимость Г от С
К
при С > К Г = Г , дальнейшее увеличение концентрации не влияет на величину адсорбции.
Слайд 62
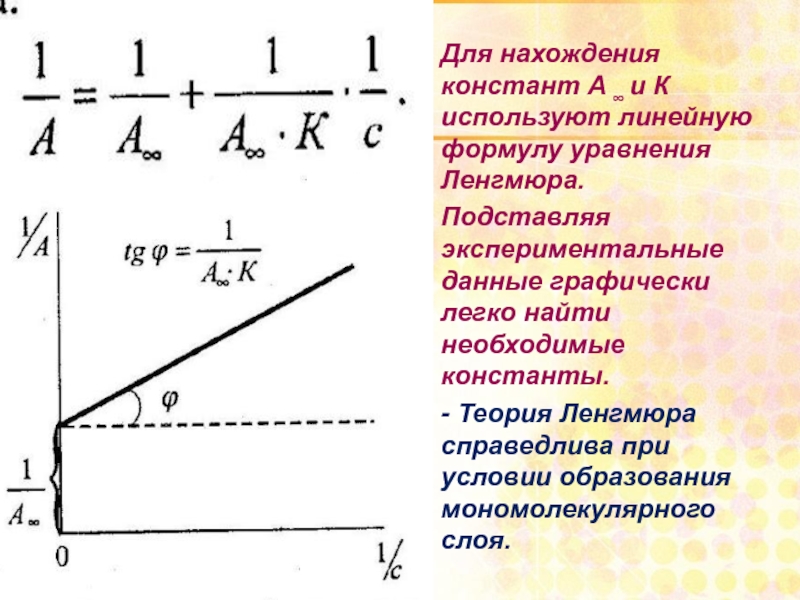
Для нахождения констант А ∞ и К используют линейную формулу уравнения
Подставляя экспериментальные данные графически легко найти необходимые константы.
- Теория Ленгмюра справедлива при условии образования мономолекулярного слоя.
Слайд 64Определение площади молекулы и толщины слоя
При с→∞ lim Г = Г∞
S = 1 / Г∞ · N a
δ= Г∞ · M / ρ
S- площадь молекулы;
δ- толщина молекулярного слоя.
Слайд 65Применение теории Ленгмюра
Несмотря на то, что рассчитанные по формуле Ленгмюра данные
Sуд=A∞·Na·S
S-площадь поперечного сечения адсорбированной молекулы;
Sуд- удельная поверхность адсорбента, катализатора…
Слайд 66Теория полимолекулярной адсорбции БЭТ (Брунауер, Эммет, Теллер)
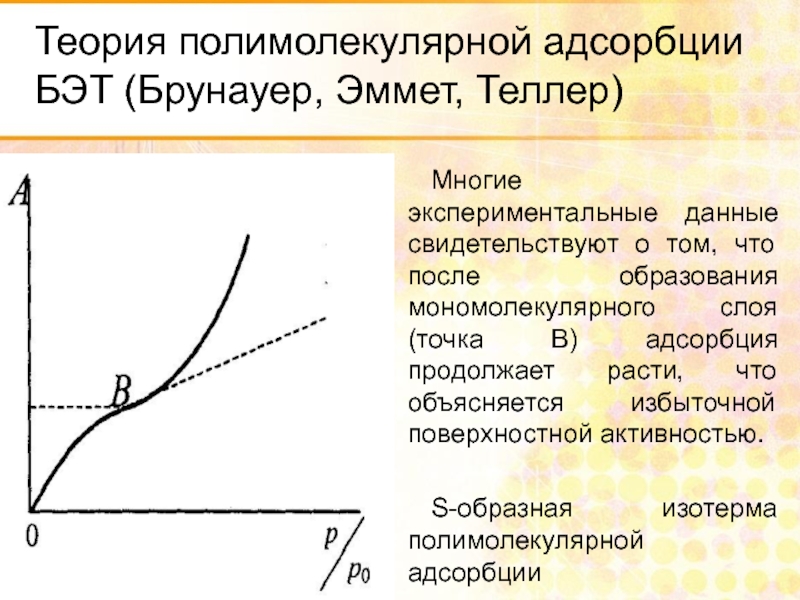
Многие экспериментальные данные свидетельствуют о
S-образная изотерма полимолекулярной адсорбции
Слайд 67Теория БЭТ
Изотерма І характерна для случая мономо-лекулярной адсорбции. Изотермы ІІ-V связаны
- Уравнение изотермы полимолекулярной адсорбции
Слайд 68Потенциальные теории адсорбции
А. Эйкен и М. Поляни (1914-1916)
Авторы исключали
Изменение адсорбционных
сил в зависимости от
расстояния от поверхности
Слайд 69Потенциальные теории адсорбции
Данное адсорбционное поле характеризует адсорбционный потенциал ε:
р0 – давление
р – давление вне адсорбционного объема
Значению адсорбционного потенциала соответствует величина адсорбции А, равная произведению объема адсорбционной пленки V на плотность адсорбтива в конденсированном состоянии ρ:
А= V · ρ
Слайд 70Капиллярная конденсация
Адсорбция паров пористыми телами может сопровождаться конденсацией адсорбтива в тонких
Капиллярная конденсация может происходить при определенных условиях:
Сорбент должен быть пористым;
Температура должна быть ниже критической для данного пара;
Жидкость должна смачивать стенки капилляра (иначе не будет образовываться вогнутый мениск)
Слайд 71Капиллярная конденсация
Изотерма адсорбции, осложненная капилярной конденсацией принадлежит к одному из типов
При адсорбции, сопровождающейся капилляной конденсацией наблюдается явление сорбционного гистерезиса при котором изотермы адсорбции и десорбции не совпадают (десорбция происходит при меньших давлениях).
Слайд 72Капиллярная конденсация
Изотермы капиллярной конденсации А=ƒ(p/p0) используют для исследования пористой структуры сорбентов
V=A/ρ
Затем находят радиус капилляров в сорбенте и строят кривую адсорбенета V=ƒ (r)
Явление капиллярной конденсации используют для рекуперации растворителей, в том числе и в фармацевтической промышленности
Слайд 73АДСОРБЦИЯ НА ГРАНИЦЕ ТВЕРДОЕ ТЕЛО – РАСТВОР
При изучении адсорбции из растворов
Слайд 74Молекулярная адсорбция
При молекулярной адсорбции из растворов (где участвуют 3 вещества) возможны
положительная адсорбция (если растворенное вещество адсорбируется сильнее растворителя);
отрицательная адсорбция (если растворитель адсорбируется сильнее растворенного вещества);
нулевая адсорбция (концентрации растворенного вещества на поверхности раздела фаз и в растворе будут одинаковыми).
Слайд 75Молекулярная адсорбция
Экспериментально величину адсорбции определяют зная начальную концентрацию раствора с0, объем
Если известна площадь поверхности адсорбента, то изотерму адсорбции относят к данной величине:
Изотермы адсорбции на угле из водных растворов: 1-фенола, 2-янтарной кислоты, 3-бензойной кислоты
Слайд 76Правило уравнивания полярностей (Ребиндера)
Вещество С будет адсорбироваться на поверхности раздела фаз
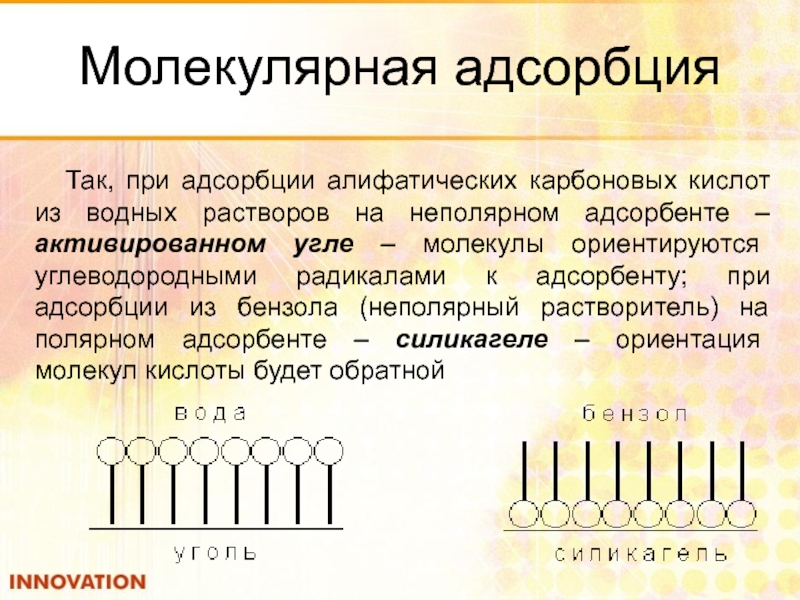
Слайд 77Молекулярная адсорбция
Так, при адсорбции алифатических карбоновых кислот из водных растворов на
Слайд 78Вывод
Из приведенного выше подтверждается тот факт, что:
Для адсорбции ПАВ из неполярных
На гидрофобных поверхностях (уголь, графит, тальк) должны лучше адсорбироваться ПАВ из водных растворов
Слайд 79Адсорбция
электролитов
Адсорбция из водных растворов электролитов происходит, как правило, таким образом,
Слайд 80Уравнение Никольского
Процессы ионного обмена на твердой поверхности характеризуются уравнением Б.П.Никольского:
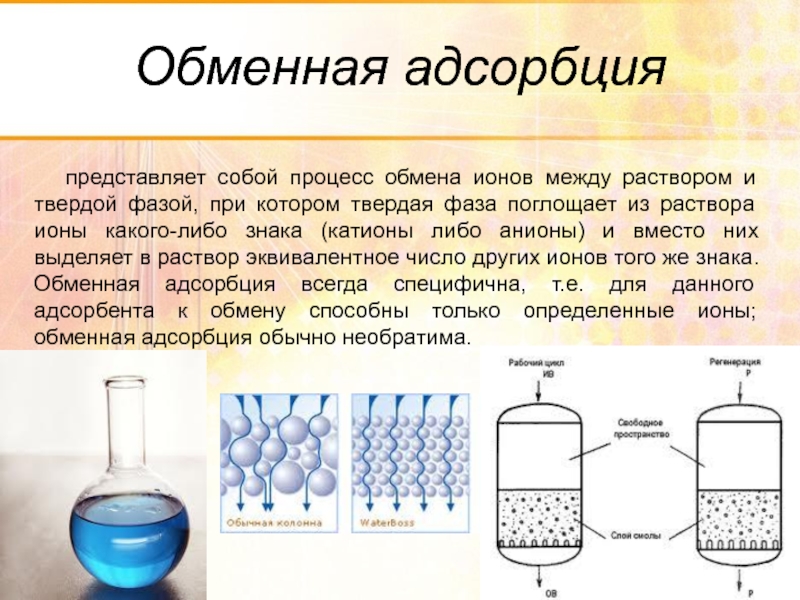
Слайд 81Обменная адсорбция
представляет собой процесс обмена ионов между раствором и твердой фазой,
Слайд 82Избирательная адсорбция
Избирательная адсорбция не сопровождается выделением в раствор эквивалентного числа других
Слайд 83Правило Панета-Фаянса
Из раствора адсорбируются те ионы, которые входят в
состав кристаллической решетки
с ним малорастворимое соединение.
Определить знак заряда поверхности AgI(крист.) полученного по реакции:
АgNО3(р) + КI(р) = АgI(крист.) + KNO3(р)
а) nАgNО3 = nКI : поверхность осадка не заряжена;
б) nАgNO3 > nКI : в) nАgNО3 < nКI :
избыток АgNO3 ⬄ Аg+ + NО3- избыток КI ⬄ К+ + I-
АgI + АgI -
+ -
+ -
Слайд 84Ионообменная адсорбция
Ионообменная адсорбция – процесс, в котором адсорбент и раствор обмениваются
RM1 + М2+ → RM2 + M1+ обмен катионов
катионит
RА1 + А2- → RА2 + А1- обмен анионов
анионит
Слайд 85Хроматография
Хроматография - динамический метод анализа, основанный на многократно повторяющихся процессах сорбции
Слайд 86Хроматография – физико-химический метод,
используется для разделения веществ
аналитические цели
Служит для идентификации и количественного определения органических и неорганических веществ
Слайд 87Из истории хроматографии
Михаил Семёнович Цвет
(1872—1919)
День
Доклад М.С. Цвета «О новой категории адсорбционных явлений и о применении их к биохимическому анализу»
Свой метод М.С. Цвет назвал – «хроматография»
(запись цвета)
Ричард Кун (институт фундаментальной медицины г. Гейдельберг) (1938г. Нобелевская премия по химии за предложенную Цветом адсорбционную хроматографию каратиноидов и витаминов):
Альфред Винтерштайн (1915г. Нобелевская премия по химии за исследования хлорофиллов)
Арчер Портер Мартин, Ричард Лоуренс Миллингтон Синдж (1938г. первый противоточный экстрактор с использованием воды и хлороформа для разделения олигопептидов;
1940г. Использование жидкость-жидкостной хроматографии для разделения аминокислот;
19 ноября 1941г. Статья «Новая форма использования двух жидких фаз для хроматографии» в «Biochemical journal»;
1952г. Нобелевская премия за открытие распределительной хроматографии
Арчер Портер Мартин, Энтони Траффорд Джеймс (50-е годы первый газовый хроматограф)
Измаилов, Шрайбер (1938г. Первые работы по тонкослойной хроматографии)
Шталь (1956г. Использование тонкослойной хроматографии как аналитического метода)
Слайд 88капиллярная газовая хроматография (КГХ),
высокоэффективная жидкостная хроматография (ВЭЖХ),
высокоэффективная тонкослойная хроматография (ВЭТСХ),
высокоэффективная ионная
сверхкритическая флюидная хроматография (ВЭИХ),
капиллярный электрофорез (КЭ)
Современные
хроматографические методы:
Слайд 89«Никакое другое открытие не оказало на исследования в органической химии такого
Каррер, 1947г.
Хроматографические методы применяют для:
количественной оценки основного вещества в субстанции;
проведения определения примесей в субстанциях и лекарственных формах;
проведения предварительного и подтверждающего этапов при фармацевтическом и химико-токсикологическом анализе;
определения чистоты пищевых продуктов и воды;
изучения кинетики химических реакций;
проведения анализа нефтепродуктов и т.д.
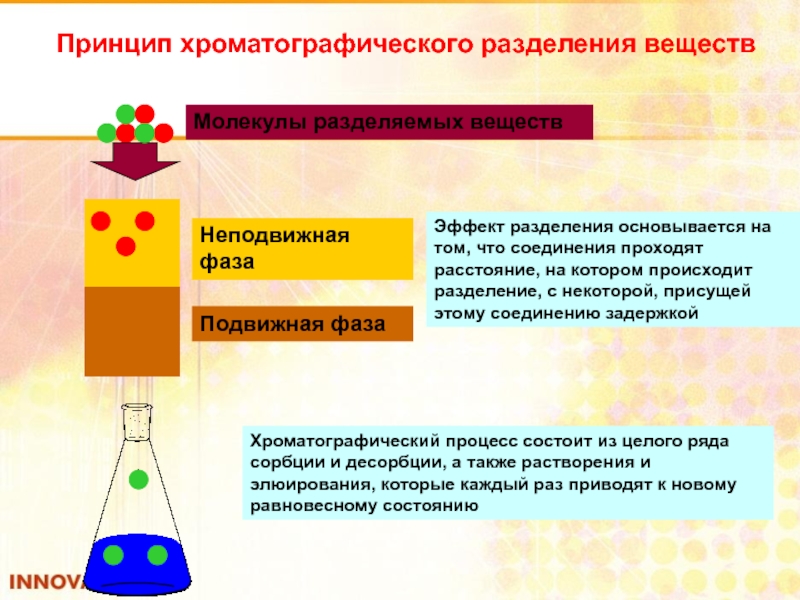
Слайд 90Принцип хроматографического разделения веществ
Неподвижная фаза
Подвижная фаза
Молекулы разделяемых веществ
Эффект разделения основывается на
Хроматографический процесс состоит из целого ряда сорбции и десорбции, а также растворения и элюирования, которые каждый раз приводят к новому равновесному состоянию
Слайд 91Классификация методов хроматографии
По типу агрегатного состояния фаз
Газовая хроматография (ГХ)
летучие вещества,
испаряются без разложения
вещество должно быть растворимо в каком-либо растворителе
Критерии использования метода
По типу процесса разделения
стационарная фаза –
твердая активная основа
Адсорбционная Распределительная
Принцип: вещества с разной силой
адсорбируются на твердой фазе
и снова десорбируются
Стационарная фаза –
жидкость, нанесенная на твердый неактивный носитель
Принцип: в зависимости от растворимости, вещества распределяются между двумя несмешивающимися жидкостями
По технике проведения
Внешняя хроматограмма Внутренняя хроматограмма
вещества детектируются
вне зоны разделения
вещества детектируются в зоне разделения (ТСХ, бумажная хроматография)
Слайд 92Классификация хроматографических методов по агрегатному состоянию фаз, типам процессов разделения и
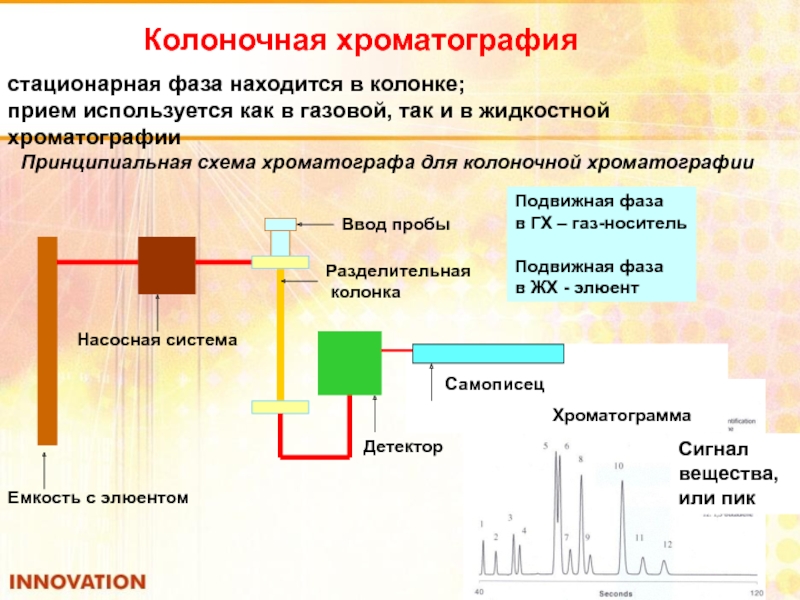
Слайд 93Колоночная хроматография
стационарная фаза находится в колонке;
прием используется как в газовой, так
Принципиальная схема хроматографа для колоночной хроматографии
Емкость с элюентом
Насосная система
Ввод пробы
Разделительная
колонка
Детектор
Подвижная фаза
в ГХ – газ-носитель
Подвижная фаза
в ЖХ - элюент
Самописец
Хроматограмма
Сигнал вещества,
или пик
Слайд 94Хроматограмма
Хроматографический пик – концентрация пробы в подвижной фазе на выходе из
Пик- качественная и количественная характеристика
Качественный анализ: время удерживание одного компонента при одинаковых условиях хроматографирования – постоянная величина.
Время удерживания – время, которое проходит с момента введения пробы до регистрации самописцем максимума сигнала.
Условия хроматографии, влияющие на время удерживания:
тип колонки;
состав подвижной фазы;
скорость потока подвижной фазы;
температура
Две возможности проведения достоверного качественного анализа:
И пробу и стандарт хроматографируют в разных хроматографических условиях
2. Выбор соответствующих детекторов
Слайд 95Правильная запись данных ГЖХ
Номер (шифр) эксперимента или номер образца
Количество введенной пробы
Расход газа-носителя
Рабочая температура
Усиление, используемое для каждого пика
Скорость диаграммы
Пример:
Опыт К-9
1 мкл
10% смазки апиезон APL на хромасорбе W, 200см
N2, 60 мл/мин
1500С
Все пики при 50•102
Диаграмма 60 см/ч
Слайд 96Газо-жидкостная хроматография (ГЖХ)
Газо-жидкостная хроматография используется для разделения «летучих» соединений, т.е. соединений
Чувствительность метода: позволяет определить до 10-6г количества соединения
Неподвижной фазой является жидкость, подвижной – газ
Жидкая неподвижная фаза - высокомолекулярную нелетучую жидкость (силиконовые масла, углеводородные смазки и высокомолекулярные полиэфиры)
Подвижная фазой – газ (азот)
Насадочные колонки Капиллярные колонки
2 - 4 мм 0.2-0.5 мм
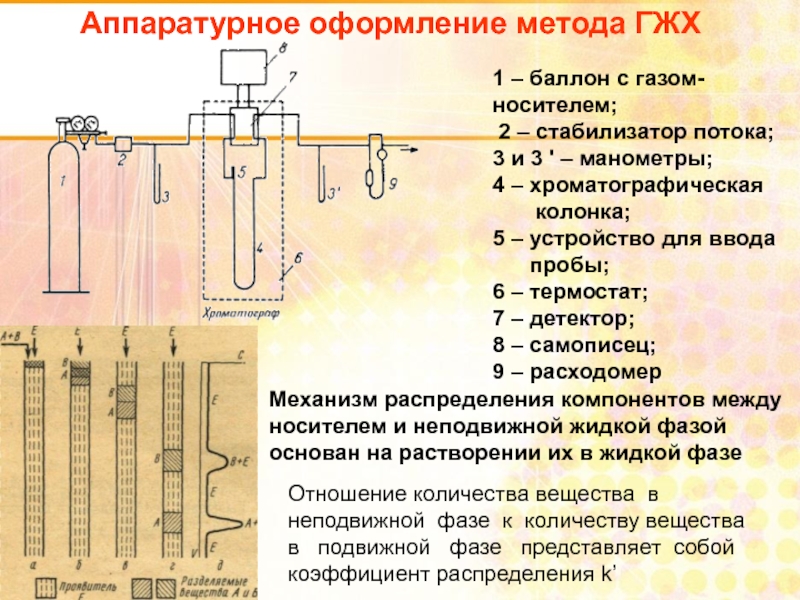
Слайд 97Аппаратурное оформление метода ГЖХ
1 – баллон с газом-носителем;
2 – стабилизатор
3 и 3 ' – манометры;
4 – хроматографическая
колонка;
5 – устройство для ввода
пробы;
6 – термостат;
7 – детектор;
8 – самописец;
9 – расходомер
Механизм распределения компонентов между носителем и неподвижной жидкой фазой основан на растворении их в жидкой фазе
Отношение количества вещества в неподвижной фазе к количеству вещества в подвижной фазе представляет собой коэффициент распределения k’
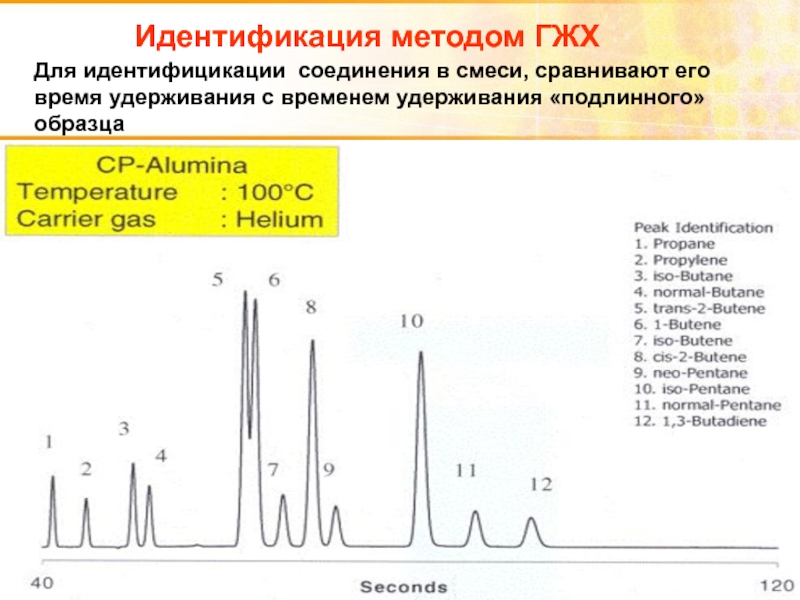
Слайд 99Идентификация методом ГЖХ
Для идентифицикации соединения в смеси, сравнивают его время удерживания
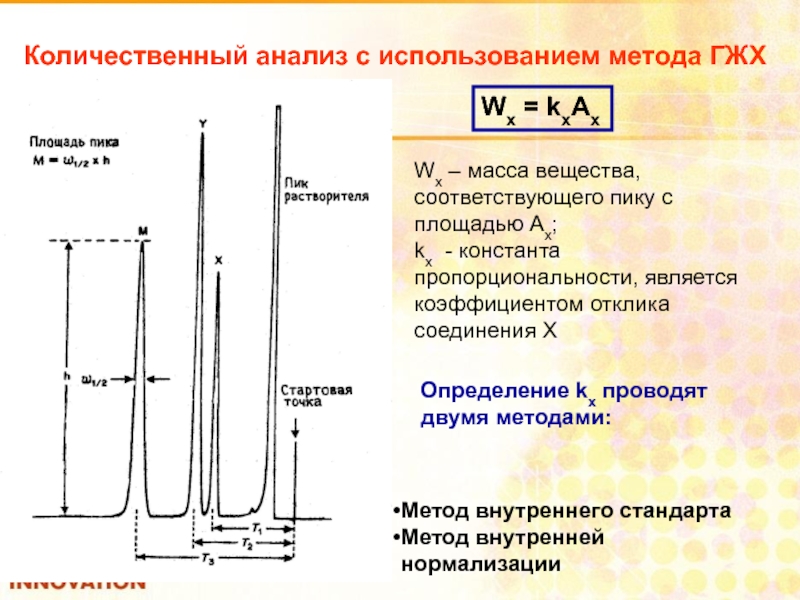
Слайд 100Количественный анализ с использованием метода ГЖХ
Wx = kxAx
Wx – масса вещества,
kx - константа пропорциональности, является коэффициентом отклика соединения Х
Определение kx проводят
двумя методами:
Метод внутреннего стандарта
Метод внутренней нормализации
Слайд 101Характеристики вещества, получаемые в хроматографическом методе
Время удержания (время выхода) – время,
Объем удержания – объем газа/жидкости-носителя, который проходит по хроматографической колонке с момента ввода анализируемой пробы в колонку до момента выхода вершины пика вещества из колонки.
Индекс удержания – отношение времен удержания какого-то стандартного вещества (обычно для неполярных колонок какого-либо углеводорода известного строения) и определяемого вещества. Для одинаковых по химическому составу колонок является постоянной величиной.
Площадь хроматографического пика – параметр, характеризующий количество вещества в пробе.




![Поверхностное натяжение σ — это работа, необходимая для создания 1 м2 поверхности [σ]= Дж/м2 Поверхностное](/img/tmb/6/509145/5fa2f99a7b1aebfdbca1a0bbbe6649d9-800x.jpg)