- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физическая химия. Химическая термодинамика презентация
Содержание
- 1. Физическая химия. Химическая термодинамика
- 2. Общий план работы в семестре Лекции –
- 3. Физическая химиия Физическая химия – наука о
- 4. Рекомендуемая литература (основная) 1. Попова А.А., Попова
- 5. 1. Романовский Б.В. Основы химической кинетики. М.:
- 6. 11. Эммануэль Н.М., Кнорре Д.Г. Курс химической
- 7. Физическая химия – краткая историческая справка www.lcr.tsu.ru *
- 8. Историческое развитие Период 1940 – 2012 Г.К.
- 9. Историческое развитие К. Шееле (Швеция - 1773),
- 10. Историческое развитие Д. Дальтон (Англия 1801-1803), Л.
- 11. Историческое развитие С. Аррениус (Швеция – 1883-1887)
- 12. ВВЕДЕНИЕ Предмет и задачи физической химии www.lcr.tsu.ru *
- 13. Предмет и задачи физической химии Объектами изучения
- 14. При решении задач физической химии используются 2-а
- 15. ОСНОВНЫЕ РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ ТЕРМОДИНАМИКА – изучает
- 16. СОДЕРЖАНИЕ КУРСА: Строение вещества (учение о строении
- 17. 2. Химическая термодинамика Основные понятия и определения www.lcr.tsu.ru *
- 18. Термодинамика – часть теоретической физики изучающая макроскопические
- 19. Химическая термодинамика – раздел физической химии,
- 20. Анализ физических явлений и установление соотношений между
- 21. Особенности термодинамики: Универсальность термодинамического аппарата (т/д аппарат
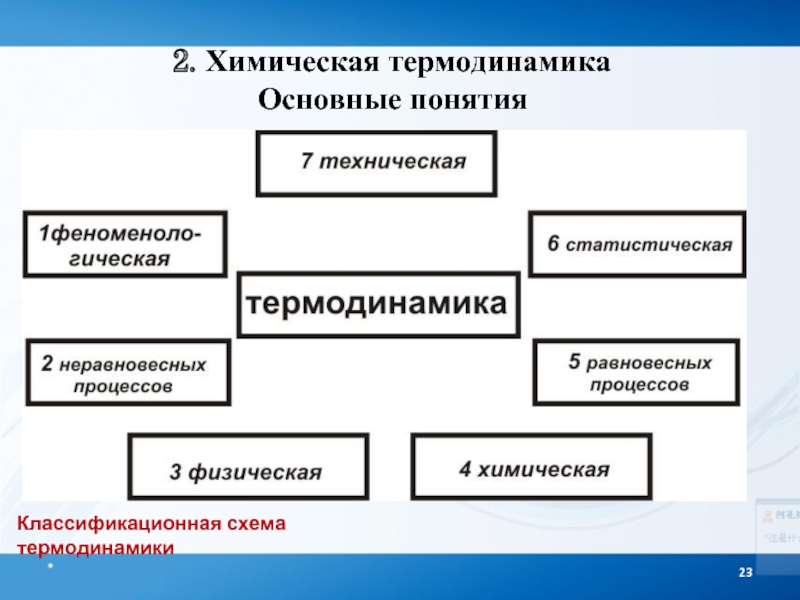
- 22. Общая классификация термодинамики I. По характеру используемых
- 23. Классификационная схема термодинамики 2. Химическая термодинамика Основные понятия *
- 24. Задачи химической термодинамики: • Получение
- 25. 2. Химическая термодинамика Основные понятия Для
- 26. 2. Химическая термодинамика Основные понятия и определения
- 27. Термодинамические параметры (состояния) или свойства: Внешние параметры:
- 28. Если одну экстенсивную Т/Д величину (Y1)
- 29. Аддитивная физическая величина — физическая
- 30. Обобщенные силы – P, А мех,
- 31. Система (т/д - система) – тело или
- 32. открытая закрытая изолированная http://www.nscience.ru/ 2. Химическая термодинамика
- 33. «ЧАСТИЧНО ОТКРЫТЫЕ» СИСТЕМЫ Адиабатическая сисмтеа –
- 34. По «структурообразованию» системы: Гомогенная система –
- 35. 2. Химическая термодинамика Основные понятия и определения
- 36. Термодинамическая фаза - однородная по составу и свойствам
- 37. Макроскопическая часть среды (вещества), имеющая однородный физико-химический
- 38. Набор термодинамических фаз вещества обычно значительно богаче
- 39. Состояние системы – совокупность
- 40. * 2. Химическая термодинамика Основные понятия и
- 41. * 2. Химическая термодинамика Уравнение состояния
- 42. * 2. Химическая термодинамика Уравнение состояния Термическое
- 43. Термические коэффициенты Уравнение состояния в диф.
- 44. * 2. Химическая термодинамика Уравнение состояния Термическое
- 45. * 2. Химическая термодинамика Уравнение состояния
- 46. * 2. Химическая термодинамика Уравнение состояния Уравнения
- 47. Состояния термодинамических систем www.lcr.tsu.ru *
- 48. Набор интенсивных термодинамических параметров определяет состояние системы.
- 49. * 2. Химическая термодинамика Основные понятия и
- 50. * 2. Химическая термодинамика Основные понятия и
- 51. * 2. Химическая термодинамика Основные понятия и
- 52. Термодинамические процессы www.lcr.tsu.ru *
- 53. * Если в т/д системе изменяется хотя
- 54. * 2. Химическая термодинамика Основные понятия и
- 55. а) Уменьшаем массу и число груза б)
- 56. В пределе когда грузы бесконечно малы,
- 57. ДОПОЛНЕНИЕ *
- 58. 2. Химическая термодинамика Основные понятия и
- 59. ДОПОЛНЕНИЕ www.tpu.ru *
- 60. ДОПОЛНЕНИЕ * www.tpu.ru
- 61. Постулат о равновесии www.lcr.tsu.ru *
- 62. * 3. Химическая термодинамика Постулат о равновесии
- 63. * Основной постулат термодинамики (первое исходное положение):
- 64. Постулат о температуре (Нулевой
- 65. * 4. Химическая термодинамика Постулат о температуре
- 66. Температура – это свойство, которое указывает, будут
Слайд 2Общий план работы в семестре
Лекции – 60 час.
Лабораторные занятия – 68
Практические занятия – 34 час.
К.х.н., доцент О.В. Магаев
*
Слайд 3Физическая химиия
Физическая химия – наука о применении теоретических и экспериментальных методов
Физическая химия изучает химические свойства веществ на основе физических свойств составляющих их атомов и молекул
«Физическая химия – наука, которая должна на основании положений и опытов физических объяснить причину того, что происходит через химические операции в сложных телах»
М.В. Ломоносов
(1752 г.)
*
Слайд 4Рекомендуемая литература (основная)
1. Попова А.А., Попова Т.Б. Физическая химия. Учебное пособие.
Касаткина И.В., Прохорова Т.М., Федоренко Е.В. Физическая химия. Учебное пособие. М.: РИОР, 2013. – 256 с.
2. Коган В.А., Луков В.В. Физическая химия. Ростов: Издательство Ростовского университета, 2011. - 254 с.
3. Горшков В.И., Кузнецов И.А. Основы физической химии. М.: БИНОМ. Лаборатория знаний, 2014. – 408 с.
4. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Физическая химия. Т1., Т2. М.: БИНОМ. Лаборатория знаний. 2013. – 584 с.
5. Беляев А.П. Физическая и коллоидная химия. практикум обработки экспериментальных результатов. Учебное пособие. М.: ГЭОТАР-Медия, 2015. – 112 с.
6. Основы физической химии: учебное пособие: в 2 ч. Теория и задачи / В.В.Еремин [и др.]. 2-е изд. перераб. и доп. М.: БИНОМ. Лаборатория знаний. 2013. – 493 с.: ил. (Учебник для высшей школы)
7. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 1999. – 528 с.
Физическая химия / под ред. Краснова К.С. М.: Высшая школа, 1998. кн.1 и 2. – 512 с. и 319с.
Курс физической химии / под ред. Герасимова Я.И. М.: Химия, 1970. Т.1. – 502 с. и 1973. Т.2. – 623 с.
*
Слайд 51. Романовский Б.В. Основы химической кинетики. М.: «Экзамен». 2006. – 415
2. Эткинс П., де Паула Дж. Физическая химия. М.: Мир, 2007. Т.1. –494 с.
3. Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. М.: Химия. КолосС, 2008. – 672 с.
4. Бирон Е.В. О взаимодействии веществ в растворе. М.: Книга по требованию. 2012. – 18 с.
5. Вальден П.И. Теория растворов в их исторической последовательности. М.: Книга по требованию. 2012. – 202 с.
6. Лукомский Ю.Я., Гамбург Ю.Д. Физико-химические основы электрохимии. Долгопрудный: Издат. дом «Интеллект», 2008. – 424 с.
7. Байрамов В.М. Основы химической кинетики и катализа. М.: Издательский центр «Академия», 2003. – 256 с.
8. Ягодовский В.Д. Статистическая термодинамика в физической химии. М: Бином. Лаборатория знаний, 2005. – 490 с.
9. Полторак О.М. Термодинамика в физической химии. М.: Высшая школа, т.2, 1991. – 319 с.
10. Еремин Е.Н. Основы кинетики химических реакций. М.: Высшая школа, 1976. – 541с.
*
Рекомендуемая литература (дополнительная)
Слайд 611. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. М.: Высшая школа,
12. Даниэль Ф., Олберти Р. Физическая химия. М.: Мир, 1978. – 645 с.
Мелвин-Хьюз Э.А. Физическая химия. М.: ИЛ, 1962 г., Кн.1 и 2. – 519 с. и 623 с.
13. Эмануэль Н.М., Кнорре Г.Д. Курс химической кинетики. М.: Высшая школа, 1984. – 590 с.
14. Эйринг Г., Лин С.М. Основы химической кинетики. М.: 1983. – 528 с.
15. Розовский А.Я. Гетерогенные химические реакции. Кинетика и макрокинетика. М.: Наука, 1980. – 323 с.
16. Розовский А.Я. Кинетика топохимических реакций. М.: Мир, 1988. – 311 с.
17. Дельмон Б. Кинетика гетерогенных реакций. М.: Химия, 1972. – 554 с.
18. Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. М.: Высшая школа, 1975. – 416 с.
19. Практикум по физической химии / Под редакцией профессора Е.П. Агеева, академика 20Лунин В.В., М.: «Академия». 2010. – 219 с.
21. ЕреминВ.В. , Каргов С.И. , Успенская И.А., Кузьменко Н.Е. , Лунин В.В., . Задачи по физической химии. М.: «Экзамен». 2002. – 318 с.
Рекомендуемая литература (дополнительная)
*
Слайд 8Историческое развитие
Период 1940 – 2012 Г.К. Боресков, Л.Онзагер, П.Флори, Дж. Натта,
Конец XIX века – ряд крупнейших открытий в области физико-химических явлений
Начало XX века – физическая химия определена как наука
*
Слайд 9Историческое развитие
К. Шееле (Швеция - 1773), Фόнтан (Франция - 1777) –
Т.Е. Ловиц (Россия - 1785) – адсорбция из растворов;
Лавуазье, Лаплас (Франция – 1779/1784) – изучение теплоемкости веществ
тепловые эффекты реакций;
Г. Дэви (Англия - 1825), Л. Тенар (Франция - 1830) – открытие каталитических
реакций;
Гальвани, Вольт (Италия - 1799) – гальванический элемент, основы
электрохимии;
М.В. Ломоносов (Россия - 1750) - описание химии через
физико-математический аппарат
И. Берцелиус (Швеция - 1835) – развитие основ катализа;
*
Слайд 10Историческое развитие
Д. Дальтон (Англия 1801-1803), Л. Гей-Люссак (Франция - 1802),
А. Авагадро
атомистических представлений;
В.В. Петров (Россия - 1802) – открытие явления электрической дуги;
Г. Дэви (Англия – 1800-1834) – электрохимическая теория взаимодействия
веществ;
Г.И. Гесс (Россия - 1820) – работы по термохимии;
Д. Гиббс (США – 1873-1878) – термодинамическое учение о
химическом равновесии;
М. Фарадей (Англия -1833-1834) – количественные законы электролиза;
Б.С. Якоби (Россия - 1836) – гальванопластика;
*
Слайд 11Историческое развитие
С. Аррениус (Швеция – 1883-1887) – теория электролитической диссоциации;
И. Гитторф,
Д.И. Менделеев (Россия – 1834-1907) – открытие существования критической температуры, химическая теория растворов (1887), вывод уравнения состояния газов (1874);
Д.П. Коновалов (Россия – 1889) – теория растворов;
Ле Шателье (Франция - 1884) – общий принцип смещения равновесия при изменении внешних условий;
Я. Вант-Гофф (Голландия – 1885-1889) термодинамическая теория химического равновесия, теория разбавленных растворов
*
Слайд 13Предмет и задачи физической химии
Объектами изучения физической химии являются любые системы,
Основная задача физической химии – изучить и объяснить закономерности протекания химических процессов, определить скорость химического процесса во времени, определить их направленность, изучить влияние на них среды, примесей, а также условия получения максимального выхода продуктов.
*
Слайд 14При решении задач физической химии используются 2-а основных метода теоретической физики:
Термодинамический
Метод МКТ – определение свойств систем (газы, кристаллы, твердые вещества)
Предмет и задачи физической химии
*
Слайд 15ОСНОВНЫЕ РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИ
ТЕРМОДИНАМИКА – изучает вопросы энергетики химических процессов, определяет
СТАТИСТИЧЕСКАЯ МЕХАНИКА – изучает свойства и поведение макроскопических физических тел, состоящих из большого числа частиц (атомов, молекул, ионов, электронов и др.) К таким телам или системам относятся газы, жидкости, твердые тела, плазма, полимеры
КВАНТОВАЯ ХИМИЯ – раздел теоретической химии, в котором строение и свойства химических соединений, их взаимодействия и превращения в химических реакциях рассматриваются на основе представлений и с помощью методов квантовой механики.
КИНЕТИКА – изучает механизмы химических превращений и влияние на них и на скорость превращения внутренних и внешних параметров
*
Слайд 16СОДЕРЖАНИЕ КУРСА:
Строение вещества
(учение о строении атомов, молекул, агрегатных состояниях вещества, включая
Химическая термодинамика
(энергетические эффекты в химических процессах; возможность, направление и глубина протекания, химического процесса)
Учение о растворах (теория растворов)
(процессы образования растворов, их внутренняя структура и важнейшие свойства в зависимости от природы компонентов раствора)
Химическая кинетика
(скорость и механизм протекания химических процессов в различных средах при различных условиях)
Электрохимия
(свойства растворов электролитов; явления электропроводности, электролиза, коррозии; работа
гальванических элементов)
Коллоидная химия
(поверхностные явления; свойства мелкодисперсных гетерогенных систем)
*
Слайд 18Термодинамика – часть теоретической физики изучающая макроскопические тела и изменение их
Основатель ТЕРМОДИНАМИКИ – Сади Карно
(Франция – 1796-1832).
Термин ТЕРМОДИНАМИКА определен Томсоном (Англия - 1854).
2. Химическая термодинамика
Основные понятия
*
Слайд 19
Химическая термодинамика – раздел физической химии, в котором термодинамические методы применяются
Изучение тепловых эффектов, сопровождающих химические реакции – термохимия
Определение возможности самопроизвольного течения процесса, а также условия положения равновесия и его смещения под влиянием изменения внешних условий
Свойства веществ в растворах
2. Химическая термодинамика
Основные понятия
*
Слайд 20Анализ физических явлений и установление соотношений между различными свойствами веществ в
Метод Циклов – применение закономерностей термодинамики к воображаемым циклам;
Метод Потенциалов (Гиббс) – получение необходимых соотношений используя основные уравнения термодинамики
2. Химическая термодинамика
Основные понятия
*
Слайд 21Особенности термодинамики:
Универсальность термодинамического аппарата (т/д аппарат основан на законах и закономерностях
Термодинамика – феноменологическая наука (макрофизический уровень рассмотрения системы, вещество-среда с макропараметрами описывающими состояние системы P, V, T);
В т/д отсутствует понятие «ВРЕМЯ», т.е все процессы протекают независимо от времени и пространства.
Термодинамика органична (не прибегая к данным опыта можно получить информацию о свойствах изучаемых систем);
2. Химическая термодинамика
Основные понятия
*
Слайд 22Общая классификация термодинамики
I. По характеру используемых параметров системы:
макроскопические/микроскопические
II. По типу процессов:
III. По типу явлений, к которым применима термодинамика
2. Химическая термодинамика
Основные понятия
*
Слайд 24
Задачи химической термодинамики:
• Получение термодинамических данных для новых соединений;
• Изучение стабильности
• Предсказание направления химической реакции;
• Расчет состава реакционной смеси и выхода химических реакций;
• Изучение возможности получение энергии из химических реакций в виде теплоты и работы;
• Применение термодинамических подходов в химической кинетике.
2. Химическая термодинамика
Основные понятия
*
Слайд 25
2. Химическая термодинамика
Основные понятия
Для химической реакции термодинамика позволяет рассчитать конечный результат
Термодинамика основывается на двух постулатах (исходных положениях) и трех законах:
Основной постулат термодинамики (постулат о равновесии)
Нулевой закон термодинамики (второе исходное положение), нулевое (общее) начало термодинамики, постулат о существовании температуры
Первый закон (первое начало) термодинамики или закон сохранения энергии
Второй закон (второе начало) термодинамики
Третий закон (третье начало) термодинамики или закон Нернста
Слайд 262. Химическая термодинамика
Основные понятия и определения
Состояние системы характеризуется совокупностью всех её
Эти свойства системы связаны уравнением состояния и другими уравнениями, поэтому, для однозначной характеристики состояния системы достаточно знать не все свойства, а лишь некоторые из них.
Эти свойства выбирают в качестве независимых переменных и называют параметрами состояния.
Т/Д параметры – свойства системы, которые однозначно определяют состояние системы (V, m, S, Cp).
Независимые переменные фиксированы условиями существования системы и не могут изменяться в пределах рассматриваемой задачи.
Количество параметров, необходимое для определения состояния системы, зависит от степени её сложности. Например, для газа в качестве параметров состояния могут быть выбраны любые два из трёх: давление, объём и температура.
*
Слайд 27Термодинамические параметры (состояния) или свойства:
Внешние параметры: определяются свойствами и координатами тела
Внутренние параметры: зависят только от свойств самой системы (например, плотность, внутренняя энергия); их число не ограничено
Экстенсивные параметры (выражают количественные характеристики системы) – их численное значение для системы постоянного химического состава пропорционально массе системы (V, m, e, U, S, G, F, H, теплоемкость(C)). Обладают аддитивностью. (additivus — прибавляемый, т.е. любое экстенсивное свойство системы равно сумме соответствующих свойств её частей).
Интенсивные параметры (выражают качественные характеристики системы) – их численное значение для системы постоянного химического состава не зависит от массы системы (Т, плотность (p), P, поверхностное натяжение, концентрация, Vm, электрический потенциал). Не обладают аддитивностью.
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 28
Если одну экстенсивную Т/Д величину (Y1) отнести к единице другой экстенсивной
Y1/Y2 = X
По определению:
на единицу объема плотности (плотность)
на единицу массы удельные величины (Удельный объем)
на единицу кол-ва вещества мольные величины (Молярный объем)
Экстенсивные величины – аддитивны (Y1+Y2+Y3+…+Yn)=Yсист.
Интенсивные величины аддитивностью не обладают!
ДОПОЛНЕНИЕ
*
Слайд 29
Аддитивная физическая величина — физическая величина, разные значения которой могут быть
Неаддитивная физическая величина — физическая величина, для которой суммирование, умножение на числовой коэффициент или деление друг на друга её значений не имеет физического смысла. Например, физическая величина температура - неаддитивная физическая величина.
ДОПОЛНЕНИЕ
*
Слайд 30
Обобщенные силы – P, А мех, φ, μ, σ (поверхностное двумерное
Обобщенные координаты – геометрическая координата
l, объем V, заряд e, mi- масса i – ого компонента.
При этом обобщенная работа имеет вид:
dAмех= Fdl – есть произведение двух величин – обобщенных сил на изменение координат
dAмех= Fdl=pdV
dAхим= Σ μdni
dAэл= φde
dAпов= σdΩ
ДОПОЛНЕНИЕ
*
Слайд 31Система (т/д - система) – тело или совокупность тел, выделенных из
2. Химическая термодинамика
Основные понятия и определения
Объект изучения термодинамики – макроскопическая система
Окружающая среда
Граница
СИСТЕМА
*
Слайд 32открытая
закрытая
изолированная
http://www.nscience.ru/
2. Химическая термодинамика
Основные понятия и определения
Примеры:
открытые системы — люди, животные, растения,
закрытые системы — герметично упакованные продукты (бутылки с газированной водой, любая система, ограниченная физической границей раздела (емкость));
изолированные системы, такие системы в природе практически не встречаются, однако, к ним можно с небольшим допущением отнести термос (сосуд Дьюара), кабина космического корабля.
Слайд 33«ЧАСТИЧНО ОТКРЫТЫЕ» СИСТЕМЫ
Адиабатическая сисмтеа – система с отсутствием теплообмена с
Диатермическая система – система с отсутствием массообмена, но с осуществлением теплообмена.
Передача энергией между системой и внешней средой может осуществляться двумя путями: Q – теплота; A (W) – работа.
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 34По «структурообразованию» системы:
Гомогенная система – система между отдельными частями которой
Примеры: смеси газов (воздух), смесь нефтепродуктов, оптическое стекло, истинные растворы.
Гетерогенная система – система состоящая из отдельных частей (двух и более фаз), разграниченных поверхностями раздела. При переходе через поверхность раздела, хотя бы одно свойство меняется скачкообразно. Примеры: сплавы, насыщенный пар, смеси органических неполярных веществ с водой.
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 352. Химическая термодинамика
Основные понятия и определения
Простая система – система, состоящая из
Пример: вода - насыщенный пар, тающий лёд
Сложная система – система, состоящая из нескольких веществ.
Пример: воздух, раствор поваренной соли, сплавы.
*
Слайд 36Термодинамическая фаза - однородная по составу и свойствам часть термодинамической системы, отделенная
Иначе: Фаза — гомогенная часть гетерогенной системы. В однокомпонентной системе разные фазы могут быть представлены различными агрегатными состояниями или разными полиморфными модификациями вещества. В многокомпонентной системе фазы могут иметь различный состав и структуру.
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела.
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 37Макроскопическая часть среды (вещества), имеющая однородный физико-химический состав, называется фазой.
Термодинамика дает
Пример: твердое, жидкое, газообразное агрегатные состояния, парамагнитное и магнитоупорядоченные состояния магнетика, состояния одного и того же вещества с различным типом кристаллической структуры и т. д.
2. Химическая термодинамика
Основные понятия и определения
Слайд 38Набор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний, т.е.
Набор термодинамических фаз связан с различными вариантами порядка, которые допускаются в том или ином агрегатном состоянии. Порядок - упорядоченное в пространстве расположение объектов, часто атомов или молекул. Более точно, порядок — это состояние системы, с достаточной степенью точности инвариантное относительно некоторых определённых сдвигов в пространстве.
Газообразное состояние в-ва не обладает никаким порядком. Соответственно, в газообразном состоянии любое вещество обладает только одной термодинамической фазой.
Жидкость обладает ориентационным порядком. В результате у одной и той же жидкости могут быть разные термодинамические фазы, однако количество их редко превышает единицу. Так, например, существование новой жидкой фазы обнаружено в переохлаждённой воде. Другой, специфический, пример: сверхтекучее состояние в жидком гелии.
Кристаллическое твёрдое тело обладает как трансляционным, так и ориентационным порядком. В результате возникает большое число возможных вариантов ориентации соседних молекул друг относительно друга. В результате твёрдые тела обладают, как правило, достаточно сложной фазовой диаграммой. Например, фазовая диаграмма льда, насчитывает порядка 12 термодинамических фаз, реализующихся при различных температурах и давлениях.
ДОПОЛНЕНИЕ
*
Слайд 39
Состояние системы – совокупность всех физических и химических свойств системы.
2. Химическая
*
Слайд 40*
2. Химическая термодинамика
Основные понятия и определения
Параметры состояния (термодинамические переменные) – макроскопические
p – давление
T – температура
V – объем
n - количество вещества
Слайд 41*
2. Химическая термодинамика
Уравнение состояния
Параметры системы связаны между собой уравнением состояния
Уравнение состояния
f(a,b,T)=0 или a=a(b,T)
a – совокупность внутренних параметров
b – совокупность внешних параметров
T – температура
Слайд 42*
2. Химическая термодинамика
Уравнение состояния
Термическое уравнение состояния:
p=p(V,n,T)
p (давление) – внутренний параметр
V (объем)
Калорическое уравнение состояния:
U=U(V,n,T)
U (энергия) – внутренний параметр
V (объем) – внешний параметр
Если известны термическое и калорическое уравнения состояния, то можно определить все термодинамические свойства системы, т.е. получить ее полное описание
Слайд 43Термические коэффициенты
Уравнение состояния в диф. форме
коэф. термического расширения
коэф. возрастания давления
коэф. изотермического
Уравнение состояния через термич. коэф.
2. Химическая термодинамика
Уравнение состояния
*
Слайд 44*
2. Химическая термодинамика
Уравнение состояния
Термическое уравнение состояния:
p=p(V,n,T)
p (давление) – внутренний параметр
V (объем)
Калорическое уравнение состояния:
U=U(V,n,T)
U (энергия) – внутренний параметр
V (объем) – внешний параметр
Если известны термическое и калорическое уравнения состояния, то можно определить все термодинамические свойства системы, т.е. получить ее полное описание
Слайд 46*
2. Химическая термодинамика
Уравнение состояния
Уравнения состояния реального газа
Уравнение Ван-дер Ваальса
Уравнение Бертло
Уравнение Дитеричи
первое уравнение второе уравнение
Вириальное уравнение состояния
В2, В3, … - второй, третий и т.д. вириальные коэффициенты, зависят от природы газа и температуры. В1=1
Слайд 48Набор интенсивных термодинамических параметров определяет состояние системы.
Для характеристики термодинамической системы необходимо,
Состояния термодинамических систем:
Равновесное
Неравновесное (неустойчивое, лабильное)
Стационарное
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 49*
2. Химическая термодинамика
Основные понятия и определения
Равновесное состояние – такое состояние системы,
В равновесном состоянии не может быть таких явлений как диффузия, фазовые превращения и т.п.
Механическое равновесие означает равенство давления внутри системы и внешнего давления.
Тепловое равновесие означает равенство температуры во всех частях системы и в окружающей среде.
Химическое равновесие – термодинамическое равновесие в системе, между компонентами которой происходят химические реакции. Параметры состояния системы при химическом равновесии не зависят от времени; состав такой системы называется равновесным.
Необходимым условием для того, чтобы процесс был равновесным, является равенство интенсивных параметров, действующих на систему со стороны окружающей среды и со стороны системы на окружающую среду.
Слайд 50*
2. Химическая термодинамика
Основные понятия и определения
Стационарное состояние - такое состояние системы,
Если на границе системы со стороны окружающей среды поддерживаются одинаковые значения интенсивных параметров, то система с течением времени обязательно придет в состояние равновесия.
Если значения интенсивных параметров неодинаковы, то система придет в стационарное состояние.
Слайд 51*
2. Химическая термодинамика
Основные понятия и определения
Неравновесное состояние – состояние , при
Пример: система с различной температурой в разных точках. Если такую систему изолировать, то температура во всех точках системы постепенно выровняется, т.е. система придёт в равновесное состояние.
Слайд 53*
Если в т/д системе изменяется хотя бы один параметр, это означает,
2. Химическая термодинамика
Основные понятия и определения
Слайд 54*
2. Химическая термодинамика
Основные понятия и определения
Термодинамический процесс – последовательность состояний системы,
Самопроизвольные процессы – для их осуществления не надо затрачивать энергию
Несамопроизвольные процессы – происходят только при затрате энергии
Обратимые процессы – процессы, в которых переход системы из одного состояния в другое и обратно может происходить через последовательность одних и тех же состояний, и после возвращения в исходное состояние в окружающей среде не остается макроскопических изменений
Необратимые (неравновесные) процессы – процессы, в результате которых невозможно возвратить систему в первоначальное состояние
Слайд 55а) Уменьшаем массу и число груза
б) Уменьшаем массу и число груза
в) Уменьшаем массу и число груза в десятки тысяч раз
в
A21> A12
A21≥ A12
2. Химическая термодинамика
Основные понятия и определения
*
а
б
Слайд 56
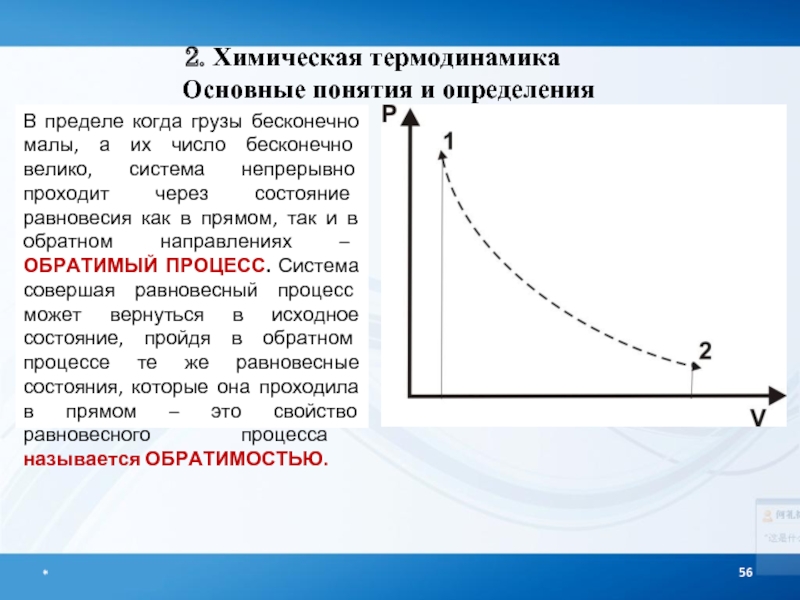
В пределе когда грузы бесконечно малы, а их число бесконечно велико,
2. Химическая термодинамика
Основные понятия и определения
*
Слайд 58
2. Химическая термодинамика
Основные понятия и определения
*
Т/д процесс, при котором система проходит
Обратимость предполагает возвращение системы в первоначальное состояние без изменения в окружающей среде.
Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает РАВНОВЕСНО!
Скорость установления равновесия должна быть больше скорости рассматриваемого процесса
Слайд 62*
3. Химическая термодинамика
Постулат о равновесии
Основной постулат термодинамики
(первое исходное положение):
Любая изолированная система
Термодинамическое равновесие — предельное состояние, к которому стремится термодинамическая система, изолированная от внешних воздействий, то есть в каждой точке системы устанавливается термическое, механическое и химическое равновесие, происходит выравнивание температуры и давления, и все возможные химические реакции достигают состояния, когда в каждом элементарном химическом процессе скорость прямой реакции равна скорости обратной.
Слайд 63*
Основной постулат термодинамики
(первое исходное положение):
Иначе, любая макроскопическая система находящаяся в постоянных
Время необходимое для достижения равновесия называется временем РЕЛАКСАЦИИ.
Релаксация – самопроизвольный переход системы из неравновесного состояния в равновесное.
Это положение не выполняется для систем астрономического масштаба (галактик) и микроскопических систем с малым числом частиц.
3. Химическая термодинамика
Постулат о равновесии
Слайд 65*
4. Химическая термодинамика
Постулат о температуре
Нулевой закон термодинамики (второе исходное положение):
Если система
Иначе: Если 2-е системы находятся в термическом равновесии с 3-ей системой, то они находятся в термическом равновесии между собой
Нулевой закон Т/Д определяет понятие ТЕМПЕРАТУРА!
B – термометр
А, С – т/д система
Слайд 66Температура – это свойство, которое указывает, будут ли находится в состоянии
4. Химическая термодинамика
Постулат о температуре
*