- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Факторы, повышающие интенсивность химического процесса презентация
Содержание
- 1. Факторы, повышающие интенсивность химического процесса
- 2. Интенсивность химического процесса оценивается удельной производительностью, под
- 3. Уравнение скорости процесса в самом общем виде
- 4. Константа скорости процесса. Влияние температуры.
- 5. Константа скорости процесса является сложной величиной, зависящей
- 6. Рассмотрим более подробно влияние температуры на скорость химического процесса
- 7.
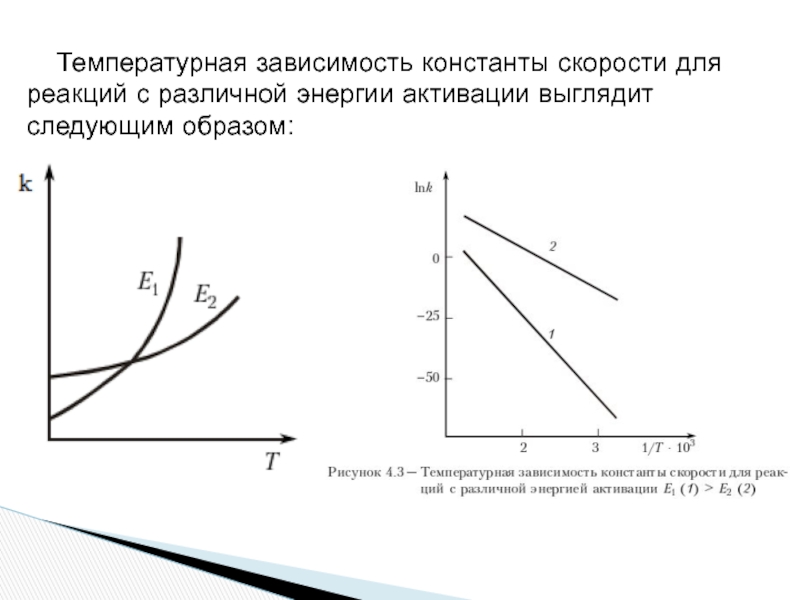
- 8. Температурная зависимость константы скорости для реакций с различной энергии активации выглядит следующим образом:
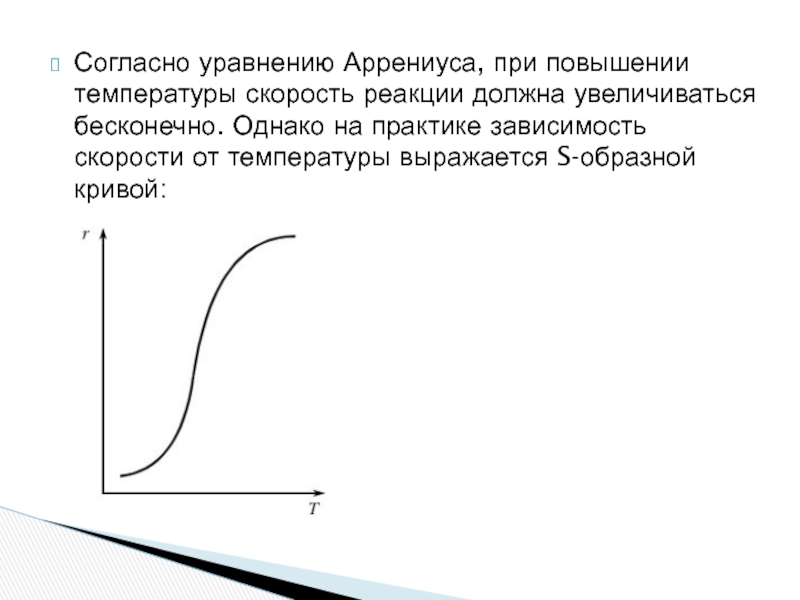
- 9. Согласно уравнению Аррениуса, при повышении температуры скорость
- 10. При очень высоких температурах реагенты расходуются
- 11.
- 12.
- 13. В процессах с диффузионным режимом для ускорения
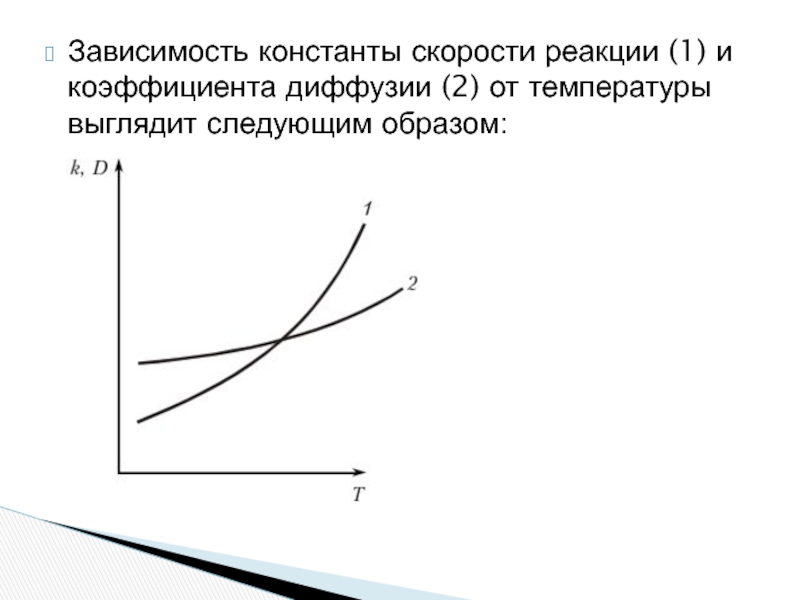
- 14. Зависимость константы скорости реакции (1) и коэффициента
- 15. Для всех обратимых экзотермических реакций с увеличением
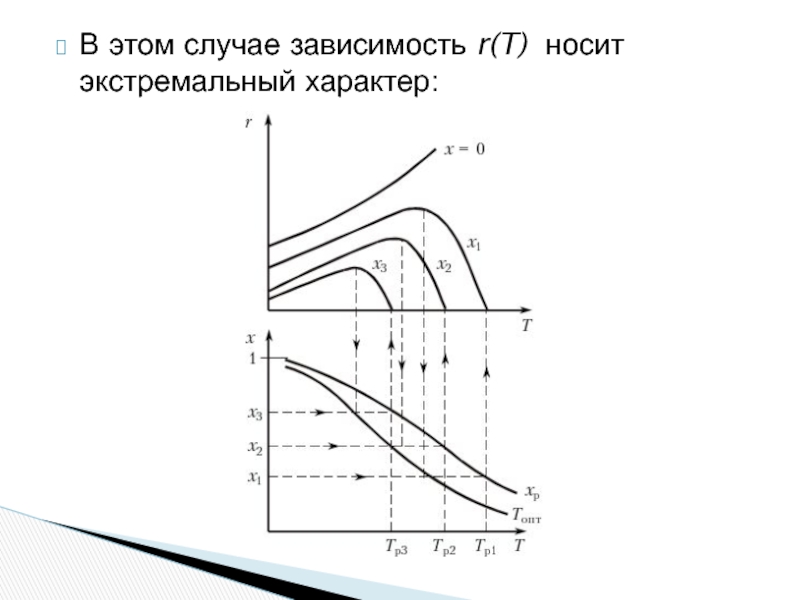
- 16. В этом случае зависимость r(T) носит экстремальный характер:
- 17. Высокая скорость процесса достигается при низкой конверсии;
- 18. Для обратимой экзотермической реакции по мере протекания
- 19. Для эндотермических процессов высокие температуры более
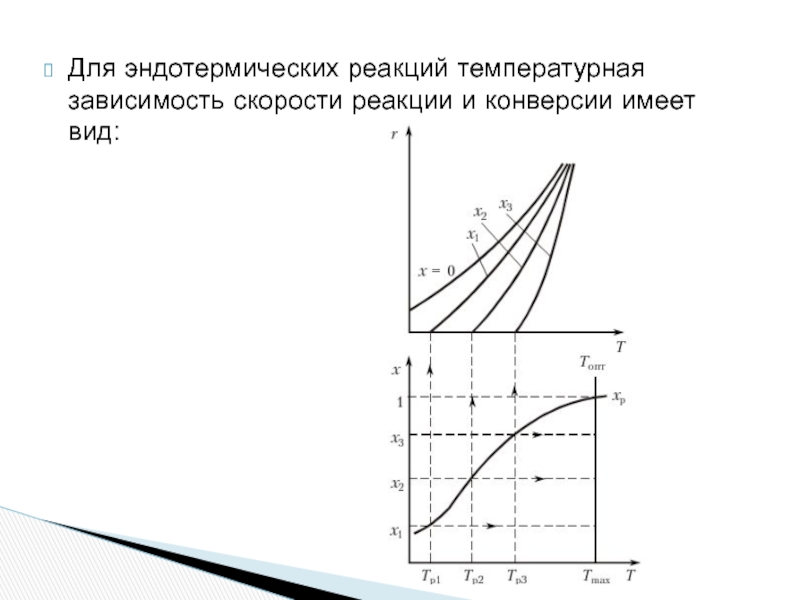
- 20. Для эндотермических реакций температурная зависимость скорости реакции и конверсии имеет вид:
- 21. В ряде процессов, особенно в технологии органических
- 22.
- 23.
- 24.
- 25. Удаление реагирующих веществ за счет десорбции из
- 26. Регулирование температуры процессов необходимо для увеличения константы
- 27. Спасибо за внимание!
Слайд 2Интенсивность химического процесса оценивается удельной производительностью, под которой понимают съём целевого
Определяющее значение имеет обеспечение максимальной скорости протекания химической реакции.
Слайд 3Уравнение скорости процесса в самом общем виде имеет вид:
W = k
k – константа скорости процесса;
ΔC – средняя движущая сила процесса;
Fуд - удельная поверхность раздела фаз.
Слайд 5Константа скорости процесса является сложной величиной, зависящей от химических свойств реагирующих
Увеличить это величину можно:
Повышая температуру;
Усилением перемешивания;
Применив катализаторы.
Слайд 8 Температурная зависимость константы скорости для реакций с различной энергии активации выглядит
Слайд 9Согласно уравнению Аррениуса, при повышении температуры скорость реакции должна увеличиваться бесконечно.
Слайд 10
При очень высоких температурах реагенты расходуются настолько быстро, что просто не
Процесс переходит в диффузионную область. Скорость процесса во многом определяется законами массообмена.
Слайд 13В процессах с диффузионным режимом для ускорения массообмена используют интенсивное перемешивание.
При снятии диффузионного торможения,
т.е. при переходе процесса в кинетическую увеличение перемешивания нецелесообразно и может привести к ухудшению гидродинамической ситуации в реакционной зоне.
Слайд 14Зависимость константы скорости реакции (1) и коэффициента диффузии (2) от температуры
Слайд 15Для всех обратимых экзотермических реакций с увеличением температуры уменьшается величина Kр
При некотором увеличении температуры кинетика вступает в противоречие с термодинамикой процесса. Несмотря на повышение скорости прямой реакции, выход ограничивается равновесием.
Влияние термодинамического фактора на скорость процесса
Слайд 17Высокая скорость процесса достигается при низкой конверсии;
Большая степень превращения достигается при
Для всех значений x существует оптимальная температура, при которой скорость процесса максимальна. Совокупность таких температур образует линию оптимальных температур Tопт(x).
Анализ графической зависимости:
Слайд 18Для обратимой экзотермической реакции по мере протекания процесса ( увеличения x)
Как интенсифицировать процесс?
Слайд 19
Для эндотермических процессов высокие температуры более благоприятны. С повышением температуры растет
Однако и в этом случае выход повышается по затухающей кривой. Беспредельное повышение температуры нецелесообразно.
Слайд 20Для эндотермических реакций температурная зависимость скорости реакции и конверсии имеет вид:
Слайд 21В ряде процессов, особенно в технологии органических веществ, повышение температуры ограничивается
Влияние температуры на селективность
Слайд 25Удаление реагирующих веществ за счет десорбции из жидкой среды;
Спекание зерен катализатора
Термостойкость материалов реакционных аппаратов;
Энергозатраты на повышение температуры.
Остальные причины, ограничивающие температуру процесса
Слайд 26Регулирование температуры процессов необходимо для увеличения константы скорости процесса k и
Оптимальные температуры процессов зависят от природы реагентов, их концентраций, требуемой конверсии, давления, поверхности соприкосновения фаз и интенсивности их перемешивания, от активности катализаторов.
Заключение