- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Элементы физической кинетики презентация
Содержание
- 1. Элементы физической кинетики
- 2. МОЛЕКУЛЯРНАЯ ФИЗИКА ТЕРМОДИНАМИКА Т П У Сегодня *
- 3. Тема 3. ЭЛЕМЕНТЫ ФИЗИЧЕСКОЙ КИНЕТИКИ 3.1. Явления
- 4. Под идеальным газом мы
- 5. 1.3. Температура и средняя кинетическая энергия теплового
- 6. Именно средняя кинетическая энергия атомов и
- 7. Чтобы связать энергию с температурой,
- 8. Величину T называют абсолютной темпе-ратурой и измеряют
- 9. Тогда следовательно,
- 10. Так как температура определяется средней
- 11. Основное уравнение молекулярно-кинетической теории можно записать по
- 12. В физике и технике за абсолютную шкалу
- 13. 3.1. Явления переноса в газах
- 14. Рассмотрим некоторые явления, происходящие в газах. Распространение
- 15. Связанный с этим движением перенос вещества обусловлен
- 16. Если какое либо тело движется в
- 17. Это явление носит название внутреннее трение или
- 18. Если в соседних слоях газа создана и
- 19. называется теплопроводностью. Поток тепла пропорционален градиенту
- 20. В состоянии равновесия в среде, содержащей заряженные
- 21. Связанный с этим движением перенос электрического заряда
- 22. В процессе диффузии, при тепло и
- 23. 3.2. Число столкновений и средняя длина свободного
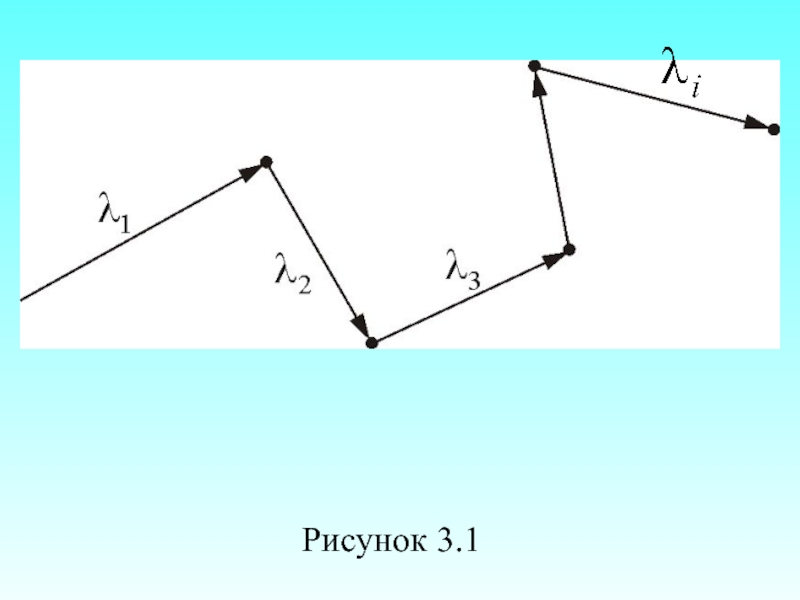
- 24. Расстояние, проходимое молекулой в среднем без столкновений,
- 25. Рисунок 3.1
- 26. Модель идеального газа – твёрдые шарики одного
- 27. Рисунок 3.2 – эффективное
- 28. За одну секунду молекула проходит путь, равный
- 29. Подсчитаем число столкновений ν. Вероятность столкновения трех
- 30. Рисунок 3.3 Путь, который пройдет молекула за
- 31. На самом деле, все молекулы движутся (и
- 32. Из уравнения состояния
- 33. Таким образом, при заданной
- 34. 3.3. Диффузия газов
- 35. Диффузия имеет место в
- 36. Обозначим:
- 37. Из уравнения Фика видно, что диффузионный поток,
- 38. Молекулы участвуют в тепловом движении, они будут
- 39. Сила, действующая на единицу
- 40. Физический смысл коэффициента вязкости η в том,
- 41. 3.5. Теплопроводность газов Учение о теплопроводности
- 42. или
- 43. υТ – тепловая скорость молекул;
- 44. 3.6. Уравнения и коэффициенты переноса Сопоставим уравнения
- 45. или
- 46. или
- 47. Все эти законы были установлены опытно, задолго
- 48. Однако к концу XIX века, несмотря на
- 49. Но это конечно не так. Все выше
- 50. Зависимость коэффициентов переноса от давления Р
- 51. С ростом давления λ уменьшается и затрудняется
- 52. Рисунок 3.7 На рисунке 3.7 показаны зависимости
- 53. Молекулярное течение. Эффузия газов
- 54. В вакууме происходит передача импульса
- 55. Как при молекулярном течении, так и при
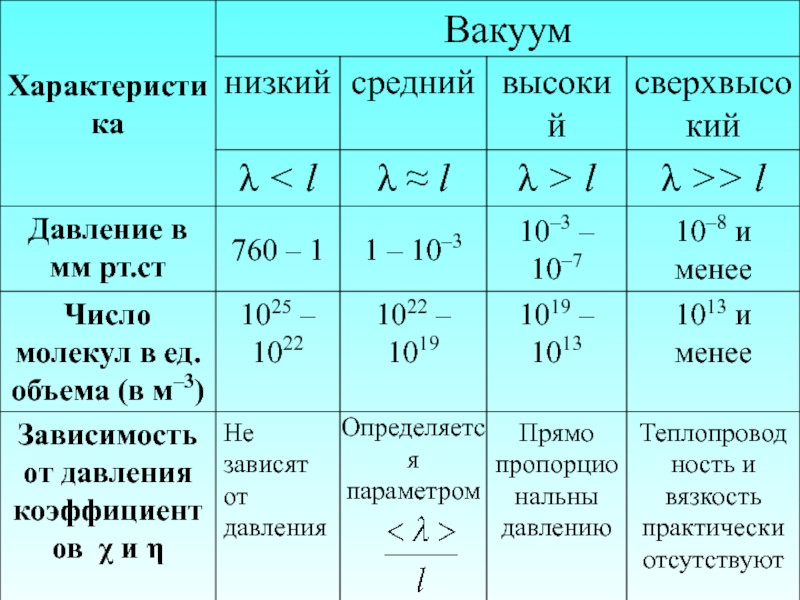
- 56. 3.7. Понятие о вакууме Газ
- 57. Плотный воздух Разряженный воздух
- 58. Свойства разряженных газов отличаются от свойств неразряженных
- 59. Определяется параметром
- 60. Если из сосуда откачивать газ, то по
- 61. Вопросы создания вакуума имеют большое значение в
Слайд 3Тема 3. ЭЛЕМЕНТЫ ФИЗИЧЕСКОЙ КИНЕТИКИ
3.1. Явления переноса в газах
3.2. Число столкновений
3.3. Диффузия газов
3.4. Внутреннее трение. Вязкость газов
3.5. Теплопроводность газов
3.6. Коэффициенты переноса и их зависимость от давления
3.7. Понятие о вакууме
Слайд 4 Под идеальным газом мы будем понимать газ, для
Слайд 51.3. Температура и средняя кинетическая энергия теплового движения молекул
Раньше, во времена Ломоносова и Лавуазье считали, что носителем тепла является некоторая жидкость – теплород.
На самом деле – ничего не переходит, только изменяется средняя кинетическая энергия – энергия движения молекул, из которых состоят эти тела.
Слайд 6 Именно средняя кинетическая энергия атомов и молекул служит характеристикой системы
Слайд 7 Чтобы связать энергию с температурой, Больцман ввел коэффициент пропор-
Слайд 8 Величину T называют абсолютной темпе-ратурой и измеряют в градусах Кельвина (К).
Слайд 10 Так как температура определяется средней энергией движения молекул, то
Слайд 11 Основное уравнение молекулярно-кинетической теории можно записать по другому. Так как Отсюда В
Слайд 12 В физике и технике за абсолютную шкалу температур принята шкала Кельвина,
Слайд 133.1. Явления переноса в газах
Из прошлых лекций мы
Слайд 14 Рассмотрим некоторые явления, происходящие в газах. Распространение молекул примеси в газе от
Слайд 15 Связанный с этим движением перенос вещества обусловлен диффузией. Диффузионный поток будет
Слайд 16 Если какое либо тело движется в газе, то оно сталкивается
Слайд 17 Это явление носит название внутреннее трение или вязкость газа, причём сила
Слайд 18 Если в соседних слоях газа создана и поддерживается разность температур, то
Слайд 19 называется теплопроводностью.
Поток тепла пропорционален градиенту температуры:
(3.1.2)
Перенос энергии от более нагретых
Слайд 20 В состоянии равновесия в среде, содержащей заряженные частицы, потенциал электрического поля
Слайд 21 Связанный с этим движением перенос электрического заряда называется электропроводностью, а само
Слайд 22 В процессе диффузии, при тепло и электропроводности происходит перенос вещества, а
Слайд 233.2. Число столкновений и средняя длина свободного
пробега молекул в газах
Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», − при относительно высокой скорости теплового движения молекул ( ) объясняется столкновениями молекул.
Слайд 24 Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного
Слайд 26 Модель идеального газа – твёрдые шарики одного диаметра, взаимодействую-щие между собой
Слайд 27Рисунок 3.2
– эффективное
сечение молекулы
проникнуть центр любой другой молекулы.
Слайд 28 За одну секунду молекула проходит путь, равный средней арифметической скорости
Слайд 29 Подсчитаем число столкновений ν. Вероятность столкновения трех и более молекул бесконечно мала. Предположим,
Слайд 30Рисунок 3.3
Путь, который пройдет молекула за одну секунду, равен длине цилиндра
- объём цилиндра
n - число молекул в единице объёма
среднее число столкнове-
ний в одну секунду:
Слайд 31 На самом деле, все молекулы движутся (и в сторону и навстречу
По закону сложения случайных величин:
Так как - средняя длина свободного пробега
Тогда:
Слайд 32 Из уравнения состояния идеального газа выразим n
Слайд 33 Таким образом, при заданной температуре, средняя длина свободного
Слайд 343.3. Диффузия газов
Диффузия от латинского
Диффузия происходит в направлении уменьшения концентрации вещества и ведет к его равномерному распределению по занимаемому объему.
Слайд 35 Диффузия имеет место в газах, жидкостях и твердых
Слайд 36Обозначим:
Слайд 37 Из уравнения Фика видно, что диффузионный поток, направлен в сторону уменьшения
Слайд 38 Молекулы участвуют в тепловом движении, они будут переходить из слоя в
Слайд 39 Сила, действующая на единицу площади поверхности, разделяющей два
Слайд 40 Физический смысл коэффициента вязкости η в том, что он численно равен
Слайд 413.5. Теплопроводность газов
Учение о теплопроводности начало развиваться в XVIII в.
Слайд 42 или
Слайд 43 υТ – тепловая скорость молекул;
Слайд 443.6. Уравнения и коэффициенты переноса
Сопоставим уравнения переноса
Уравнение Фика для диффузии.
Коэффициент диффузии
Слайд 47 Все эти законы были установлены опытно, задолго до обоснования молекулярно-кинетической теорией.
Слайд 48 Однако к концу XIX века, несмотря на блестящие успехи молекулярно-кинетической теории
Слайд 49 Но это конечно не так. Все выше указанные коэффициенты связаны между
Слайд 50Зависимость коэффициентов переноса от давления Р
Так как скорость теплового
При обычных давлениях и в разряженных газах
в высоком вакууме D = const.
Слайд 51 С ростом давления λ уменьшается и затрудняется диффузия (
Слайд 52Рисунок 3.7
На рисунке 3.7 показаны зависимости коэффициентов переноса и λ от
Слайд 53Молекулярное течение. Эффузия газов
Молекулярное течение –
Течение газа в условиях вакуума через отверстие (под действием разности давлений) называется эффузией газа.
Слайд 54 В вакууме происходит передача импульса непосредственно стенкам сосуда, то
Слайд 55 Как при молекулярном течении, так и при эффузии, количество протекающего в
Слайд 563.7. Понятие о вакууме
Газ называется разреженным, если его плотность
Такое состояние газа называется вакуумом.
Различают следующие степени вакуума: сверхвысокий ( ),
высокий ( ),
средний ( ) и низкий вакуум.