- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электрохимические методы контроля качества презентация
Содержание
- 1. Электрохимические методы контроля качества
- 2. Науменко Н.В. Они основаны на зависимости между
- 3. Науменко Н.В. Кондуктометрический метод основан на измерении
- 4. Науменко Н.В. На этом основан прямой кондуктометрический
- 5. Науменко Н.В. Если в сосуд с раствором
- 6. Науменко Н.В. Большое значение имеет кондуктометрическое титрование
- 7. Науменко Н.В. При кондуктометрическом анализе электропроводность растворов
- 8. Науменко Н.В. Ионы в растворе находятся в
- 9. Науменко Н.В. Чем больше ионов участвует в
- 10. Науменко Н.В. Сосуд для измерения электропроводности раствора
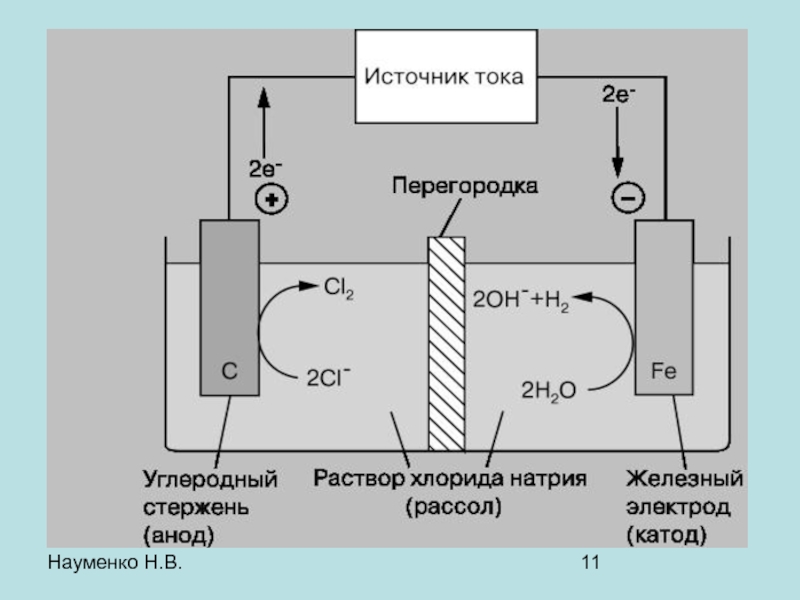
- 11. Науменко Н.В.
- 12. Науменко Н.В. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА Потенциометрический метод
- 13. Науменко Н.В. Главное достоинство потенциометрического метода –
- 14. Науменко Н.В. При исследовании потребительских товаров потенциометрический
- 15. Науменко Н.В. измерительного (высокоомный преобразователь); датчика (электродная
- 16. Науменко Н.В. При погружении электродов в раствор
- 17. Науменко Н.В. При условии, что потенциал электрода
- 18. Науменко Н.В. Существующие индикаторные электроды условно подразделяют
- 19. Науменко Н.В. Электроннообменные электроды изготавливают из инертных
- 20. Науменко Н.В. Ионоселективные (мембранные) электроды в свою
- 21. Науменко Н.В. Независимо от типа мембраны механизм
- 22. Науменко Н.В. В качестве электрода сравнения (потенциал
- 23. Науменко Н.В.
- 24. Науменко Н.В.
Слайд 2Науменко Н.В.
Они основаны на зависимости между составом анализируемого вещества и его
электрохимическими свойствами.
Методы определения базируются на использовании процессов, происходящих в электролитической ячейке, которая представляет собой систему из электродов и электролитов, контактирующих между собой.
Данные методы анализа характеризуются достаточной точностью, селективностью, воспроизводимостью и могут использоваться для прямых и косвенных измерений.
Методы определения базируются на использовании процессов, происходящих в электролитической ячейке, которая представляет собой систему из электродов и электролитов, контактирующих между собой.
Данные методы анализа характеризуются достаточной точностью, селективностью, воспроизводимостью и могут использоваться для прямых и косвенных измерений.
Слайд 3Науменко Н.В.
Кондуктометрический метод основан на измерении электропроводности растворов электролитов.
При определенных
условиях электропроводность раствора электролита зависит от концентрации.
Слайд 4Науменко Н.В.
На этом основан прямой кондуктометрический метод анализа, заключающийся в непосредственном
измерении электропроводности растворов электролитов и сравнении её с электропроводностью растворов того же состава, концентрация которых известна.
Этот метод наиболее распространен для анализа растворов, содержащих один электролит, и имеет сравнительные ограничения в лабораторной практике.
Этот метод наиболее распространен для анализа растворов, содержащих один электролит, и имеет сравнительные ограничения в лабораторной практике.
Слайд 5Науменко Н.В.
Если в сосуд с раствором электролита поместить два электрода и
соединить их с источником тока, то через раствор пойдет электрический ток, сила которого определяется законом Ома:
I=E/R,
где E – напряжение на электродах, R – сопротивление раствора.
Электропроводность – величина обратная сопротивлению.
Электропроводность зависит от концентрации, свойств растворенного электролита, а также от размера и расположения электродов.
I=E/R,
где E – напряжение на электродах, R – сопротивление раствора.
Электропроводность – величина обратная сопротивлению.
Электропроводность зависит от концентрации, свойств растворенного электролита, а также от размера и расположения электродов.
Слайд 6Науменко Н.В.
Большое значение имеет кондуктометрическое титрование – разновидность кондуктометрического метода анализа,
при котором измерение электропроводности используется для определения точки эквивалентности во время титрования.
Чем больше площадь электродов и чем меньше расстояние между ними, тем больше электропроводность, измеренная при помощи электродов.
Чтобы было можно сравнивать между собой результаты измерений, вводят понятие удельной электропроводности.
Под которой понимают электропроводность раствора, заключенного между плоскими электродами площадью 1 см2 и отстоящими друг от друга на расстоянии 1 см.
Чем больше площадь электродов и чем меньше расстояние между ними, тем больше электропроводность, измеренная при помощи электродов.
Чтобы было можно сравнивать между собой результаты измерений, вводят понятие удельной электропроводности.
Под которой понимают электропроводность раствора, заключенного между плоскими электродами площадью 1 см2 и отстоящими друг от друга на расстоянии 1 см.
Слайд 7Науменко Н.В.
При кондуктометрическом анализе электропроводность растворов чаще всего выражают через удельную
электропроводность, которая, прежде всего, зависит от концентрации и природы электролита.
Переносчиком тока в растворах электролитов являются ионы, на которые распадаются молекулы электролитов при диссоциации в водном растворе.
Переносчиком тока в растворах электролитов являются ионы, на которые распадаются молекулы электролитов при диссоциации в водном растворе.
Слайд 8Науменко Н.В.
Ионы в растворе находятся в беспорядочном движении.
Когда к электродам
подводят напряжение, в растворе возникает электрическое поле; под его действием ионы начинают двигаться в определенных направлениях, перенося электрические заряды, следовательно, через раствор начинает протекать ток.
Слайд 9Науменко Н.В.
Чем больше ионов участвует в переносе зарядов, тем больше сила
тока и тем больше электропроводность раствора.
Удельная электропроводность у растворов большинства кислот, солей и оснований с повышением концентрации сначала возрастает, но затем после достижения определенного максимума начинает падать.
Это объясняется тем, что когда концентрация раствора становится достаточно большой, дальнейшее увеличение её сопровождается уменьшением степени диссоциации и увеличением взаимодействия ионов между собой.
Удельная электропроводность у растворов большинства кислот, солей и оснований с повышением концентрации сначала возрастает, но затем после достижения определенного максимума начинает падать.
Это объясняется тем, что когда концентрация раствора становится достаточно большой, дальнейшее увеличение её сопровождается уменьшением степени диссоциации и увеличением взаимодействия ионов между собой.
Слайд 10Науменко Н.В.
Сосуд для измерения электропроводности раствора – электролитическая ячейка – представляет
собой стеклянный сосуд с платиновыми электродами. Электроды жестко закреплены в стенках или в крышке сосуда для того, чтобы расстояние между ними не изменялось.
В зависимости от электропроводности анализируемого раствора выбирают ячейку с большим или меньшим расстоянием между электродами, с большей или меньшей поверхностью электродов.
Отношение площади электрода к расстоянию между электродами – важная характеристика ячейки, называемая постоянной электролитической ячейки. При помощи специального устройства измеряют не электропроводность раствора, а обратную ей величину – сопротивление.
В зависимости от электропроводности анализируемого раствора выбирают ячейку с большим или меньшим расстоянием между электродами, с большей или меньшей поверхностью электродов.
Отношение площади электрода к расстоянию между электродами – важная характеристика ячейки, называемая постоянной электролитической ячейки. При помощи специального устройства измеряют не электропроводность раствора, а обратную ей величину – сопротивление.
Слайд 12Науменко Н.В.
ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Потенциометрический метод используют для определения содержания различных веществ
в растворе, а также различных физико-химический параметров системы, например окислительно-восстановительного потенциала.
Слайд 13Науменко Н.В.
Главное достоинство потенциометрического метода – быстрота и простота проведения измерений.
Потенциометрическим методом исследуют мутные и окрашенные растворы, при этом исключаются операции фильтрации и перегонки.
Потенциометрия широко применяется для непосредственного определения активности ионов, находящихся в растворе (ионометрия), а также для индикации точки эквивалентности при потенциометрическом титровании.
Потенциометрия широко применяется для непосредственного определения активности ионов, находящихся в растворе (ионометрия), а также для индикации точки эквивалентности при потенциометрическом титровании.
Слайд 14Науменко Н.В.
При исследовании потребительских товаров потенциометрический метод анализа широко применяют для
исследования химического состава продукта (в частности минерального состава), а также определения показателя активной кислотности.
Потенциометрический метод анализа основан на использовании зависимости потенциала от концентрации ионов в растворе.
Устройства, применяемые для измерения потенциала – потенциометры (рН-метр, ионометр), состоят из двух блоков:
Потенциометрический метод анализа основан на использовании зависимости потенциала от концентрации ионов в растворе.
Устройства, применяемые для измерения потенциала – потенциометры (рН-метр, ионометр), состоят из двух блоков:
Слайд 15Науменко Н.В.
измерительного (высокоомный преобразователь);
датчика (электродная система).
В качестве электродной системы выступают обычно
два электрода:
индикаторный (потенциал которого зависит от концентрации определенных ионов в растворе);
сравнения (потенциал которого не зависит от концентрации определяемых ионов, как правило, хлор-серебряный).
индикаторный (потенциал которого зависит от концентрации определенных ионов в растворе);
сравнения (потенциал которого не зависит от концентрации определяемых ионов, как правило, хлор-серебряный).
Слайд 16Науменко Н.В.
При погружении электродов в раствор на границе индикаторный электрод –
раствор возникает электрический потенциал, так как ионы электрода переходят в раствор.
При этом электрод заряжается положительно, а пограничный слой раствора – отрицательно. Возникающий пограничный потенциал функционально связан с активной концентрацией ионов.
Однако непосредственное измерение потенциала отдельного электрода невозможно, технически можно измерить лишь разность потенциалов индикаторного электрода и электрода сравнения (ЭДС).
Е = ϕ 1 ‑ ϕ 2
При этом электрод заряжается положительно, а пограничный слой раствора – отрицательно. Возникающий пограничный потенциал функционально связан с активной концентрацией ионов.
Однако непосредственное измерение потенциала отдельного электрода невозможно, технически можно измерить лишь разность потенциалов индикаторного электрода и электрода сравнения (ЭДС).
Е = ϕ 1 ‑ ϕ 2
Слайд 17Науменко Н.В.
При условии, что потенциал электрода сравнения – величина известная (ϕ
2), рассчитывают потенциал другого электрода и, используя уравнение Нернста рассчитывают концентрацию определяемых ионов.
Слайд 18Науменко Н.В.
Существующие индикаторные электроды условно подразделяют на две группы:
Электроды, в которых
электрический ток между раствором и электродом переносится электронами;
Мембранные электроды, в которых электрический ток переносится ионами.
Мембранные электроды, в которых электрический ток переносится ионами.
Слайд 19Науменко Н.В.
Электроннообменные электроды изготавливают из инертных металлов (золото, платина).
Эти металлы
имеют такую прочную кристаллическую решетку, что их ионы не принимают участия в возникновении электродного потенциала.
Инертные металлы являются лишь передатчиками электронов между окислителем и восстановителем в приэлектродном слое.
Обмен электронами и обусловливает возникновение потенциала.
Инертные металлы являются лишь передатчиками электронов между окислителем и восстановителем в приэлектродном слое.
Обмен электронами и обусловливает возникновение потенциала.
Слайд 20Науменко Н.В.
Ионоселективные (мембранные) электроды в свою очередь подразделяют на:
электроды с твердой
мембраной;
электроды с жидкостной мембраной;
стеклянные электроды.
электроды с жидкостной мембраной;
стеклянные электроды.
Слайд 21Науменко Н.В.
Независимо от типа мембраны механизм действия ионоселективного электрода подчиняется одним
и тем же законам.
Если чувствительная мембрана помещена между двумя растворами, то через нее могут перемещаться ионы только определенного типа в направлении к раствору с меньшей активностью (концентрацией) подвижного иона.
На поверхности мембраны возникает потенциал, при котором прекращается дальнейшее перемещение ионов, и в результате устанавливается динамическое равновесие, которое называют равновесным электродным потенциалом.
Если чувствительная мембрана помещена между двумя растворами, то через нее могут перемещаться ионы только определенного типа в направлении к раствору с меньшей активностью (концентрацией) подвижного иона.
На поверхности мембраны возникает потенциал, при котором прекращается дальнейшее перемещение ионов, и в результате устанавливается динамическое равновесие, которое называют равновесным электродным потенциалом.
Слайд 22Науменко Н.В.
В качестве электрода сравнения (потенциал которого не зависит от концентрации
определяемых ионов в растворе) используют хлорсеребряный, каломельный и хлорталиевый электроды.
Наибольшее распространение находит хлорсеребряный электрод, который представляет собой сосуд с серебряной пластинкой, покрытой слоем трудно растворимой соли AgCl, которую заливают раствором KCl (как правило, насыщенным).
Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод.
Так в хлорсеребряном электроде потенциал зависит только от активности ионов Cl‑, которая в свою очередь определяется концентрацией Cl‑ из хорошо растворимой соли KCl.
Наибольшее распространение находит хлорсеребряный электрод, который представляет собой сосуд с серебряной пластинкой, покрытой слоем трудно растворимой соли AgCl, которую заливают раствором KCl (как правило, насыщенным).
Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод.
Так в хлорсеребряном электроде потенциал зависит только от активности ионов Cl‑, которая в свою очередь определяется концентрацией Cl‑ из хорошо растворимой соли KCl.