- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы презентация
Содержание
- 1. Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы
- 2. ЖОСПАР: І. Кіріспе ІІ. Негізгі бөлім а)Дисперсті
- 3. Дисперстік жүйелердің тұрақтылығы деп олардың қасиеттерінің
- 4. Песковтың ұсынысы бойынша дисперстік жүйелердің тұрақтылығын екіге
- 5. Седиментациялық тұрақтылық - жүйенің дисперстік фазасының бөлшектерінің
- 6. Термодинамикалық тұрақты жүйелер бір фаза екінші фазаның
- 7. Лиофобтық жүйелердің агрегаттық тұрақтылығы коагуляция жылдамдығы арқылы
- 8.
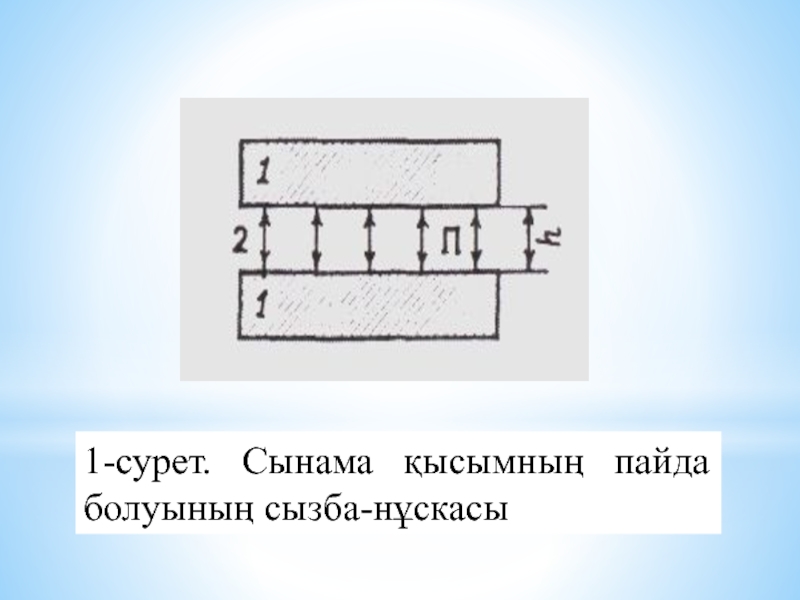
- 9. 1-сурет. Сынама қысымның пайда болуының сызба-нұскасы
- 10. Жалпы термодинамикалық және кинетикалық тұрақтылықтарды қамтамасыз ететін
- 11. Бұл теория бойынша коллоидтық ерітіндінің (зольдің) коагуляциясы
- 12. Қосылған электролит диффузиялық қабатты сығымдап дзета потенциал
- 13. Коллоидты ерітінділерде электролит қосылғаннан кейін диффузиялық қабаттың
- 14. Сырттан қосылған электролит иондарының коллоидты бөлшек агрегатындағы
- 15. Бұл коллоидты бөлшектердің потенциал анықтауыш иондары теріс
- 16. Дерягин және Ландау, бейтараптану байыбымен жүзеге асатын
- 18. Мұндағы,
- 19. Бұл Дерягиннің атақты (Z6) ережесі.
- 21. Қорытынды Дисперсті жүйелердің тұрақтылығы мен бұзылуы мәселесі
- 22. Пайдаланылған әдебиеттер: Мұсабеков Қ.Б.,Әбдиев Қ.Ж. Коллоидтық химия:
- 23. Назарларыңызға рахмет!
Слайд 2ЖОСПАР:
І. Кіріспе
ІІ. Негізгі бөлім
а)Дисперсті жүйелердің тұрақтылығы
б)ДЛФО теориясы
ІІІ. Қорытынды
ІV. Пайдаланған әдебиеттер
Слайд 3 Дисперстік жүйелердің тұрақтылығы деп олардың қасиеттерінің (дисперстігінің, дисперстік ортада біркелкі
Слайд 4Песковтың ұсынысы бойынша дисперстік жүйелердің тұрақтылығын екіге бөліп:
шөгу құбылысына қарсы
бөлшектердің бірігіп, ірілену құбылысына қарсы тұра алу қабілеті деп қарастырған жөн.
Бірінші тұрақтылықты седиментациялық тұрақтылық деп атайды. Екіншісін - агрегаттық тұрақтылық деп атайды. Агрегаттық тұрақтылықтың өзі термодинамикалық және кинетикалық тұрақтылық болып екіге бөлінеді.
Слайд 5Седиментациялық тұрақтылық - жүйенің дисперстік фазасының бөлшектерінің ауырлық күшінің әсерінен тұнбаға
Агрегаттық тұрақтылық - дисперстік фаза бөлшектерінің бірігіп (агрегацияланып) жүйенің меншікті бетінің азаюына қарсы тұра білу қабілеті.
Слайд 6Термодинамикалық тұрақты жүйелер бір фаза екінші фазаның көлемінде ұсақ бөлшектер (тамшылар)
Термодинамикалық тұрақты жүйелерді лиофилъдік жүйелер деп атайды. Бірақ термодинамикалық тұрақсыз жүйелер кинетикалық тұрғысынан тұрақты болуы мүмкін. Мұндай жүйелерді кинетикалық тұрақты жүйелер деп атайды.
Кинетикалық тұрақты жүйелерді лиофобтық жүйелер деп атайды. Лиофобтық жүйелер белгілі бір уақыт аралығында ғана тұрақты болады, одан кейін оның агрегаттық тұрақтылығы бұзылады.
Слайд 7Лиофобтық жүйелердің агрегаттық тұрақтылығы коагуляция жылдамдығы арқылы сипатталады. Б.В.Дерягинның көзқарасына сәйкес
Слайд 10Жалпы термодинамикалық және кинетикалық тұрақтылықтарды қамтамасыз ететін мынадай факторлар бар:
1.Электростатикалық фактор,
2.Адсорбциялық-солъваттық фактор, ол бөлшектің дисперстік ортамен әрекеттесуі нәтижесінде фазааралық керілудің кемуімен қамтамасыз етіледі;
3.Энтропиялық фактор, ол тек ультрамикрогетерогенді жүйелерге ғана тән және жылулық қозғалыстың нәтижесінде бөлшектердің дисперстік ортада біркелкі таралуына ұмтылысымен қамтамасыз етіледі;
4.Құрылымдық-механикалық фактор, ол фазааралық бөлу бетінде серпімділік және беріктік қасиеттері бар адсорбциялық қабаттардың түзілуімен қамтамасыз етіледі;
5.Гидродинамикалық фактор, ол бөлшектердің беттік қабатындағы дисперстік ортаның тұтқырлығының артуымен қамтамасыз етіледі;
6.Аралас факторлар. Ол жоғарыдағы факторлардың бірнешеуінің бір мезгілде әсер етуі нәтижесінде іске асады.
Слайд 11 Бұл теория бойынша коллоидтық ерітіндінің (зольдің) коагуляциясы бөлшектердің әрекеттесуінің потенциалдық қисығындағы
ДЛФО теориясы.
(Дерягин, Ландау 1935-1941, Фервей, Овербек)
ДЛФО теориясында коллоидты бөлшектердің өзара белгілі бір ара қашықтықта олардьің арасында тебілу күштері басым болатындығы негізге алынады.
Енді осы жүйеге сырттан злектролит қосылсын. Бұл орайда коллоидты ерітінділер өз күйін жоғалтып, коагуляцияға ұшырайды.
Слайд 12Қосылған электролит диффузиялық қабатты сығымдап дзета потенциал шамасын өзгертеді. Бұл электролит
Сырттан қосылған электролиттер ионы ядроға адсорбцияланбайтын болса, онда оларды индиферентті электролиттер деп атайды.
Слайд 13Коллоидты ерітінділерде электролит қосылғаннан кейін диффузиялық қабаттың сығылуы екі түрлі жағдайда
- қарама-қарсы таңбадағы иондар диффузиялық қабаттан қос иондық қабатқа ауысып,дзета потеициал шамасын төмендетеді;
- ерітінді иондық күші артқандықтан қарсы таңбадағы иондардың диффузиялану қабаты сығымдалады. Осының нәтижесінде дзета потенциал шамасы өзгереді, бөлшектердің бір-біріне жақындау мүмкіндігі артады.
Слайд 14Сырттан қосылған электролит иондарының коллоидты бөлшек агрегатындағы иондармен нашар еритін қосылыс
{m AgJ nJ-( n- x)K+} xK+
Слайд 15Бұл коллоидты бөлшектердің потенциал анықтауыш иондары теріс таңбалы болғандықтан, оны бейтараптандыру
Слайд 16Дерягин және Ландау, бейтараптану байыбымен жүзеге асатын ұю барысында электролиттердің "ұйыту
γ = Сопst / z6
Бұл теңдікті және оның оң бөлігіндегі қатынасты былай түсіну керек.
Ұйыту үшін бір, екі және үш зарядты иондарды алатын болсақ, онда олардың ұйыту шекті мәндері төмендегідей қатынаста бола отырып, ұютуға бірдей әсер етеді:
γI : γII : γIII = (1/1)6 : (1/2)6 : ( 1/3)6 = 1: 1/26: 1/36 = 1: 1/64: 1/ 729 = 729:11:1
Демек, белгілі зольдің ерітіндісінің бірдей мөлшерін ұйыту үшін үш зарядты ионы бар электролитке қарағанда екі зарядты ионы бар электролит он бір есе, ал бір зарядты ионы бар электролит 729 есе көп қажет деген сөз.
Слайд 17
Демек, күшті зарядталған бөлшектердің коагуляциялану шарты былай жазылады:
(а)
(б)
hс-ның
өрнегін аламыз.
Слайд 18
Мұндағы, .
Бұл
Бұл теңдеуді квадрат дәрежесіне шығарып, әрі
екенін ескеріп, мына теңдеуді аламыз:
Слайд 19
Бұл Дерягиннің атақты (Z6) ережесі. Бұл ереже бойынша электролиттің коагуляциялау қабілеті
Слайд 20
- олардың бір-біріне тартылысын сипаттайды.
Егер
- жүйе тұрақты; - жүйе тұрақсыз.
Бұдан,
(Эйлерс – Корф шарты)
Демек, .
Слайд 21Қорытынды
Дисперсті жүйелердің тұрақтылығы мен бұзылуы мәселесі дисперсті жүйелер мен беттік құбылыстар
Слайд 22Пайдаланылған әдебиеттер:
Мұсабеков Қ.Б.,Әбдиев Қ.Ж. Коллоидтық химия: Оқулық.-Алматы: 2011.-10-24 б.
Ходаков Г.С., Юдкин
Воюцкий С.С., Курс коллоидной химии. М., «Химия», 1976-574 с.