- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Давление газа. Уравнение состояния идеального газа. Изопроцессы презентация
Содержание
- 1. Давление газа. Уравнение состояния идеального газа. Изопроцессы
- 2. ДАВЛЕНИЕ ГАЗА ВОЗНИКАЕТ В РЕЗУЛЬТАТЕ СТОЛКНОВЕНИЙ МОЛЕКУЛ
- 5. Основное уравнение молекулярно-кинетической теории идеального газа Основное
- 6. ИДЕАЛЬНЫЙ ГАЗ – ЭТО МОДЕЛЬ РЕАЛЬНОГО ГАЗА.
- 7. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА — ФОРМУЛА, УСТАНАВЛИВАЮЩАЯ
- 8. ИЗОПРОЦЕССЫ – ЭТО ПРОЦЕССЫ, КОТОРЫЕ СОВЕРШАЮТСЯ ПРИ ОДИНАКОВОМ ПАРАМЕТРЕ ИЛИ Т-ТЕМПЕРАТУРЕ, ИЛИ V-ОБЪЕМЕ, ИЛИ Р-ДАВЛЕНИИ.
- 9. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС —ЗАКОН БОЙЛЯ — МАРИОТТА (ПРИ
- 10. ИЗОБАРНЫЙ ПРОЦЕСС —ЗАКОН ГЕЙ-ЛЮССАКА (ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- 11. ИЗОХОРНЫЙ ПРОЦЕСС — ЗАКОН ШАРЛЯ (ПРИ ПОСТОЯННОМ
- 12. ИСТОЧНИКИ: HTTP://KAPLIO.RU/DAVLENIE-GAZA-URAVNENIE-MENDELEEVA-KLAPEJRONA-IZOPROTSESSY/ HTTPS://STUDFILES.NET/
Слайд 1ДАВЛЕНИЕ ГАЗА. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ИЗОПРОЦЕССЫ.
ПОДГОТОВИЛА:
СТУДЕНТКА ПСК ГРУППЫ 671
ЛИСУНОВА КСЕНИЯ
ПРОВЕРИЛА:
ЗАХАРОВА О.А.
ОЦЕНКА
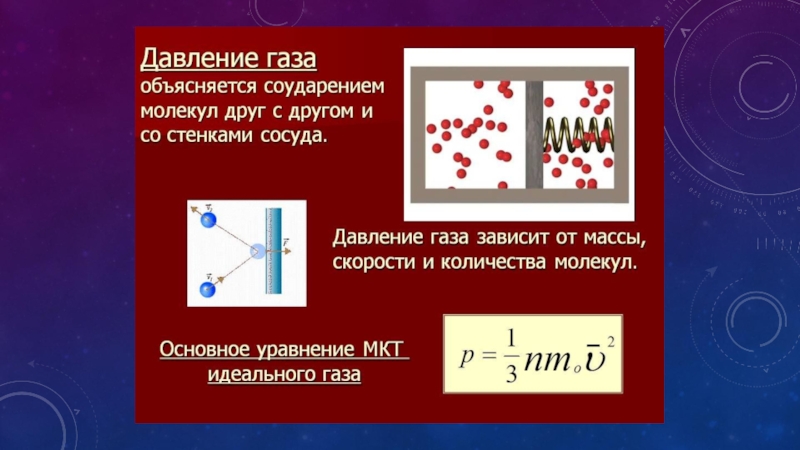
Слайд 2ДАВЛЕНИЕ ГАЗА ВОЗНИКАЕТ В РЕЗУЛЬТАТЕ СТОЛКНОВЕНИЙ МОЛЕКУЛ СО СТЕНКАМИ СОСУДА (
И НА ПОМЕЩЕННОЕ В ГАЗ ТЕЛО ), В КОТОРОМ НАХОДИТСЯ БЕСПОРЯДОЧНО ДВИЖУЩИЕСЯ МОЛЕКУЛЫ ГАЗА. ЧЕМ ЧАШЕ УДАРЫ, ТЕМ ОНИ СИЛЬНЕЕ – ТЕМ ВЫШЕ ДАВЛЕНИЕ. ДАВЛЕНИЕ ЗАВИСИТ И ОТ СКОРОСТИ ПОСТУПАТЕЛЬНО ДВИЖУЩИХСЯ ГАЗОВЫХ МОЛЕКУЛ. ЕДИНИЦА ИЗМЕРЕНИЯ ДАВЛЕНИЯ — ПАСКАЛЬ P(ПА). ИЗМЕРЯЮТ ДАВЛЕНИЕ ГАЗА МАНОМЕТРОМ.
Слайд 5Основное уравнение молекулярно-кинетической теории идеального газа
Основное уравнение молекулярно-кинетической теории идеального газа
устанавливает связь между макроскопической величиной - давлением, которое может быть измерено, например манометром, и микроскопическими величинами, характеризующими молекулу:
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
где р - давление, m0- масса молекулы, п - концентрация (число молекул в единице объема), v2- средний квадрат скорости молекул.
Если через Е обозначить среднюю кинетическую энергию поступательного движения молекулы
можно записать:
Давление идеального газа пропорционально концентрации молекул и средней кинетической энергии их поступательного движения.
уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева):
PV = nRT
Слайд 6ИДЕАЛЬНЫЙ ГАЗ – ЭТО МОДЕЛЬ РЕАЛЬНОГО ГАЗА. ЗА ИДЕАЛЬНЫЙ ГАЗ ПРИНИМАЮТ
ГАЗ В СОСУДЕ, КОГДА МОЛЕКУЛА, ПРОЛЕТАЯ ОТ СТЕНКИ ДО СТЕНКИ СОСУДА НЕ ИСПЫТЫВАЕТ СТОЛКНОВЕНИЯ С ДРУГИМИ МОЛЕКУЛАМИ. ТОЧНЕЕ, ИДЕАЛЬНЫЙ ГАЗ – ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО ⇒ EК >> EР .
Слайд 7УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА — ФОРМУЛА, УСТАНАВЛИВАЮЩАЯ ЗАВИСИМОСТЬ МЕЖДУ ДАВЛЕНИЕМ, ОБЪЁМОМ
И АБСОЛЮТНОЙ ТЕМПЕРАТУРОЙ ИДЕАЛЬНОГО ГАЗА, ХАРАКТЕРИЗУЮЩЕЕ СОСТОЯНИЕ ДАННОЙ СИСТЕМЫ ГАЗА. УРАВНЕНИЕ МЕНДЕЛЕЕВА-КЛАПЕЙРОНА— УРАВНЕНИЕ МЕНДЕЛЕЕВА — КЛАПЕЙРОНА (ДЛЯ ПРОИЗВОЛЬНОЙ МАССЫ ГАЗА).
R = 8,31 ДЖ/МОЛЬ·К — УНИВЕРСАЛЬНАЯ ГАЗОВАЯ ПОСТОЯННАЯ. PV = RT – (ДЛЯ 1 МОЛЯ).
Слайд 8ИЗОПРОЦЕССЫ – ЭТО ПРОЦЕССЫ, КОТОРЫЕ СОВЕРШАЮТСЯ ПРИ ОДИНАКОВОМ ПАРАМЕТРЕ ИЛИ Т-ТЕМПЕРАТУРЕ,
ИЛИ V-ОБЪЕМЕ, ИЛИ Р-ДАВЛЕНИИ.
Слайд 9ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС —ЗАКОН БОЙЛЯ — МАРИОТТА (ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ И ДАННОЙ
МАССЫ ГАЗА ПРОИЗВЕДЕНИЕ ДАВЛЕНИЯ НА ОБЪЕМ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ)
Слайд 10ИЗОБАРНЫЙ ПРОЦЕСС —ЗАКОН ГЕЙ-ЛЮССАКА (ПРИ ПОСТОЯННОМ ДАВЛЕНИИ ДЛЯ ДАННОЙ МАССЫ ГАЗА
ОТНОШЕНИЕ ОБЪЕМА К ТЕМПЕРАТУРЕ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ)
Слайд 11ИЗОХОРНЫЙ ПРОЦЕСС — ЗАКОН ШАРЛЯ (ПРИ ПОСТОЯННОМ ОБЪЕМЕ ДЛЯ ДАННОЙ МАССЫ
ГАЗА ОТНОШЕНИЕ ДАВЛЕНИЯ К ТЕМПЕРАТУРЕ ЕСТЬ ВЕЛИЧИНА ПОСТОЯННАЯ.