- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
(1)Основные понятия молекулярной физики. Молекулярно-кинетическая теория. Идеальный газ презентация
Содержание
- 1. (1)Основные понятия молекулярной физики. Молекулярно-кинетическая теория. Идеальный газ
- 2. Эмпирические газовые законы (1) Изопроцессы – процессы,
- 3. Эмпирические газовые законы (2) Закон Шарля: II.
- 4. Количество вещества - число Авогадро -
- 5. Уравнение Менделеева-Клапейрона уравнение состояния идеального газа -
- 6. Закон Дальтона Давление смеси газов равно сумме
- 7. Получим связь давления идеального газа с его
- 8. Количество вещества смеси газов - количество вещества
- 9. Основное уравнение МКТ
- 10. Основное уравнение МКТ
- 11. Основное уравнение МКТ Средняя сила, действующая на
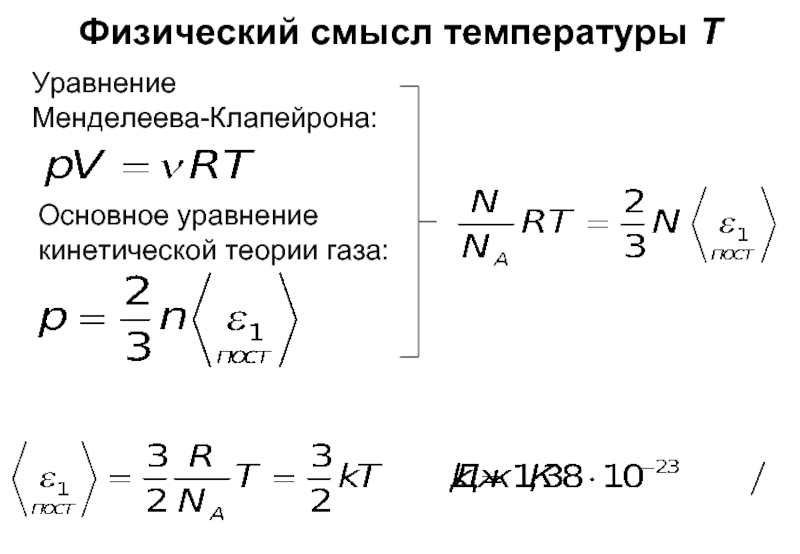
- 12. Физический смысл температуры T Уравнение Менделеева-Клапейрона: Основное уравнение кинетической теории газа:
Слайд 2Эмпирические газовые законы (1)
Изопроцессы – процессы, протекающие в системе с постоянной
I. p=const
Закон Гей-Люссака:
температурный коэффициент объемного расширения:
Слайд 3Эмпирические газовые законы (2)
Закон Шарля:
II. V=const
температурный коэффициент объемного расширения:
Закон Бойля-Мариотта :
III.
Слайд 4Количество вещества
- число Авогадро
- молярная масса
Закон Авогадро
Равные объёмы различных газов
Слайд 5Уравнение Менделеева-Клапейрона
уравнение состояния идеального газа
- давление газа
- объём газа
- масса газа
-
- абсолютная температура газа
- универсальная газовая постоянная
P, V, T – параметры состояния системы
Слайд 6Закон Дальтона
Давление смеси газов равно сумме их парциальных давлений.
- парциальное давление
данный газ создавал бы в отсутствие остальных
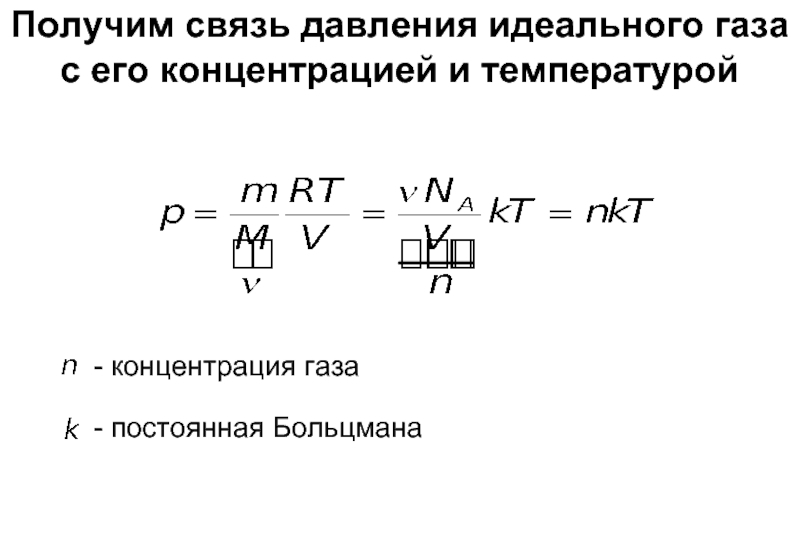
Слайд 7Получим связь давления идеального газа с его концентрацией и температурой
- концентрация
- постоянная Больцмана
Слайд 8Количество вещества смеси газов
- количество вещества газов, входящих в состав
Молярная масса смеси газов
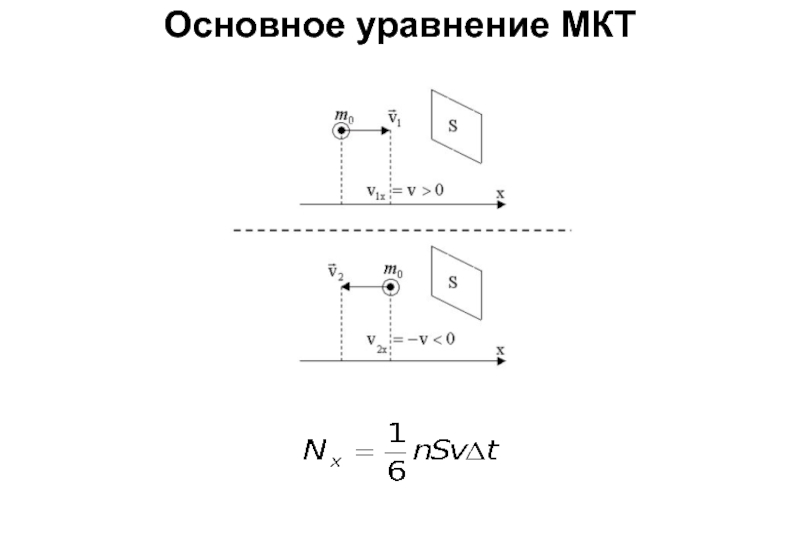
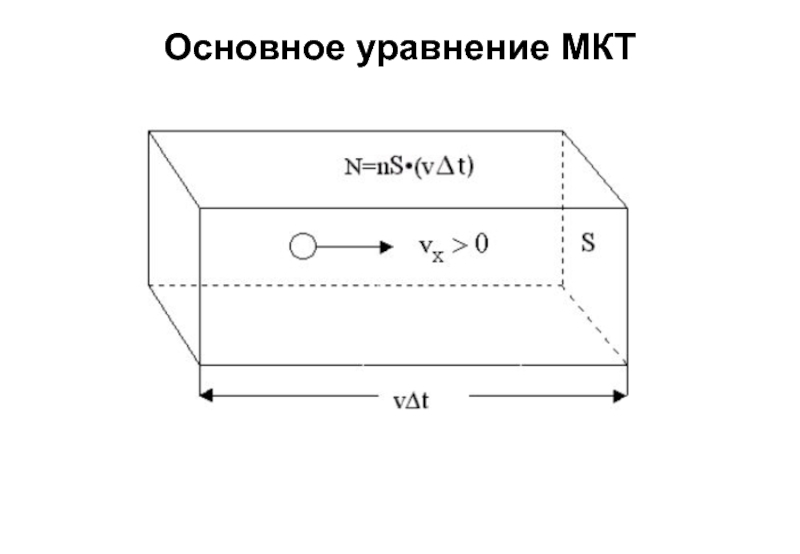
Слайд 11Основное уравнение МКТ
Средняя сила, действующая на стенку со стороны одной молекулы:
Число
Давление газа:
- средняя кинетическая энергия поступательного движения одной молекулы