- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Загрязнение атмосферного воздуха презентация
Содержание
- 1. Загрязнение атмосферного воздуха
- 2. Состав атмосферы
- 3. Основные загрязнители атмосферы: пыль, SO2, NOx,
- 4. Источники диоксида серы: природные - вулканы и
- 5. Источники оксидов азота NO и N02: природные
- 6. СМОГ - аэрозоль, состоящий из дыма, тумана
- 7. Лондонский (влажный) смог - сочетание газообразных и
- 8. Фотохимический смог: разновидность вторичного загрязнения атмосферы, когда
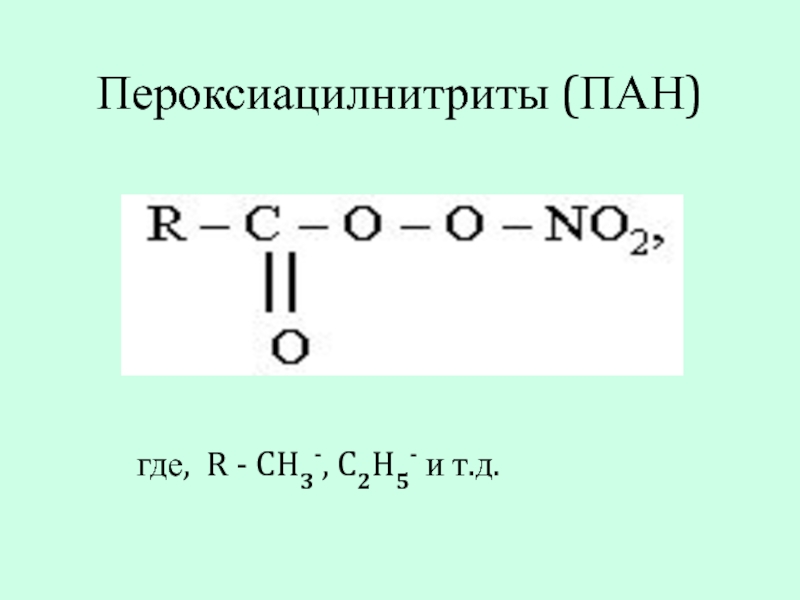
- 9. Пероксиацилнитриты (ПАН) где, R - CH3-, C2H5- и т.д.
- 10. Изменение концентраций компонентов фотохимического смога в разное время суток
- 11. Основные загрязнители атмосферы и источники их поступления
- 12. Основные загрязнители атмосферы и источники их поступления
- 13. Основные загрязнители атмосферы и источники их поступления
- 14. Наиболее сложная экологическая обстановка складывается в регионах,
- 15. Особо опасные вещества, искусственно созданные человеком -
- 16. Особо опасные вещества, искусственно созданные человеком -
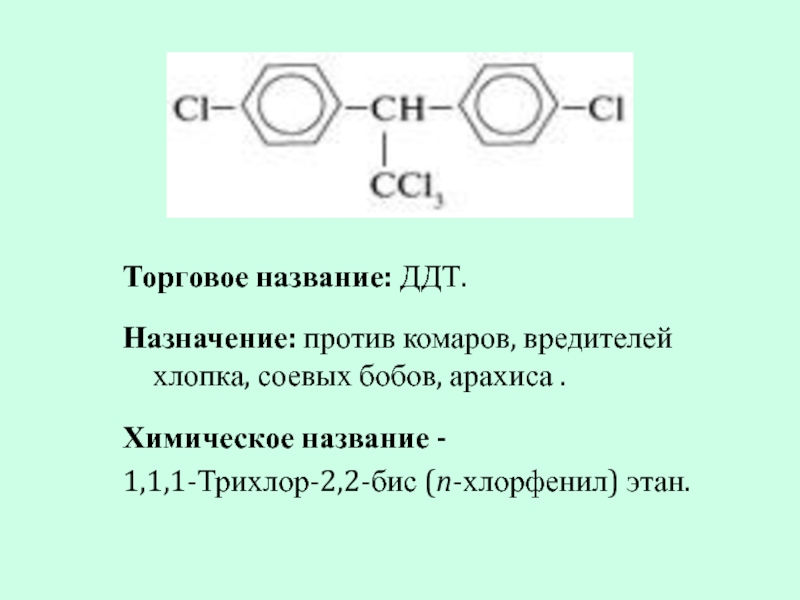
- 17. Торговое название: ДДТ. Назначение: против комаров,
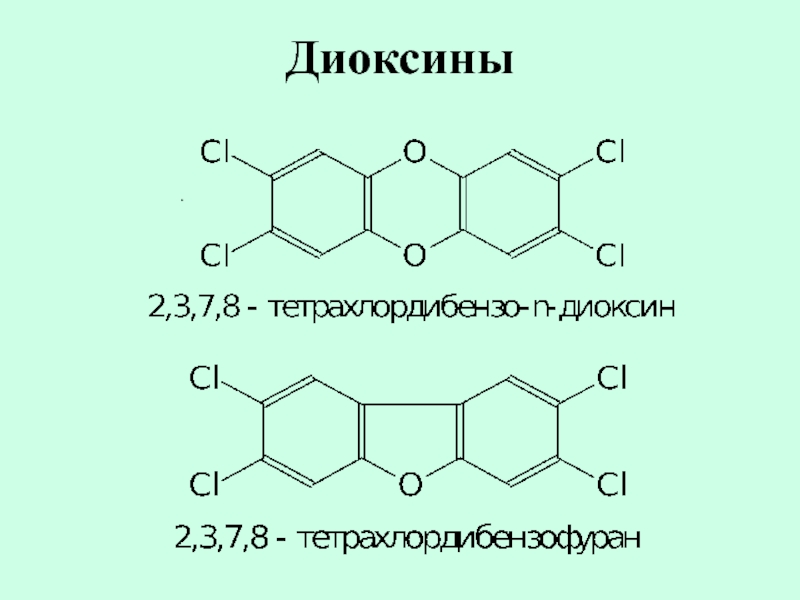
- 18. Диоксины .
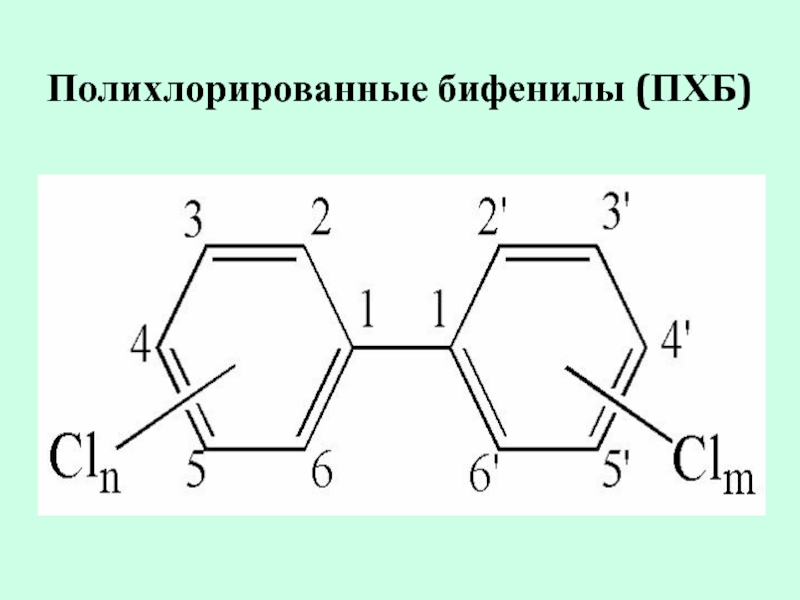
- 19. Полихлорированные бифенилы (ПХБ)
- 21. Парниковый эффект Парниковым может считаться любой газ,
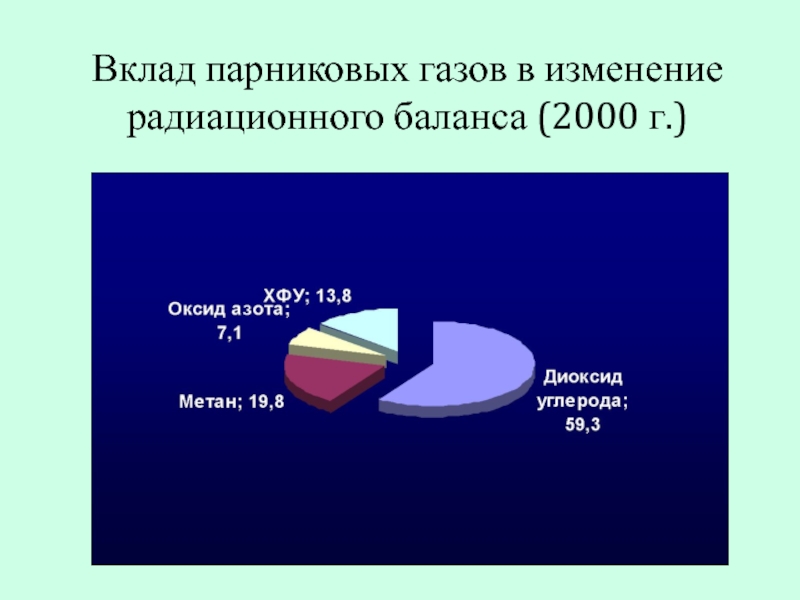
- 22. Вклад парниковых газов в изменение радиационного баланса (2000 г.)
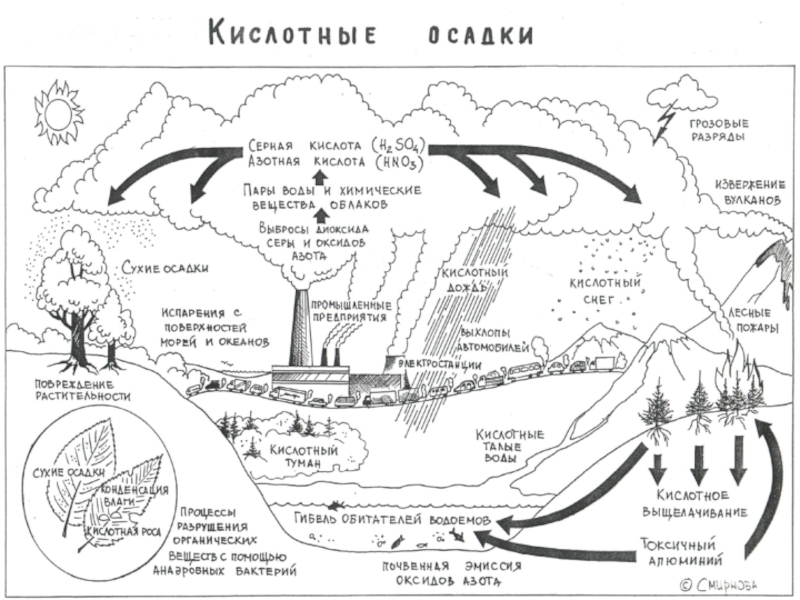
- 23. Кислотные осадки
- 24. Кислотность атмосферных осадков в России в 2002 г.
- 25. В естественных условиях атмосферные осадки обычно имеют
- 26. Кислотные осадки бывают двух типов: сухие,
- 28. Основные компоненты кислотных осадков: аэрозоли
- 29. Основные природные источники : извержения вулканов, лесные пожары, эрозия почв и др.
- 30. - процессы сжигания горючих ископаемых, главным
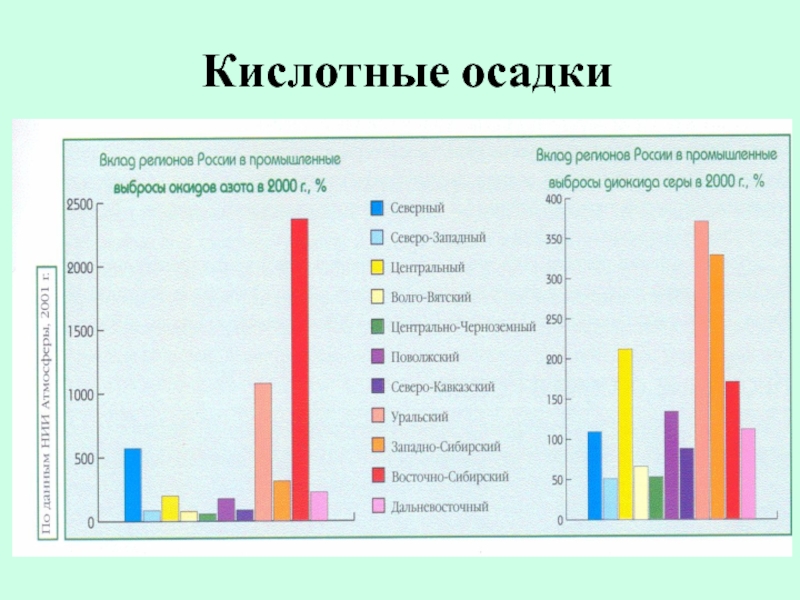
- 31. Кислотные осадки
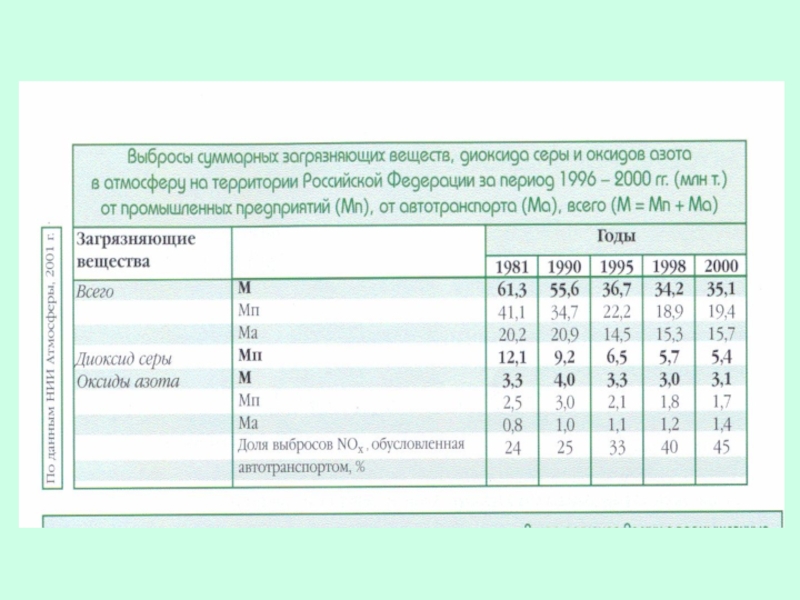
- 34. Основные пути снижения эмиссии оксидов азота и
- 35. Виды ущерба от кислых осадков: деградация водных
- 36. Исторические памятники Греции и Рима, простояв тысячелетия, в последние годы разрушаются прямо на глазах.
- 37. Такая же судьба грозит и Тадж-Махалу —
- 38. На соборе Св. Павла в Риме слой
- 39. Рациональное использование воздуха (газоочистка) «Всё, что попадает
- 40. Ниже представлен вклад (%) в загрязнение атмосферного воздуха основных отраслей промышленности:
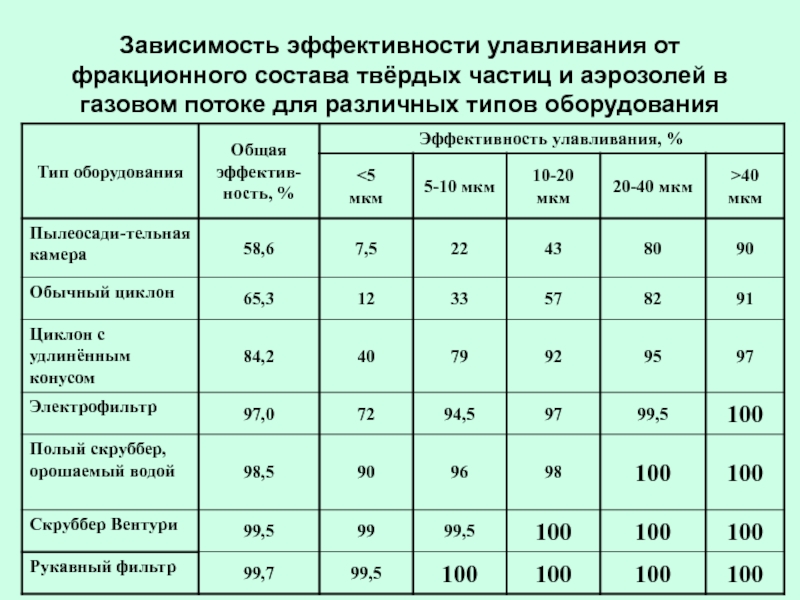
- 41. Зависимость эффективности улавливания от фракционного состава твёрдых
- 46. Очистка топочных газов от диоксида серы Известковый
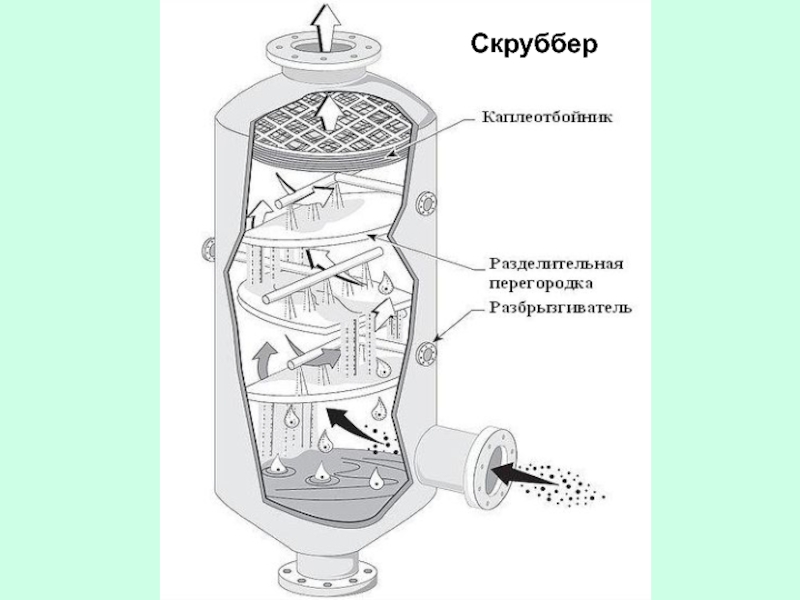
- 47. Скруббер
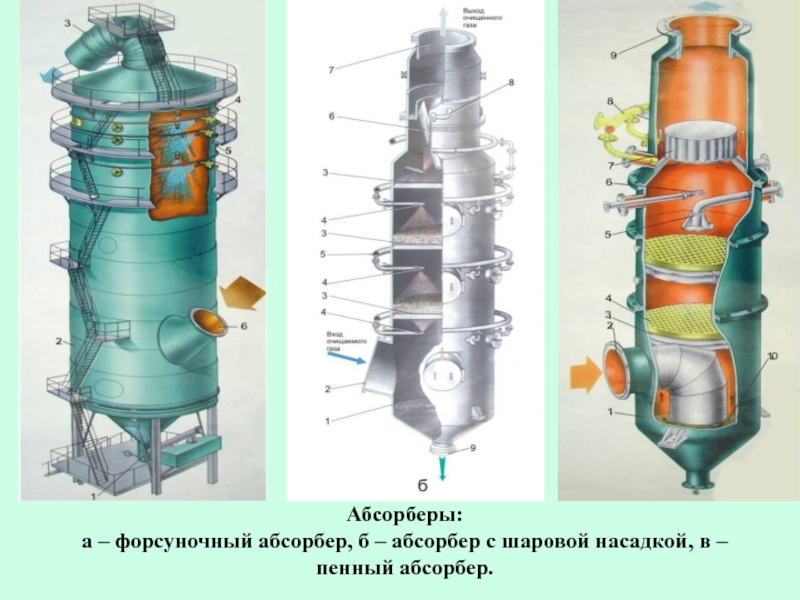
- 48. Абсорберы: а – форсуночный абсорбер, б – абсорбер с шаровой насадкой, в – пенный абсорбер.
- 49. Магнезитовый метод Сущность метода состоит
- 50. Достоинствами магнезитового
- 51. Очистка отходящих газов от оксидов азота Адсорбционные
- 52. Каталитическое восстановление Одним из основных,
- 53. Наиболее широкое распространение получило селективное каталитическое восстановление
- 54. Карбамидный метод В РХТУ им.
- 55. Рис…Схема установки для очистки дымовых газов от
- 56. Снижение выбросов оксидов азота в атмосферу путем
- 57. Очистка отходящих газов от фтор- и хлорсодержащих
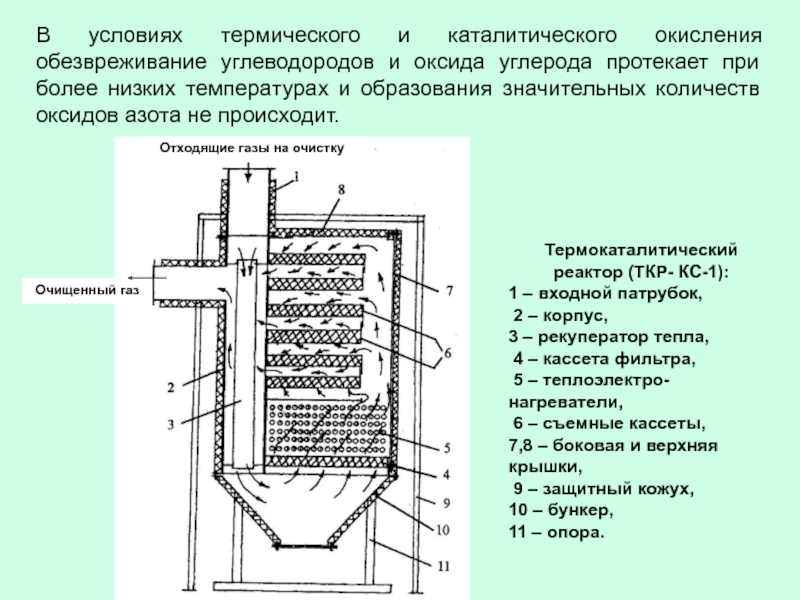
- 58. В условиях термического и каталитического окисления обезвреживание
- 59. Содержание загрязняющих веществ в дымовых газах при мусоросжигании
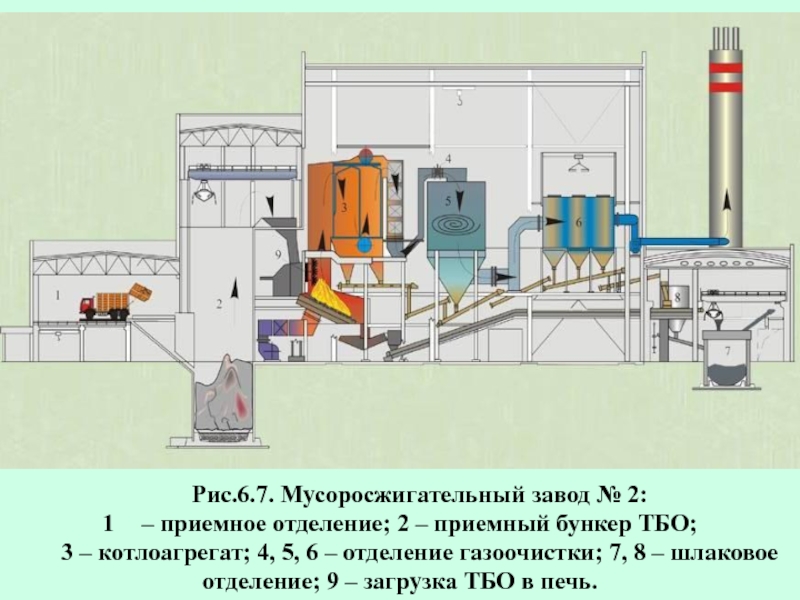
- 60. Рис.6.7. Мусоросжигательный завод № 2: – приемное
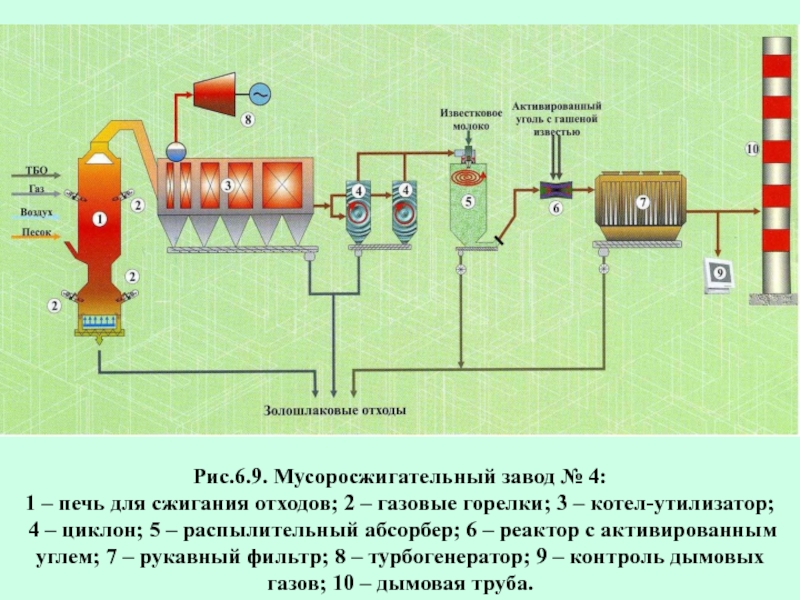
- 61. Рис.6.9. Мусоросжигательный завод № 4: 1 –
Слайд 4Источники диоксида серы:
природные - вулканы и лесные пожары,
антропогенные - сжигание
Слайд 5Источники оксидов азота NO и N02:
природные - электрические разряды, при которых
антропогенные - сгорание топлива, особенно при высоких температурах (Т > 10000С).
Слайд 6СМОГ
- аэрозоль, состоящий из дыма, тумана и пыли. Английское слово «smog» — производное
Жители английской столицы первыми столкнулись с проблемами, связанными с загрязнением городского воздуха.
Слайд 7Лондонский (влажный) смог
- сочетание газообразных и твердых примесей с туманом,
как
высокой влажности.
Слайд 8Фотохимический смог:
разновидность вторичного загрязнения атмосферы, когда из первичных загрязнителей образуются гораздо
автомобильные выхлопы +Солнечный свет + О2 →О3 + NOx + пероксиды, пероксинитриты+ CО2 + H2O.
Слайд 11Основные загрязнители атмосферы и источники их поступления
Оксид углерода (СО) :
дымовые газы
выхлопные газы транспорта с двигателем внутреннего сгорания.
Слайд 12Основные загрязнители атмосферы и источники их поступления
Углеводороды (CnHm ):
дымовые газы теплоэнергетических
из хранилищ жидкого и газообразного топлива,
выхлопные газы транспорта.
Слайд 13Основные загрязнители атмосферы и источники их поступления
Аэрозоли, тяжелые металлы:
результат сжигания
отходящие газы промышленных производств, в т.ч. дым плавильных печей при производстве сталей и сплавов цветных металлов.
Слайд 14Наиболее сложная экологическая обстановка складывается в регионах, где сосредоточены объекты тяжелой
К городам с напряженной экологической обстановкой относятся:
Новокузнецк и Екатеринбург,
Магнитогорск и Череповец,
Омск и Братск,
Кемерово и Нижний Тагил,
Тюмень и Иркутск,
Братск и Липецк,
Уфа и Чита,
Красноярск и Хабаровск.
Слайд 15Особо опасные вещества, искусственно созданные человеком -
ксенобиотики, экотоксиканты
КСЕНОБИОТИКИ – любое чужеродное
Экотоксиканты – высокотоксичный особый класс загрязняющих веществ.
Слайд 16Особо опасные вещества, искусственно созданные человеком -
ксенобиотики, экотоксиканты:
диоксины-гетероциклические полихлорированные соединения,
ДДТ –хлоорганические
полихлорированные бифенилы (ПХБ).
Слайд 17Торговое название: ДДТ.
Назначение: против комаров, вредителей хлопка, соевых бобов, арахиса .
Химическое
1,1,1-Трихлор-2,2-бис (n-хлорфенил) этан.
Слайд 21Парниковый эффект
Парниковым может считаться любой газ, поглощающий в ИК-области и содержащийся
водяной пар, находящийся в атмосфере,
углекислый газ (диоксид углерода) (СО2),
метан (СН4),
оксиды азота, в особенности N2O,
озон (О3),
хлорфторуглероды.
Слайд 25 В естественных условиях атмосферные осадки обычно имеют нейтральную или слабо кислую
В присутствии углекислого газа и при температуре 20о С дождевая вода имеет
рН = 5,6.
В присутствии других природных газов рН дождевой воды снижается примерно до
рН = 5,0.
Кислотные осадки (или “кислотные дожди”) это осадки с рН<5.
Слайд 26Кислотные осадки бывают двух типов:
сухие, обычно выпадающие невдалеке от источника
влажные (дождь, снег и пр.), распространяющиеся на большие расстояния, соизмеримые с размерами континентов.
Слайд 28Основные компоненты кислотных осадков:
аэрозоли оксидов серы и азота (SOх и
Слайд 30 - процессы сжигания горючих ископаемых, главным образом угля, в тепловых
- сельское хозяйство .
Основные антропогенные источники:
Слайд 34Основные пути снижения эмиссии оксидов азота и серы:
понижение температуры сжигания угля,
извлечение
экономия использования энергии.
Слайд 35Виды ущерба от кислых осадков:
деградация водных систем,
гибель лесов,
возрастание заболеваемость людей,
ущерб зданиям,
CaCO3+H2SO4→CaSO4+H2O.
Мрамор превращается в гипс.
Слайд 36 Исторические памятники Греции и Рима, простояв тысячелетия, в последние годы разрушаются
Слайд 37Такая же судьба грозит и Тадж-Махалу — шедевру индийской архитектуры периода
Слайд 38На соборе Св. Павла в Риме слой портлендского известняка разъеден на
Слайд 39Рациональное использование воздуха (газоочистка)
«Всё, что попадает в воздух, рано или поздно
Барри Коммонер, Замыкающийся круг
Слайд 40Ниже представлен вклад (%) в загрязнение атмосферного воздуха основных отраслей промышленности:
Слайд 41Зависимость эффективности улавливания от фракционного состава твёрдых частиц и аэрозолей в
Слайд 46Очистка топочных газов от диоксида серы
Известковый и известняковый методы
Основные химические реакции,
CaO + H2O ? Сa(OH)2
Ca(OH)2 + СO2 ? СаСО3 + H2O
CaCO3 + CO2 + H2O ? Са(НСО3)2
Са(НСО3)2 + SO2 + H2O ? CaSO3 * 2 H2O + 2 СO2
CaSO3 * 2 H2O + 1/2 О2 ? CaSO4 * 2 H2O
Слайд 49Магнезитовый метод
Сущность метода состоит во взаимодействии SO2 с суспензией Мg(ОН)2
Мg(ОН)2 + SO2 + 5 Н2О ? МgSО3 * 6 Н2О
Кристаллический сульфит магния подвергают сушке и обжигу, получая при этом концентрированный поток SO2 и МgО. Оксид магния возвращается в цикл, а SO2 направляется на переработку (например, на получение серной кислоты по стандартной технологии). Часть сульфита магния под действием кислорода воздуха окисляется до сульфата:
МgSО3 + 1/2О2 ? МgSО4
Слайд 50 Достоинствами магнезитового метода являются его цикличность,
Аммиачные методы
В основе этих методов лежит процесс абсорбции SO2 раствором сульфита аммония:
SO2 + (NH4 )2 SO3 + H2O ?? 2 NH4 НSO3
Слайд 51Очистка отходящих газов от оксидов азота
Адсорбционные методы
Слайд 52Каталитическое восстановление
Одним из основных, хорошо освоенных промышленных методов очистки отходящих
Слайд 53Наиболее широкое распространение получило селективное каталитическое восстановление оксидов азота аммиаком:
6
6 NO2 + 8NH3 ? 7 N2 + 12 H2O.
В нашей стране для этих целей разработан специальный алюмо-ванадиевый катализатор (АВК-10). Процесс восстановления протекает при 200-3600С, степень очистки составляет 96-98,5%. Основным недостатком метода является необходимость точного дозирования аммиака, что при переменном составе отходящих газов (меняется концентрация оксидов азота) практически невозможно. При недостатке аммиака происходит проскок оксидов азота, а при избытке – проскок аммиака, и отходящие газы загрязняются токсичными соединениями.
Слайд 54Карбамидный метод
В РХТУ им. Д.И. Менделеева разработан Карбамидный метод, позволяющий
В общем виде процесс описывается приведенными ниже уравнениями реакций:
Н2О
NO + NO2 + (NH2)2CO ? 2 Н2О + СО2 + 2 N2,
SO2 + (NH2)2CO + 2 Н2О + 1/2 О2 ? (NH4)2SO4 + СО2
Слайд 55Рис…Схема установки для очистки дымовых газов от оксидов азота и серы
1 – электрофильтр; 2 и 3 – распылительные сушилки; 4 – циклон; 5 – емкость для суспензии CaSO3 и Ca(OH)2; 6 – емкость для суспензии Ca(OH)2; 7 – реакционный аппарат; 8 – абсорбер; 9 – емкость для рабочего раствора карбамида; 10 – емкость для концентрированного раствора карбамида.
Слайд 56Снижение выбросов оксидов азота в атмосферу путем регулирования процесса горения
Наряду с
сжигание с низким коэффициентом избытка воздуха (а – альфа);
рециркуляция части дымовых газов в зону горения;
сжигание топлива в две и три ступени;
применение горелок, позволяющих понизить выход NOх;
подача влаги в зону горения;
интенсификация излучения в топочной камере;
выбор профиля топочной камеры, которому отвечает наименьший выход NOх.
Следует отметить, что указанные мероприятия способны в той или иной мере подавить образование NOх из азота воздуха, но не могут предотвратить их образования из азотосодержащих соединений, имеющихся в составе топлива.
Слайд 57Очистка отходящих газов от фтор- и хлорсодержащих соединений
Очистка от фторсодержащих газов
Очистка отходящих газов от оксида углерода и углеводородов
Основным методом очистки от углеводородов и оксида углерода в промышленности являются сжигание в пламени, а также термическое и каталитическое окисление. Наиболее известным примером сжигания является широко применяемое в нефтедобывающей и нефтеперерабатывающей промышленности сжигание в факеле, т.е. в открытой горелке, направленной вверх. К недостаткам процесса, помимо потерь углеводородов при горении следует отнести образование оксидов азота, а следовательно, вторичное загрязнение атмосферы.
Слайд 58В условиях термического и каталитического окисления обезвреживание углеводородов и оксида углерода
Термокаталитический реактор (ТКР- КС-1):
1 – входной патрубок,
2 – корпус,
3 – рекуператор тепла,
4 – кассета фильтра,
5 – теплоэлектро-нагреватели,
6 – съемные кассеты,
7,8 – боковая и верхняя крышки,
9 – защитный кожух,
10 – бункер,
11 – опора.
Слайд 60Рис.6.7. Мусоросжигательный завод № 2:
– приемное отделение; 2 – приемный бункер
3 – котлоагрегат; 4, 5, 6 – отделение газоочистки; 7, 8 – шлаковое отделение; 9 – загрузка ТБО в печь.
Слайд 61Рис.6.9. Мусоросжигательный завод № 4:
1 – печь для сжигания отходов; 2
4 – циклон; 5 – распылительный абсорбер; 6 – реактор с активированным углем; 7 – рукавный фильтр; 8 – турбогенератор; 9 – контроль дымовых газов; 10 – дымовая труба.