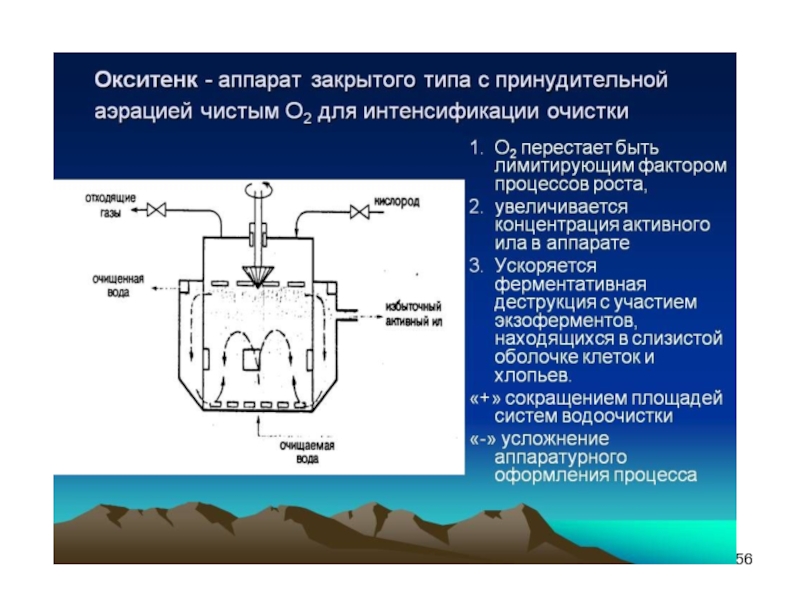
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Распределение выбросов производственной пыли презентация
Содержание
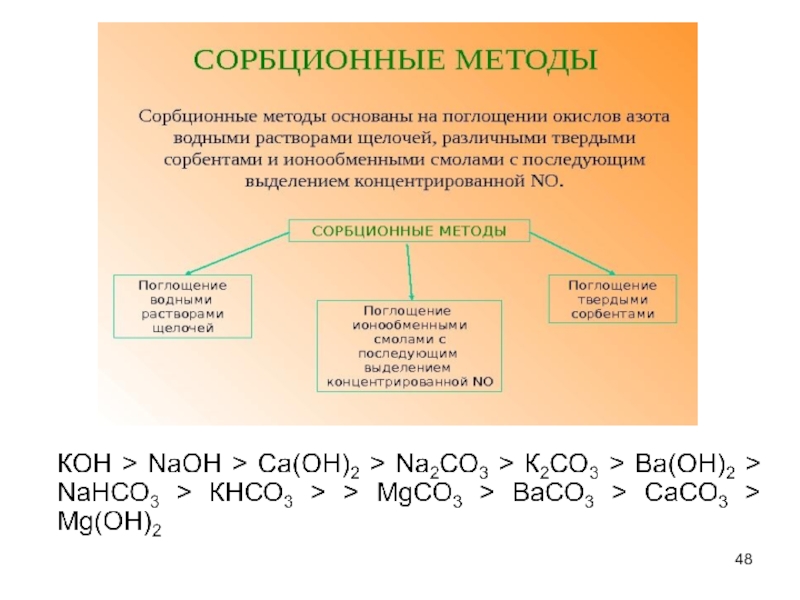
- 3. Распределение выбросов производственной пыли, % строительные материалы
- 4. Пылевые частицы имеют большую суммарную поверхность (высокую
- 5. Частицы промышленной пыли имеют разнообразную форму и
- 6. 4 группы современных аппаратов для обеспыливания
- 7. Механические обеспыливающие устройства используются для предварительной очистки
- 8. Простейшие аппараты - осадительные камеры. Для освобождения
- 9. Распростанены мокрый (гидравлический) способ очистки промышленных газов
- 10. Мокрая очистка В полых и насадочных аппаратах
- 12. Мокрая очистка В барботажных и пенных аппаратах
- 13. Мокрая очистка Мокрые газоочистные аппараты ударно- инерционного
- 14. Фильтрация через пористые перегородки Высокая степень очистки,
- 15. Промышленные фильтры условно делят на два класса:
- 16. Зернистые фильтры Возможность работы в агрессивных средах
- 17. Различают фильтры насыпные с неподвижным фильтрующим веществом
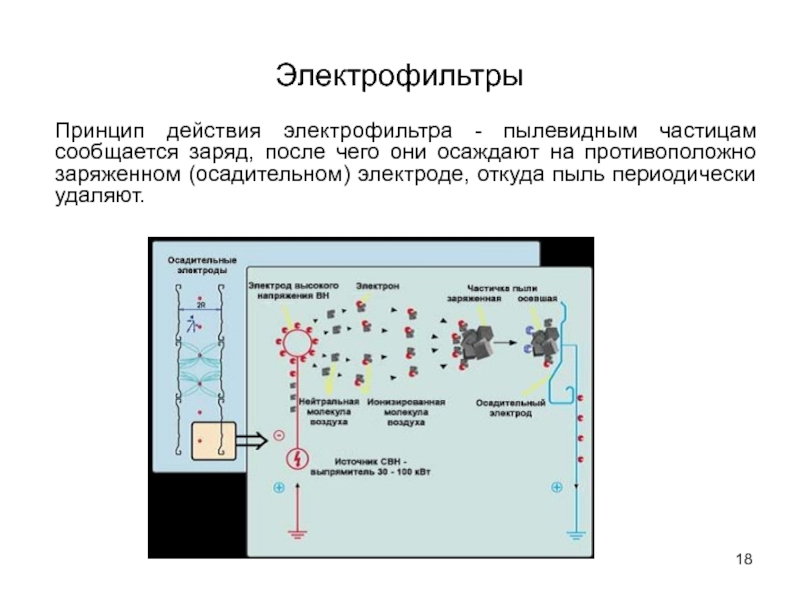
- 18. Электрофильтры Принцип действия электрофильтра - пылевидным частицам
- 19. В сухих электрофильтрах улавливают твердые частицы, которые
- 20. Очистка атмосферных выбросов от кислых компонентов.
- 21. Очистка газов от оксидов углерода. 1.
- 22. Очистка газов от диоксида серы Диоксид серы
- 23. Очистка газов от диоксида серы Три основные
- 24. Аммиачный метод NH4OH + S02 + Н20
- 25. 2)методы нейтрализации - высокая степень очистки газов,
- 26. Метод нейтрализации Содовый метод - пропускание отходящих
- 27. Метод нейтрализации При очистке отходящих газов сернокислотной
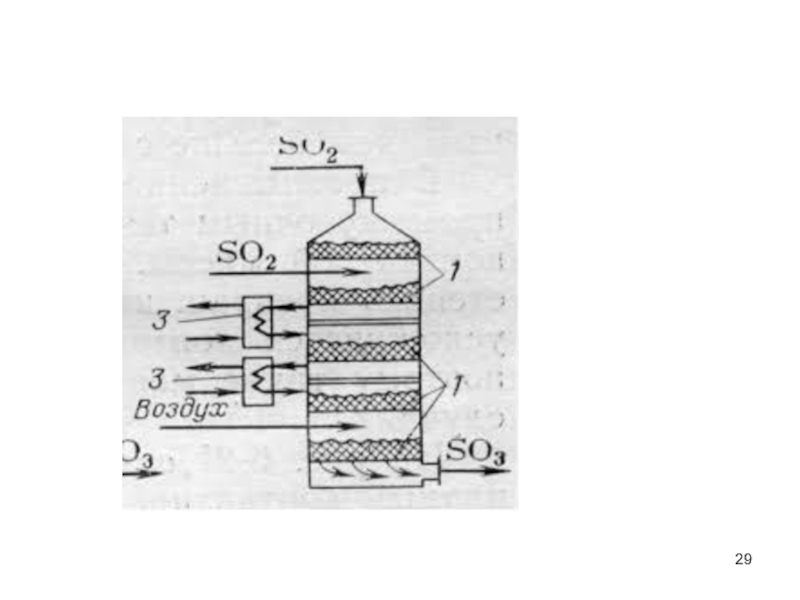
- 28. 3) методы каталитического окисления S02 до S03
- 30. Очистка отходящих газов от сероводорода Сероводород
- 31. Окислительные методы Поглощение H2S водными растворами Na2CO3,
- 32. 2Н2S + 02 = 2Н2О + 2S
- 33. Фосфатный метод Для газов содержащих смесь СО2
- 34. При пропускании газов через слой болотной руды
- 35. Очистка отходящих газов от оксидов азота Наиболее
- 36. Классы методов очистки газов от соединений азота
- 37. Окислительные методы Основаны на окислении оксида азота
- 38. Для интенсификации процесса улавливания оксидов азота используют
- 39. Альтернативные окислители Скорость процесса окисления NО существенно
- 41. Аппараты Высокие скорости процесса достигаются в полых
- 42. Катализаторы Эффективность очистки отходящих газов, скорость окисления
- 43. Восстановительные методы Восстановление до нейтральных продуктов жидкими
- 44. Процессы NO С возрастанием температуры идет обратный процесс:
- 45. Наиболее высокой каталитической активностью отличаются катализаторы на
- 46. Восстановители В качестве восстановителей в очистных сооружениях
- 47. Схемы реакции Восстановление оксидов азота протекает по
- 49. Очистка отходящих газов от аммиака. Аммиак NН3,
- 50. Способы очистки Простейшим способом очистки отходящих газов
- 52. Очистка отходящих газов от галогенов и
- 54. Сухая очистка от НF В качестве сухих
- 55. Мокрая очистка от НF В основе очистки
- 56. Основные источники поступления хлора и его соединений
- 57. Способы очистки от хлора Абсорбционные Хемосорбционные
- 58. Проблемы выделения НСl НСl выделяют абсорбцией водой
- 59. Недостатком поглощения НСl водой в насадочных
- 60. Проблема утилизации НСl Утилизация НСl отходящих газов
- 61. Очистка отходящих газов от углеводородов Для рекуперации
- 62. Источники поступления Hg в атмосферу 1.Предприятия цветной
- 63. Очистка от ртути Для предварительной очистки концентрированных
- 64. Высокотемпературное обезвреживание газов Прямое сжигание применяют для
- 66. Тема 4. ОЧИСТКА СТОЧНЫХ ВОД Методы очистки
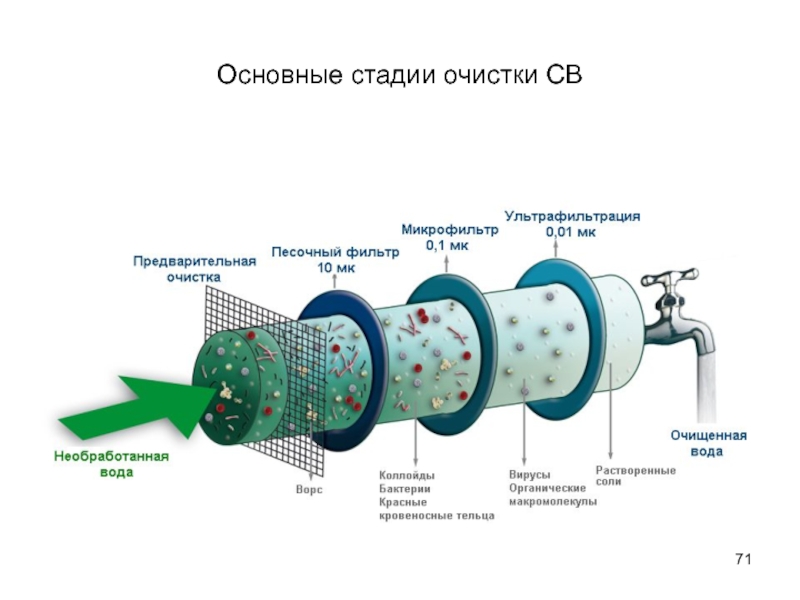
- 67. Основные стадии очистки сточных вод механическая очистка,
- 68. Основные методы очистки сточных вод для удаления
- 69. Основные методы очистки сточных вод 4) для
- 70. Очистка сточных вод от взвешенных частиц Сравнительно
- 71. Основные стадии очистки СВ
- 72. Песколовки После процеживания сточные воды поступают в
- 73. При движении воды в резервуаре песколовки на
- 74. Для выделения более мелких органических и минеральных
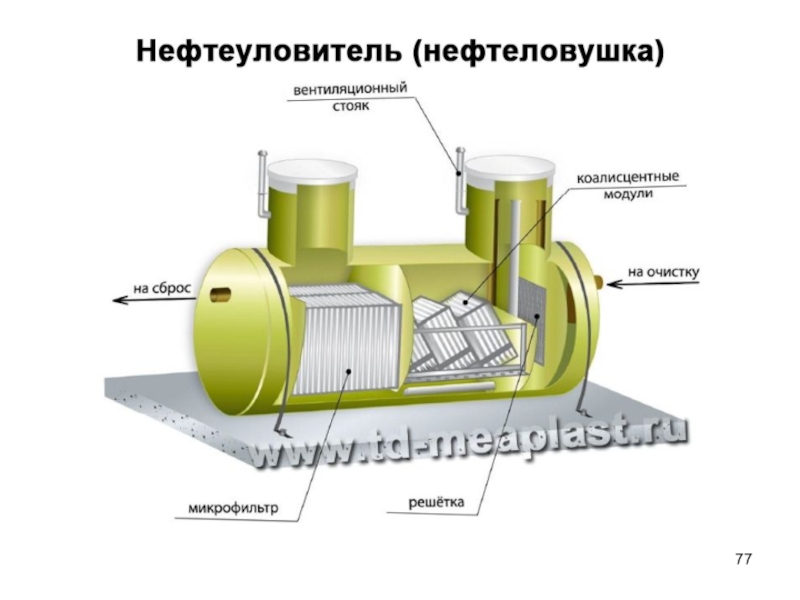
- 76. Для удаления всплывающих примесей: масел, жиров, смол,
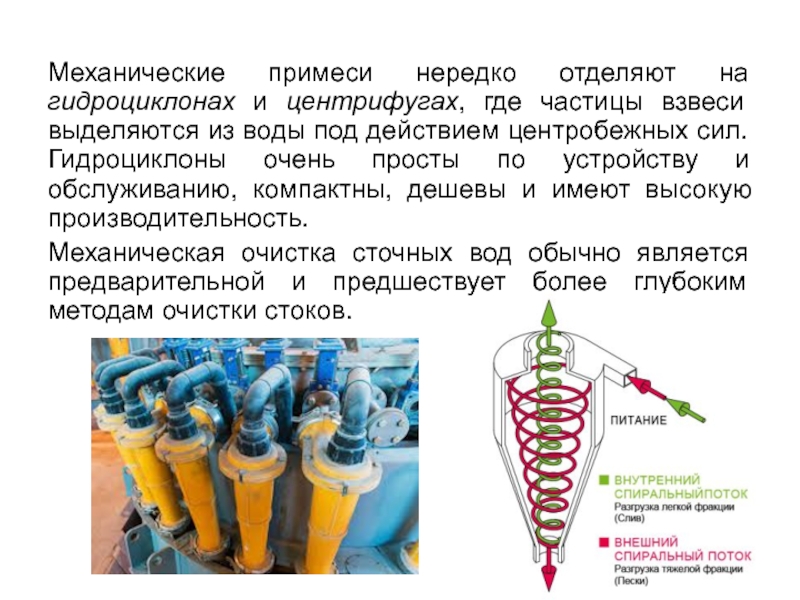
- 78. Механические примеси нередко отделяют на гидроциклонах и
- 79. Для отделения тонкодиспергированных твердых или жидких веществ,
- 80. Физико-химические методы очистки сточных вод ФХ
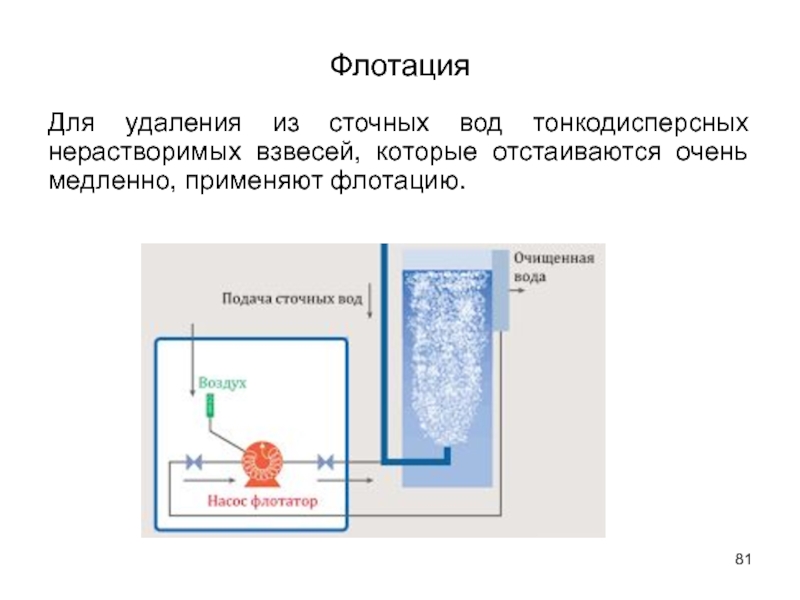
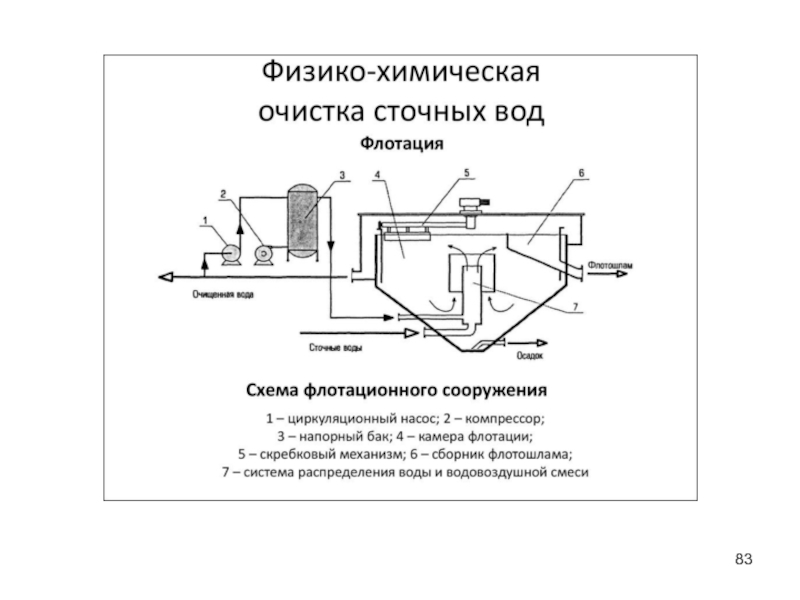
- 81. Флотация Для удаления из сточных вод тонкодисперсных нерастворимых взвесей, которые отстаиваются очень медленно, применяют флотацию.
- 82. Флотация Флотационные установки широко применяют для очистки
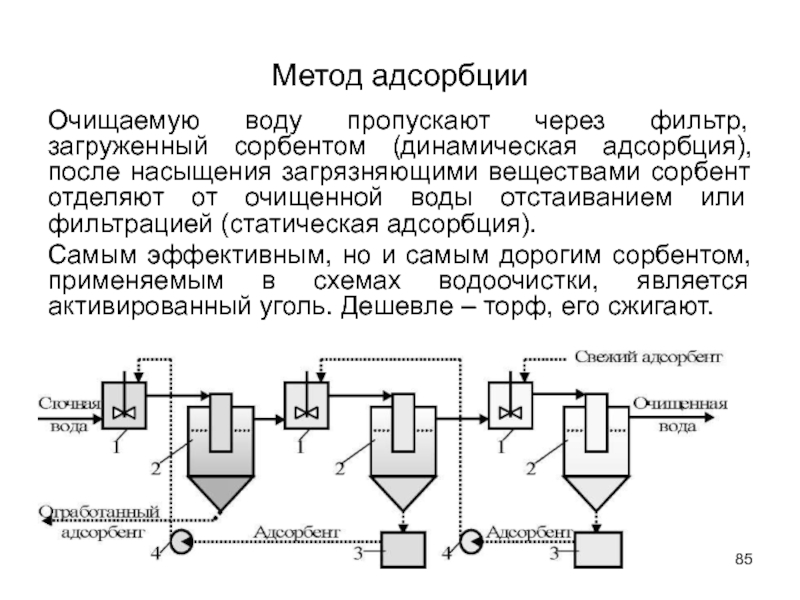
- 84. Метод адсорбции Для глубокой очистки сточных вод
- 85. Метод адсорбции Очищаемую воду пропускают через фильтр,
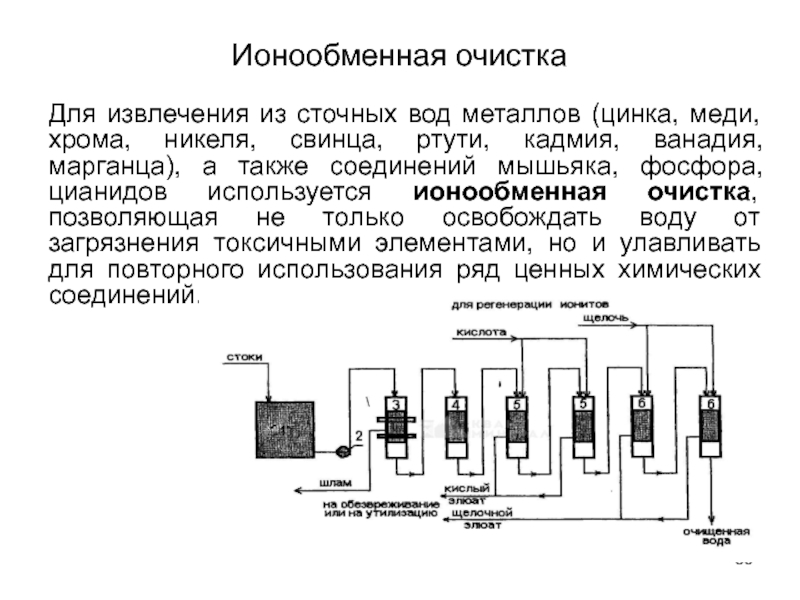
- 86. Ионообменная очистка Для извлечения из сточных вод
- 87. В процессах водоочистки используют природные неорганические и
- 89. Ионообменные смолы В водоочистных сооружениях - синтетические
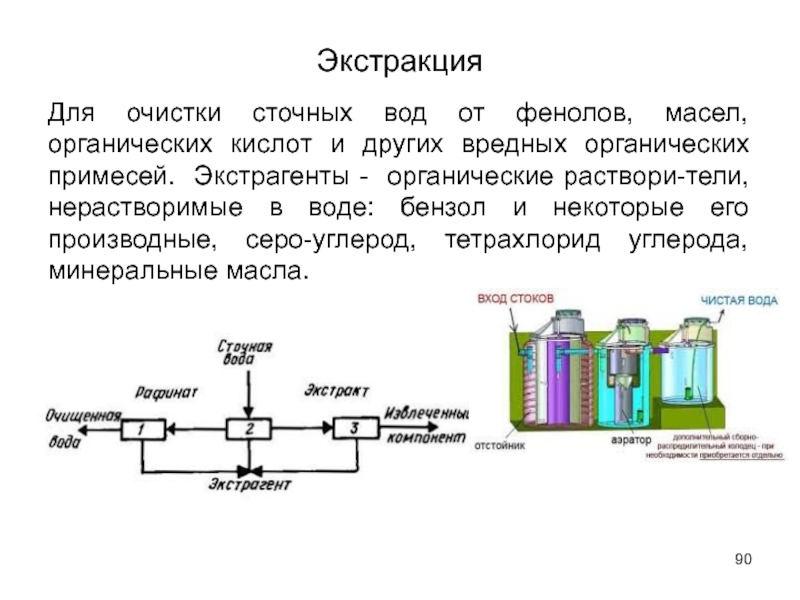
- 90. Экстракция Для очистки сточных вод от фенолов,
- 91. Требования к экстрагенту: 1) растворять извлекаемое
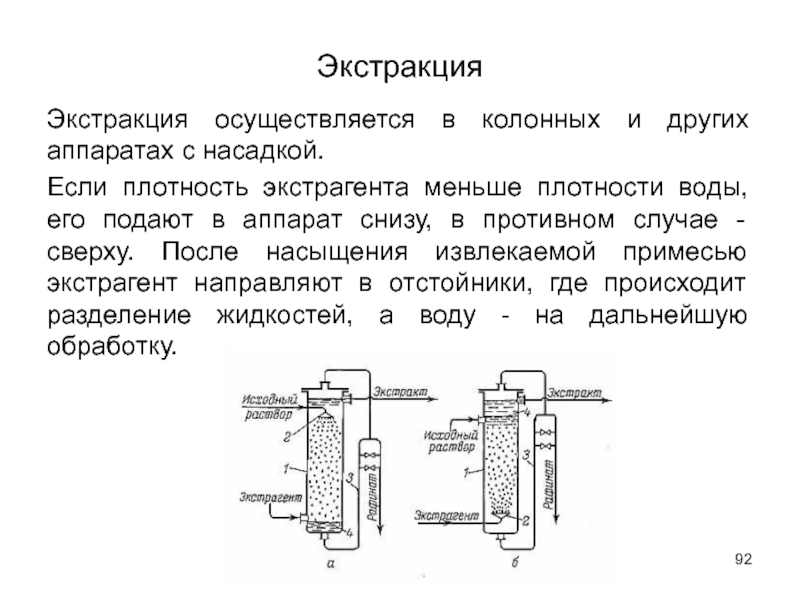
- 92. Экстракция Экстракция осуществляется в колонных и других
- 93. Целесообразность Определяется ценностью извлекаемых примесей и их
- 94. Эвапорация и десорбция Сточные воды с летучими
- 95. Десорбцию летучих примесей инертными малорастворимыми газами (азот,
- 96. Аэрация Если сточные воды содержат дурно пахнущие
- 97. Метод аэрации заключается в продувании воздуха через
- 98. Коагуляция и флокуляция Эти методы требуют расхода
- 99. В процессах водоочистки в качестве коагулянтов используют
- 100. Метод коагулирования широко применяется при очистке сточных
- 101. Флокуляция Процесс агрегации взвешенных частиц при добавлении
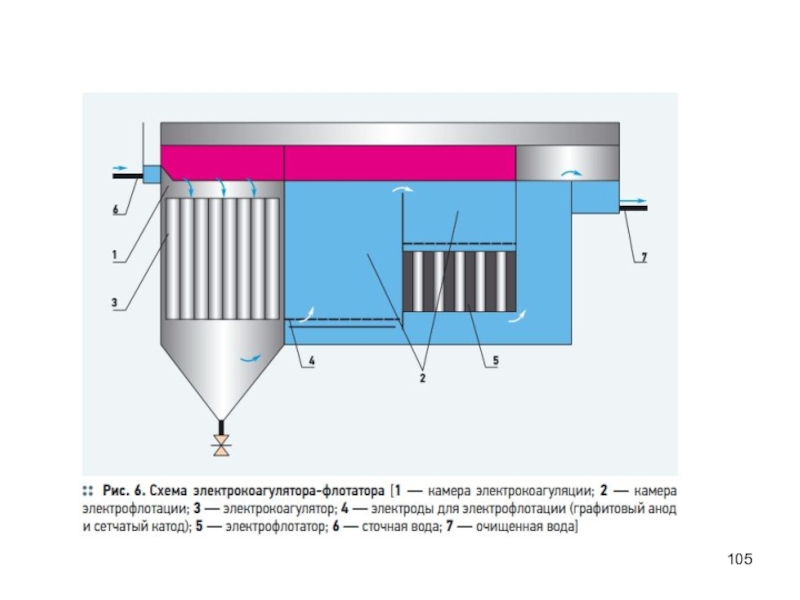
- 103. Электрохимические методы очистки сточных вод Электрофлотация,
- 106. Процессы анодного окисления разработаны для очистки сточных
- 107. Химические методы очистки сточных вод Нейтрализация загрязняющих
- 108. Способы проведения нейтрализации смешение кислых и щелочных
- 110. Реагенты Для нейтрализации кислых сточных вод в
- 111. Очистка сточных вод с помощью окислителей
- 112. Окислители В качестве окислителей используют хлор, озон
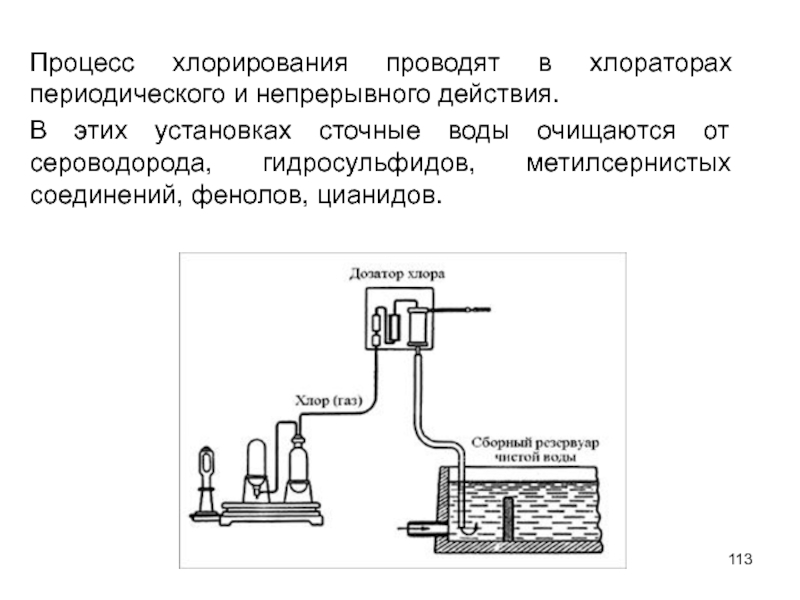
- 113. Процесс хлорирования проводят в хлораторах периодического и
- 114. Очистка от цианидов При обезвреживании вод от
- 115. В двухступенчатом процессе цианиды окисляются до N2
- 116. Пероксид водорода Окислитель - пероксид водорода легко
- 117. Пероксид водорода В процессах водообработки используют и
- 118. Окисление кислородом воздуха Используют при очистке сточной
- 119. Окисление кислородом воздуха Кислородом воздуха окисляют также
- 120. Окисление пиролюзитом Для очистки промышленных стоков
- 121. Озонирование От фенолов, нефтепродуктов, сероводорода, соединений мышьяка,
- 122. Озонирование В сточную воду озон подают в
- 124. Восстановительная очистка Используются для сточных вод, содержащих
- 125. Восстановители В качестве восстановителей используют активированный уголь,
- 126. Очистка от соединений Сr и Hg 4Н2Сr04
- 127. Удаление тяжелых металлов Hg, Cr, Cd,Co, Zn,
- 128. Осадение ионов металлов В качестве реагентов для
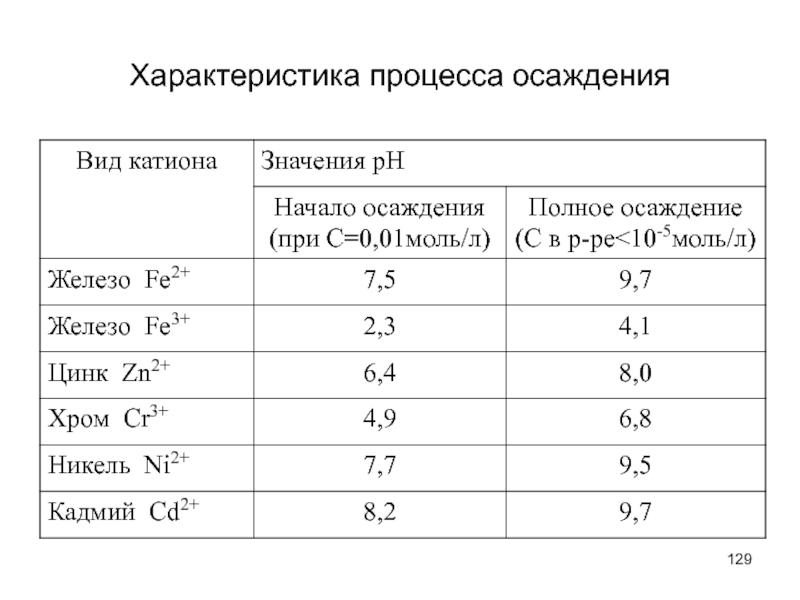
- 129. Характеристика процесса осаждения
- 130. Очистка от соединений ртути Неорганические соединения ртути
- 131. Органические соединения Hg Органические соединения ртути применяют
- 132. Очистка от металлической Hg Металлическая ртуть может
- 133. Очистка от неорганической ртути Для удаления из
- 134. Органические соединения Их сначала разрушают с помощью
- 135. Очистка от соединений Zn,Cu, Ni, Pb, Cd,
- 136. Общая схема выделения ионов металлов В общем
- 137. Очистка от ионов свинца Находящиеся в растворе
- 138. Концентрации ионов кобальта и кадмия в стоках
- 139. Обработка сточных вод щелочными реагентами позволяет
- 140. Очистка от солей железа В природных водах
- 141. Методы обезжелезивания вод Аэрация, реагентные методы, электродиализ, адсорбция, обратный осмос.
- 142. Аэрирование В процессе аэрирования происходит окисление двухвалентного
- 143. Реагентные методы При высоком содержании железа в
- 144. Окисление перманганатом калия проходит по уравнению
- 145. Очистка от соединений марганца Соединения марганца содержатся
- 146. При обработке воды перманганатом калия достигается одновременная
- 147. Биохимические методы очистки сточных вод Основаны на
- 148. Биохимическую очистку сточных вод можно проводить как
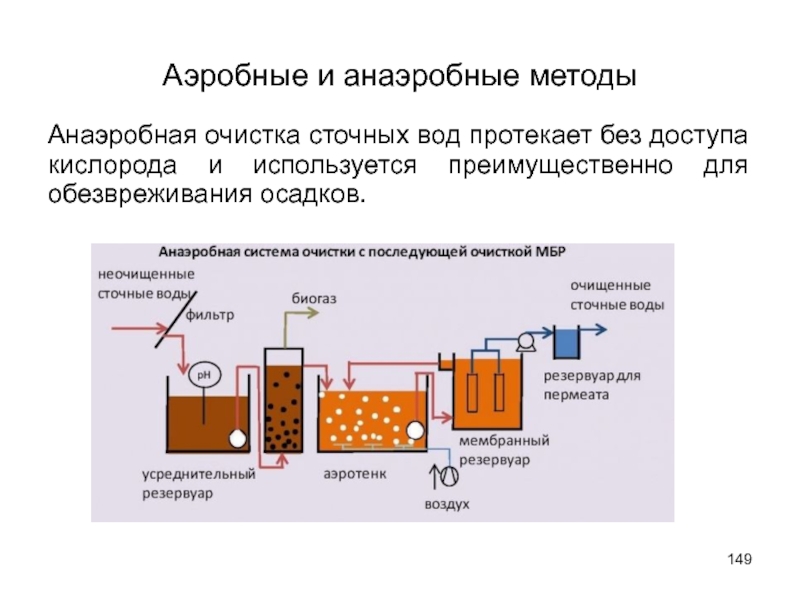
- 149. Аэробные и анаэробные методы Анаэробная очистка сточных
- 150. Аэробная очистка Для аэробной очистки используют аэробные
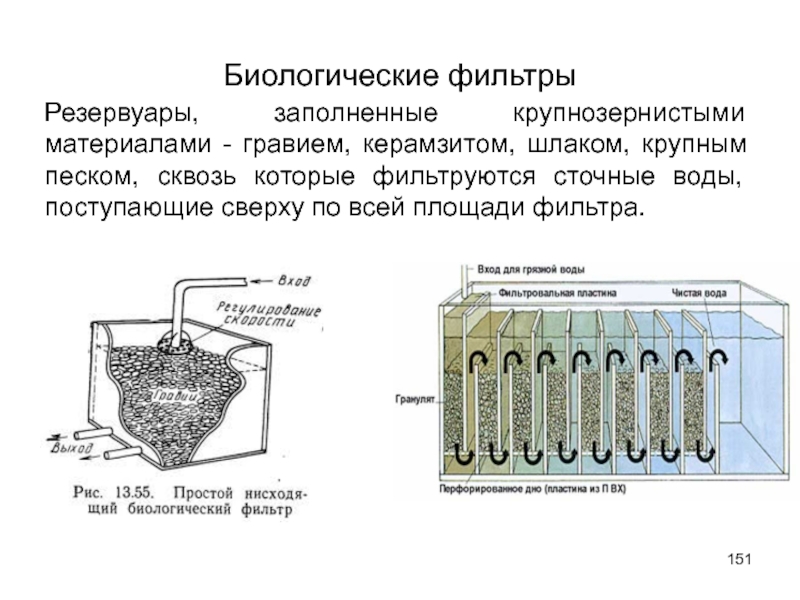
- 151. Биологические фильтры Резервуары, заполненные крупнозернистыми материалами -
- 152. Проходя сквозь загрузку биофильтра, сточные воды оставляют
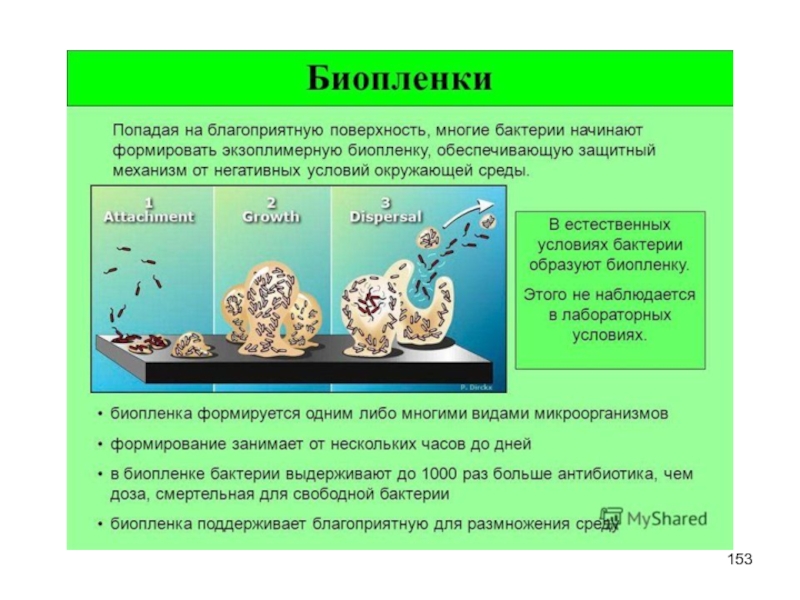
- 154. Бактерии Биоценоз активной пленки включает несколько групп
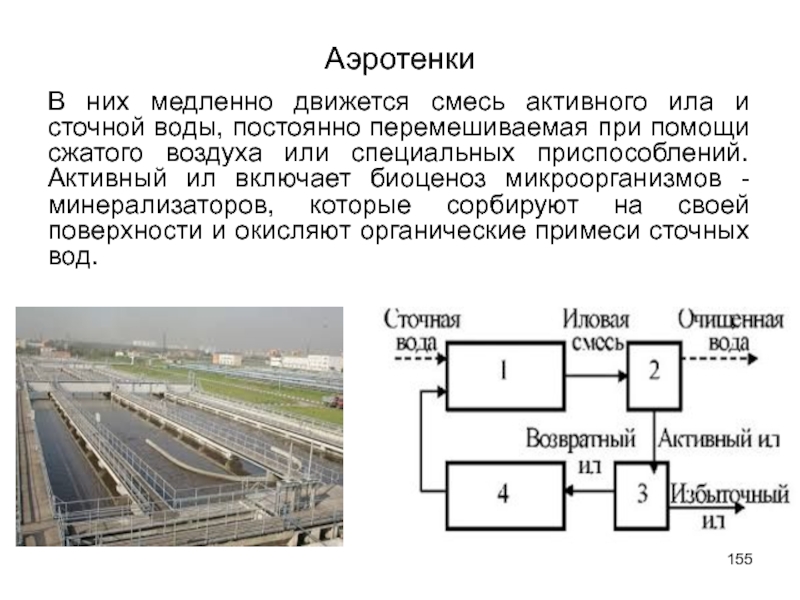
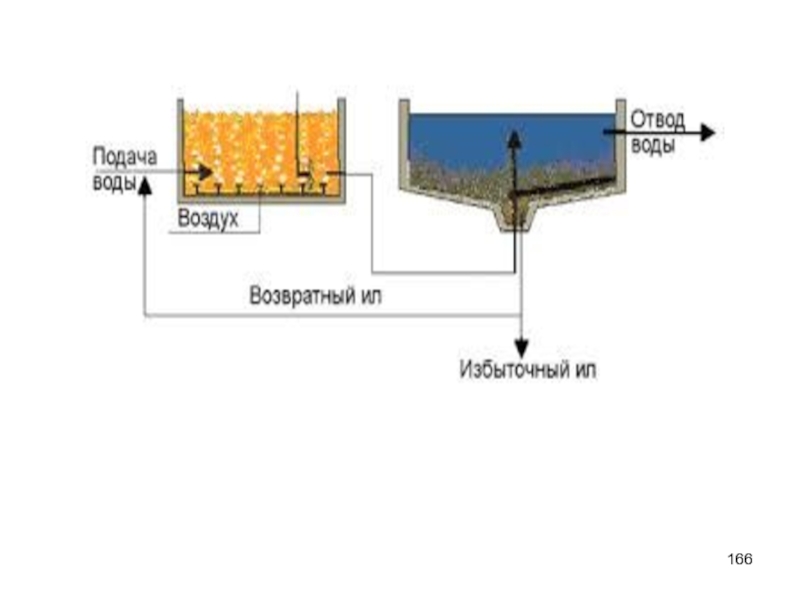
- 155. Аэротенки В них медленно движется смесь активного
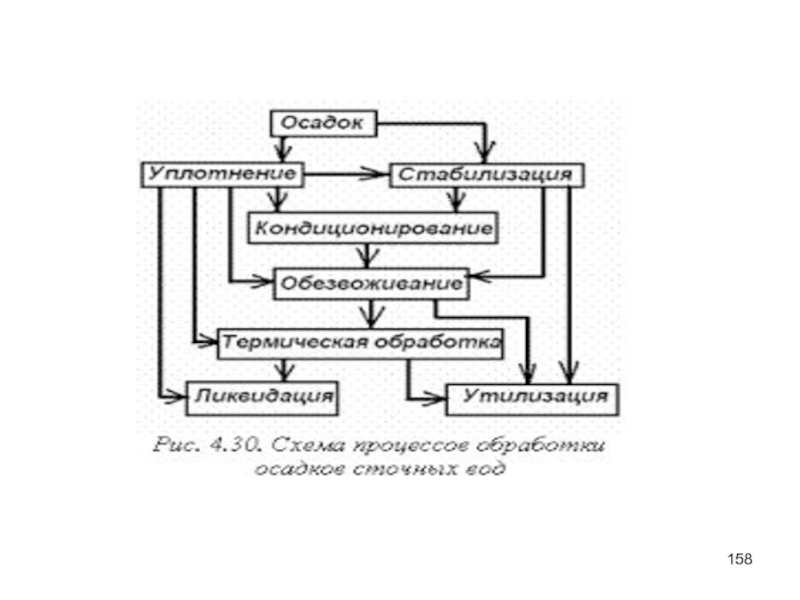
- 157. Основные проблемы В результате биохимической образуются сильно
- 159. Уплотнение осадка Обработка начинается с уплотнения осадка
- 160. Стабилизация осадка Уплотненный осадок подвергается стабилизации -
- 162. Аэробная стабилизация Это продолжительное аэрирование осадка;
- 163. Кондиционирование Стабилизированный осадок подвергают коагуляции. Далее проводят
- 164. Обезвоживание осадков Производят на иловых площадках -
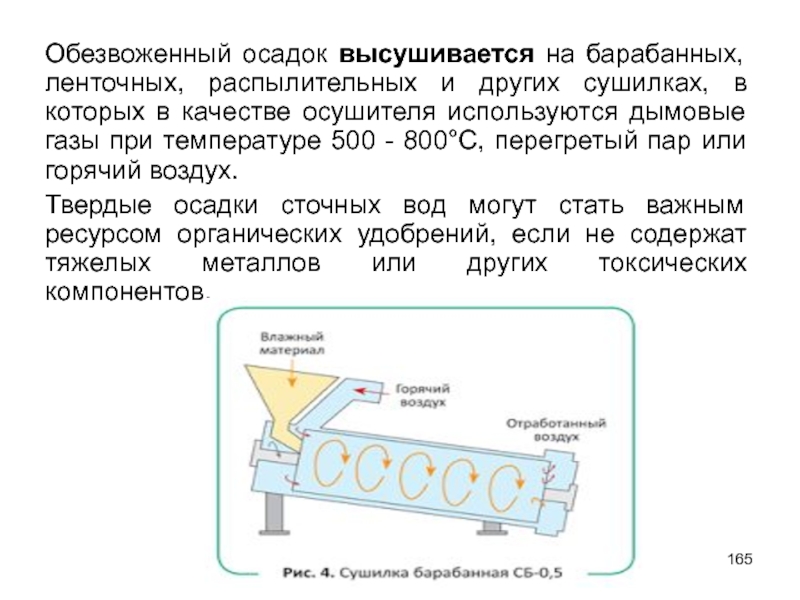
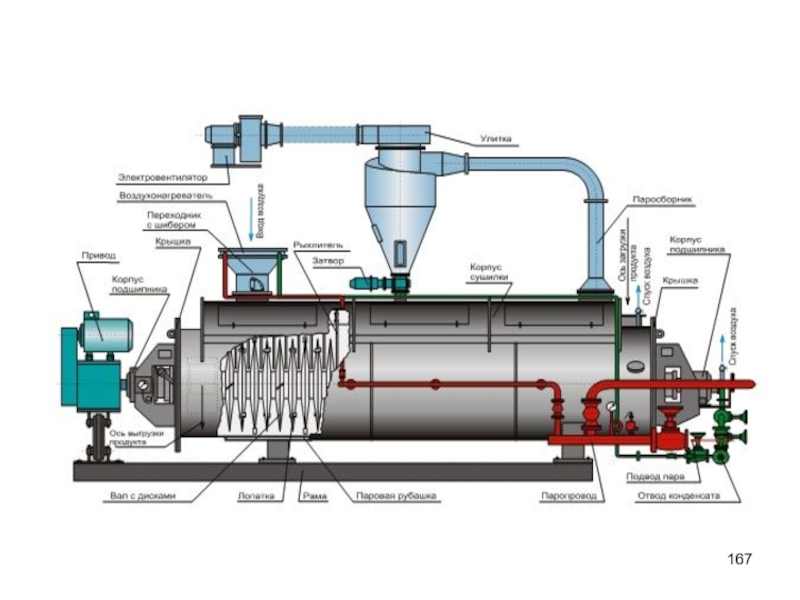
- 165. Обезвоженный осадок высушивается на барабанных, ленточных, распылительных
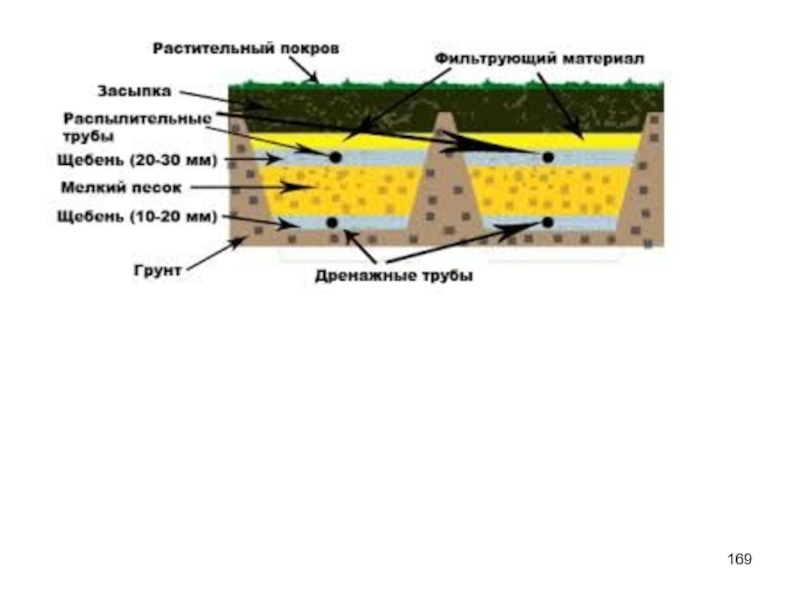
- 168. Поля фильтрации Перспективна биохимическая очистка сточных вод
- 170. Наиболее интенсивно протекают эти процессы в верхних
- 171. Поля фильтрации Используют только для биохимической очистки
- 172. ЗПО На земледельческих полях орошения очистка сточных
- 173. Для обезвреживания яиц гельминтов, содержащихся в фекальных
- 174. Биологические пруды Используется способность природных вод к
- 175. Аэробные пруды Их располагают секциями, от двух
- 176. После биологической очистки сточных вод на искусственных
- 177. Термические методы очистки сточных вод На химических
- 179. К термическим методам относятся: концентрирование сточных
- 180. Концентрирование сточных вод Используют для обезвреживания минеральных
- 181. Методы концентрирования С использованием одноступенчатых и многоступенчатых
- 182. Установки вымораживания. Данный процесс заключается в
- 183. Методы концентрирования Кристаллогидратные установки. В данном процессе
- 184. Выделение веществ из концентрированных растворов Для выделения
- 185. Кристаллизация Вещества, растворимость которых существенно возрастает с
- 186. Кристаллизация Кристаллизацию соли проводят также введением в
- 187. После кристаллизации в аппаратах любой конструкции полученные
- 188. Сушка Наиболее удобны для данного процесса распылительные
- 189. Термоокислительные методы обезвреживания По теплотворной способности химические
- 190. Метод жидкофазного окисления Этот метод очистки основан
- 191. Метод парофазного каталитического окисления Это гетерогенное каталитическое
- 192. Огневой метод Сущность метода - распыление сточных
- 193. ЗАЩИТА ЛИТОСФЕРЫ ОТ ЗАГРЯЗНЕНИЙ Твердые отходы, поступающие
- 194. Утилизация отходов горнодобывающей промышленности Исследования и полупромышленные
- 195. Серный колчедан FeS2 является потенциальным сырьем для
- 196. Породы основные и попутно извлекаемые часто содержат
- 197. Среди извлекаемых при горных работах пород нередко
- 198. Утилизация твердых отходов металлургии и энергетики Металлургические
- 199. Сталеплавильные шлаки используются в качестве оборотного продукта
- 200. По химическому составу их можно условно подразделить
- 201. Золошлаковые отходы тепловых электростанций, выход которых в
- 202. Зола некоторых углей и нефтей содержит многие
- 203. В зависимости от концентрации металлов в золе
- 204. Утилизация твердых отходов химической промышленности В промышленности
- 205. При переработке и обогащении сырья в калийной
- 206. В производстве серной кислоты основными отходами являются
- 207. Опасные отходы Особо токсичные и радиоактивные отходы,
- 208. Использование промышленных и коммунально-бытовых отходов в сельском
- 209. Применение промышленных отходов для мелиорации кислых почв
- 210. В качестве известковых мелиорантов могут быть использованы
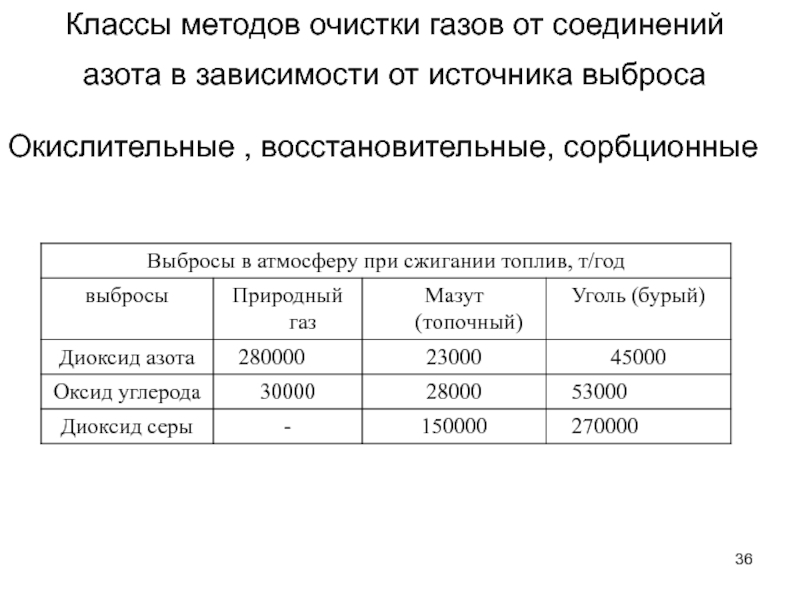
Слайд 3Распределение выбросов производственной пыли, %
строительные материалы — 34,7;
тепловые электростанции —
черная металлургия — 12,4;
химическая промышленность — 4,6; цветная металлургия — 2,2; нефтеперерабатывающая промышленность — 0,5;
прочие — 0,3
Слайд 4Пылевые частицы имеют большую суммарную поверхность (высокую биологическую и химическую активность).
Некоторые вещества в аэродисперсном состоянии приобретают новые, опасные свойства (способность взрываться).
Слайд 5Частицы промышленной пыли имеют разнообразную форму и размеры и даже при
Поэтому аппаратура пылеулавливания многообразна, хотя в ее основе лежат немногие основные принципы
Слайд 64 группы современных аппаратов
для обеспыливания отходящих газов
механические обеспыливающие устройства, в
мокрые или гидравлические аппараты, в которых твердые частицы улавливаются жидкостью;
пористые фильтры, удерживающие тонкую пыль;
электрофильтры, в которых осаждение пыли осуществляется за счет ионизации газа и содержащихся в нем пылинок.
Слайд 7Механические обеспыливающие устройства используются для предварительной очистки отходящих газов; выбор оптимального
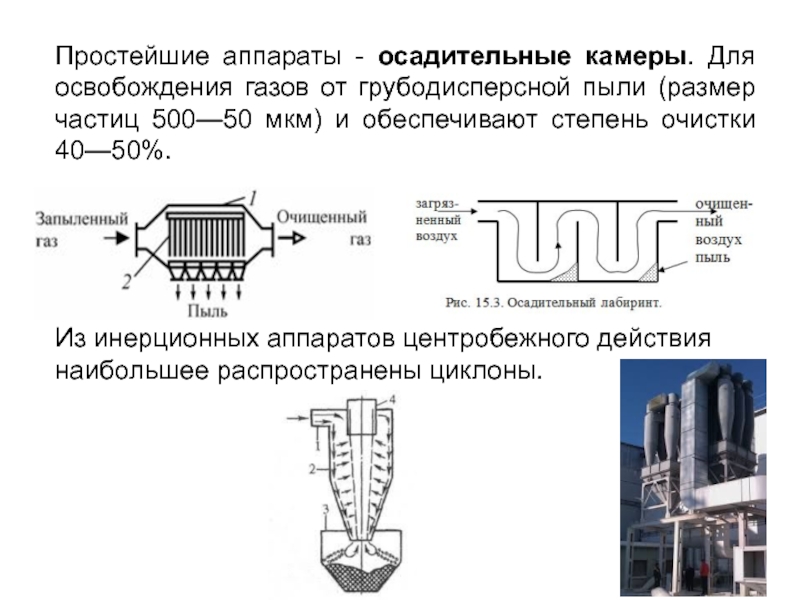
Слайд 8Простейшие аппараты - осадительные камеры. Для освобождения газов от грубодисперсной пыли
Из инерционных аппаратов центробежного действия наибольшее распространены циклоны.
Слайд 9Распростанены мокрый (гидравлический) способ очистки промышленных газов от пыли, имеющий высокую
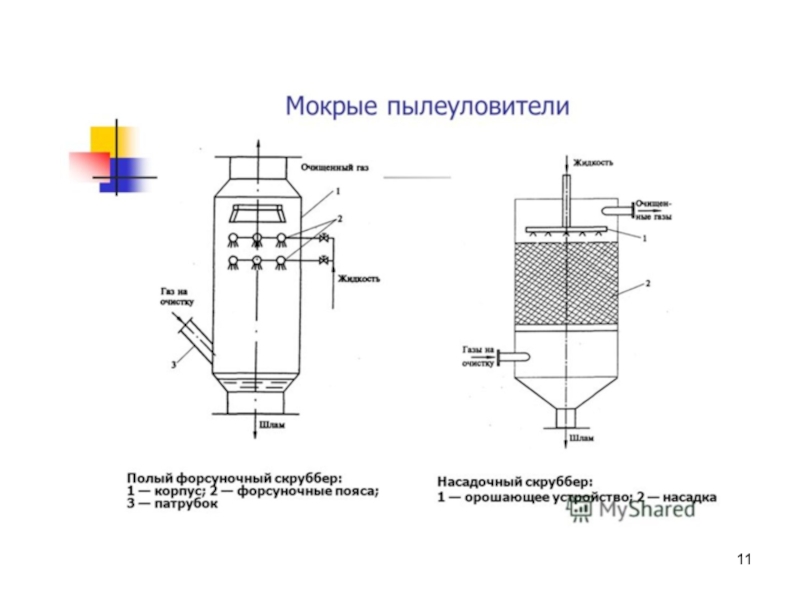
Слайд 10Мокрая очистка
В полых и насадочных аппаратах запыленные газы пропускают через поток
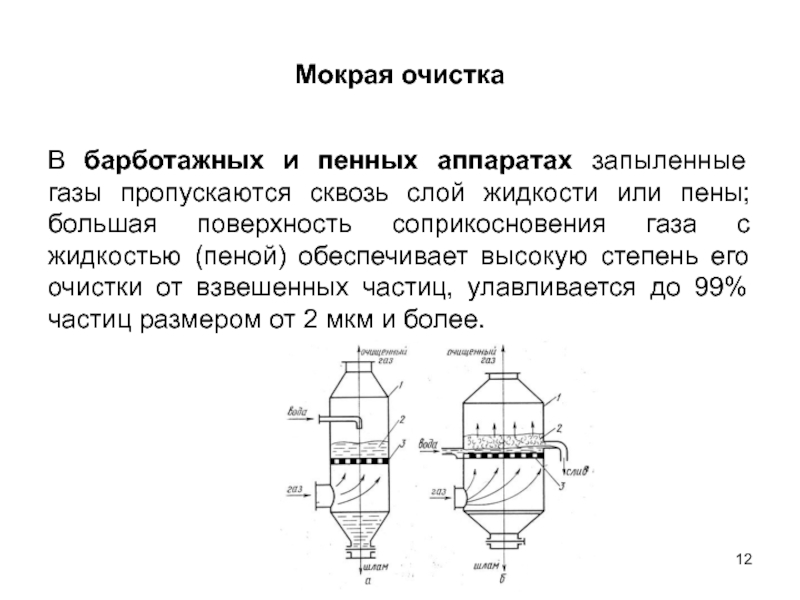
Слайд 12Мокрая очистка
В барботажных и пенных аппаратах запыленные газы пропускаются сквозь слой
Слайд 13Мокрая очистка
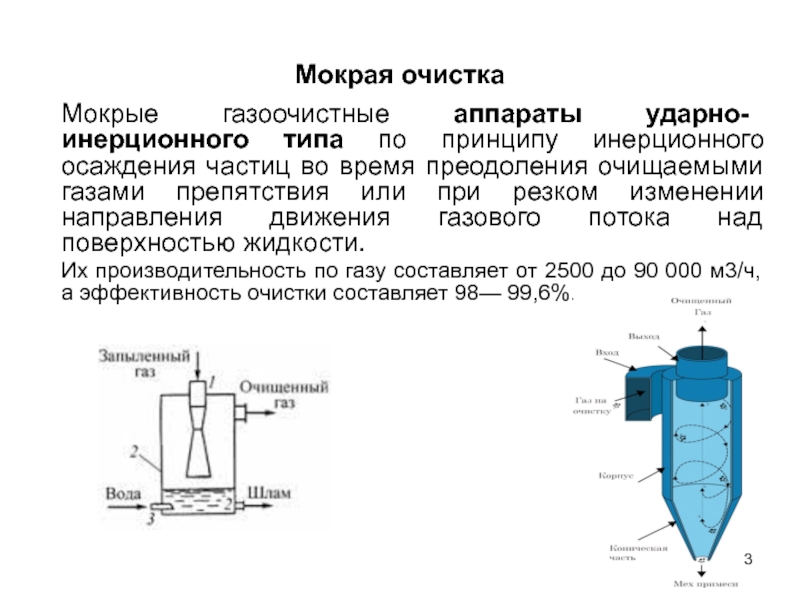
Мокрые газоочистные аппараты ударно- инерционного типа по принципу инерционного осаждения
Их производительность по газу составляет от 2500 до 90 000 м3/ч, а эффективность очистки составляет 98— 99,6%.
Слайд 14Фильтрация через пористые перегородки
Высокая степень очистки, чем сухое или мокрое пылеулавливание;
Недостаток: необходимая регенерация фильтра
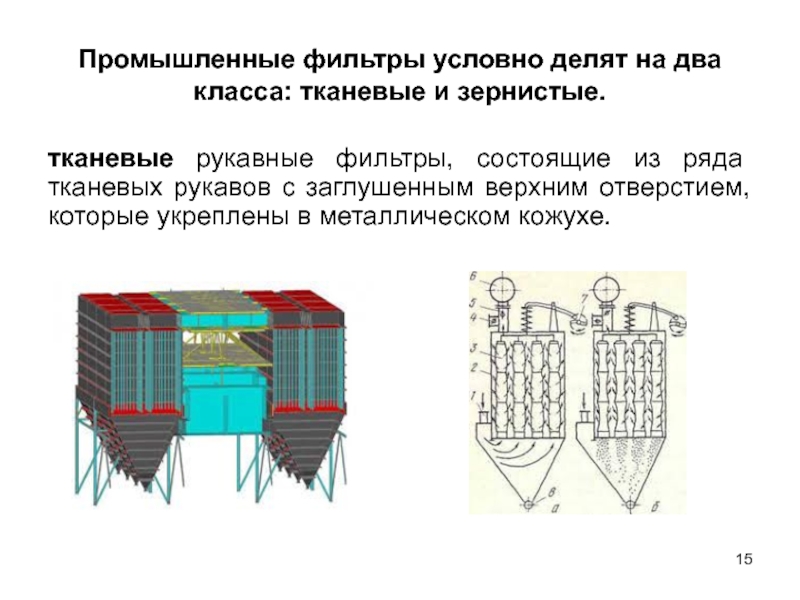
Слайд 15Промышленные фильтры условно делят на два класса: тканевые и зернистые.
тканевые рукавные
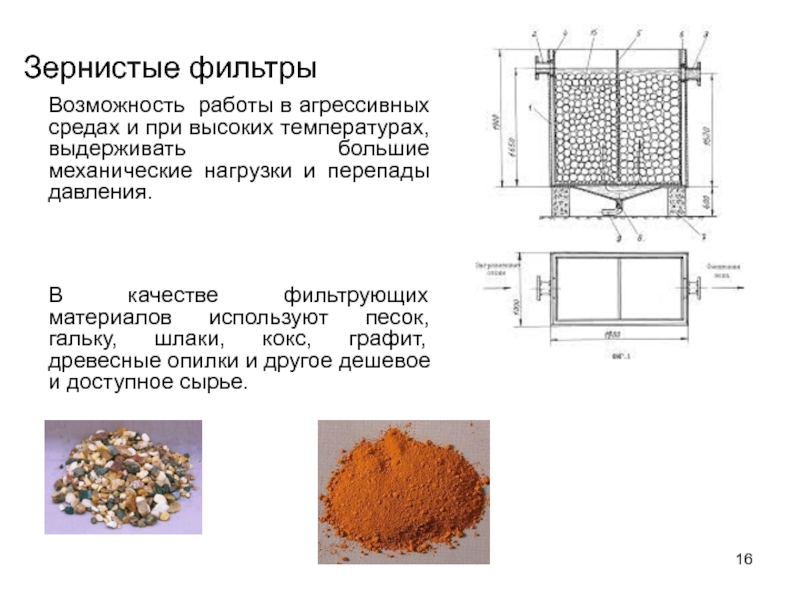
Слайд 16Зернистые фильтры
Возможность работы в агрессивных средах и при высоких температурах, выдерживать
В качестве фильтрующих материалов используют песок, гальку, шлаки, кокс, графит, древесные опилки и другое дешевое и доступное сырье.
.
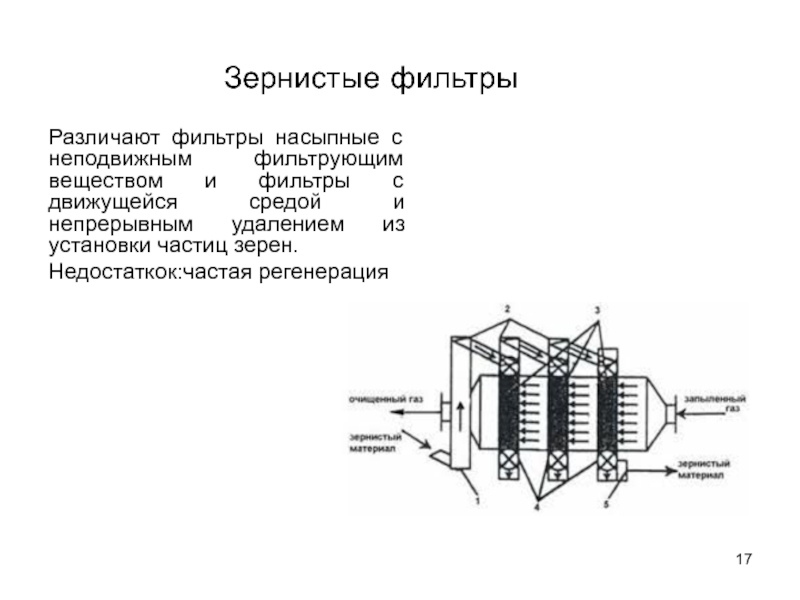
Слайд 17Различают фильтры насыпные с неподвижным фильтрующим веществом и фильтры с движущейся
Недостаткок:частая регенерация
Слайд 18Электрофильтры
Принцип действия электрофильтра - пылевидным частицам сообщается заряд, после чего они
Слайд 19В сухих электрофильтрах улавливают твердые частицы, которые удаляются с осадительного электрода
В мокрых электрофильтрах можно улавливать не только твердые, но и жидкие примеси отходящих газов (туманы) которые смываются с поверхности электродов водой.
Слайд 20Очистка атмосферных выбросов от кислых компонентов.
Основные методы очистки:
Адсорбционные методы основаны
Абсорбционные методы очистки газов основываются на физической сорбции компонентов отходящих газов твердыми телами.
Каталитические методы основаны на каталитических реакциях окисления или восстановления кислых компонентов с последующим их выделением.
Слайд 21Очистка газов от оксидов углерода.
1. Поглощение СО2 растворами этаноламинов:
2RNН2 +
(RNН3)2СО3 + С02 + Н20 = 2RNН3НСО3
2RNН2 + С02 = RNНСООNH3R
2. Поглошение СО2 холодным метанолом, цеолитами
Слайд 22Очистка газов от диоксида серы
Диоксид серы S02 оказывает сильное токсическое действие
В нашей стране на S02 установлены следующие предельно допустимые концентрации: ПДКр.з. - 10 мг/м3, ПДКм.р - 0,03 мг/м3 и ПДКс.с - 0,005 мг/м3. (рабочей зоны, максимально разовая, среднесуточная)
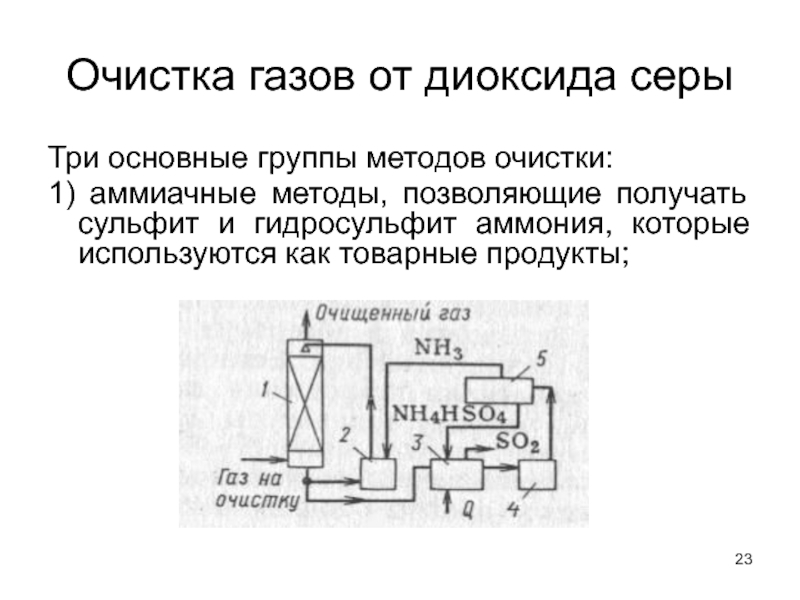
Слайд 23Очистка газов от диоксида серы
Три основные группы методов очистки:
1) аммиачные методы,
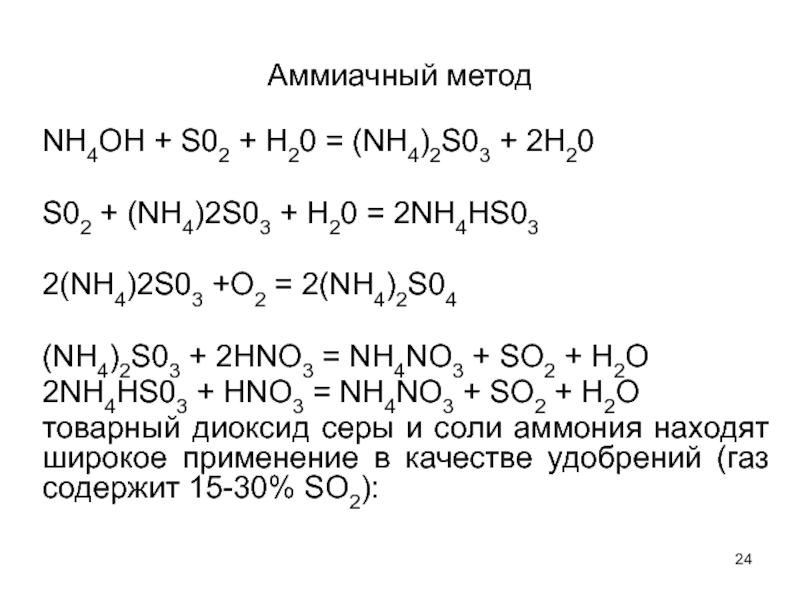
Слайд 24Аммиачный метод
NH4OH + S02 + Н20 = (NН4)2S03 + 2Н20
S02 +
2(NН4)2S03 +O2 = 2(NН4)2S04
(NН4)2S03 + 2HNO3 = NH4NO3 + SO2 + H2O
2NН4НS03 + HNO3 = NH4NO3 + SO2 + H2O
товарный диоксид серы и соли аммония находят широкое применение в качестве удобрений (газ содержит 15-30% SO2):
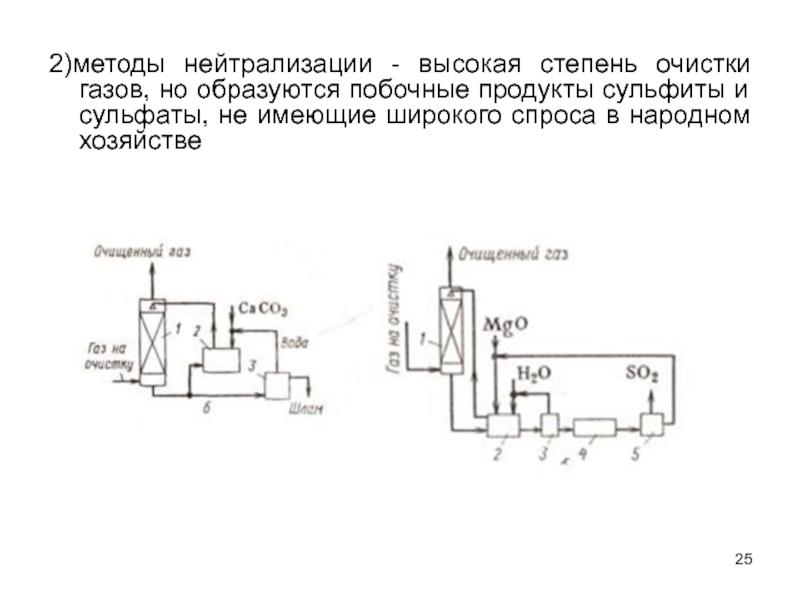
Слайд 252)методы нейтрализации - высокая степень очистки газов, но образуются побочные продукты
Слайд 26Метод нейтрализации
Содовый метод - пропускание отходящих газов через раствор соды
2Nа2СО3
2NаНСО3 + S02 → Nа2S03 + 2С02 + Н20
Nа2S03 + S02 + Н20 → 2NаНS03
Образующийся раствор взаимодействует с оксидом цинка:
NаНS03 + ZnO → ZnSO3 + NaOH
Сульфит цинка обжигают:
ZnSO3 = ZnO + S02
Слайд 27Метод нейтрализации
При очистке отходящих газов сернокислотной промышленности используется известковый метод -
Н2S04 + СаО = СаS04 + Н20
S02 + СаО + 2Н20 = СаS03 * 2Н20
СаS03 + 2Н20 + 1/202 = CaSO4 * 2Н20
Степень очистки газов известковым методом достигает 85%, а технологическое оборудование отличается простотой и надежностью
Слайд 283) методы каталитического окисления S02 до S03 с последующим получением разбавленной
В качестве катализаторов для доокисления S02 до S03 используются пиролюзит, активированный уголь и ряд других веществ,
в качестве окислителей - кислород воздуха, озон О3, надсерная кислота Н2S208.
Слайд 30Очистка отходящих газов от сероводорода
Сероводород - сильный нервно-токсичный яд, при
Слайд 31Окислительные методы
Поглощение H2S водными растворами Na2CO3, K2CO3, NH3 с последующим окислением
Слайд 322Н2S + 02 = 2Н2О + 2S
мышьяково- содовый метод
Nа4АsS502 +
Nа4Аs2S6О + 1/202 = Nа4АsS502 + S↓
Достоинства: высокая степень очистки (90 - 98%) и селективность поглощения Н2S, в присутствии больших количеств С02.
Слайд 33Фосфатный метод
Для газов содержащих смесь СО2 и Н2S:
Н2S + К3Р04 =
Для очистки газов, не содержащих С02, обычно используют 40 - 50%-ный раствор К3Р04;
в присутствии С02, во избежание осаждения гидрокарбоната - 35%-ный раствор.
Слайд 34При пропускании газов через слой болотной руды протекала реакция
Fе203 + ЗН2S
после чего через аппарат пропускали воздух:
2Fе2S3 + 302 = 2Fе203 + 6S↓
В последующем эти стадии совместили, добавляя необходимое количество кислорода или воздуха.
Слайд 35Очистка отходящих газов от оксидов азота
Наиболее устойчив в атмосферном воздухе диоксид
Слайд 36Классы методов очистки газов от соединений азота в зависимости от источника
Окислительные , восстановительные, сорбционные
Слайд 37Окислительные методы
Основаны на окислении оксида азота кислородом воздуха, озоном, водными растворами
Окисление NО до N02 проводится в газообразной или жидкой фазе с последующим получением азотной кислоты.
Окисление NО в жидкой фазе протекает с несколько меньшей скоростью, чем в газообразной, причем лимитирующей стадией процесса является скорость растворения кислорода.
Слайд 38Для интенсификации процесса улавливания оксидов азота используют более сильные окислители, чем
При введении озона в жидкую рабочую смесь протекает реакция:
2N0 + О3 + Н20 = 2НNО3
А окисление NО в газовой фазе позволяет использовать лишь один атом О в молекуле О3:
N0 + О3 = NO2 + 02
Слайд 39Альтернативные окислители
Скорость процесса окисления NО существенно возрастает при замене кислорода или
Слайд 41Аппараты
Высокие скорости процесса достигаются в полых распылительных аппаратах за счет развитой
Слайд 42Катализаторы
Эффективность очистки отходящих газов, скорость окисления NO существенно возрастают в присутствии
В качестве которых используются гранулы полиэтилена, шамот, известняк, динас, кокс, пропитанный солями Mn, Сu, Сr, доломит, оксид алюминия, стекловолокно, силикагель и др.
Слайд 43Восстановительные методы
Восстановление до нейтральных продуктов жидкими или газообразными восстановителями в присутствии
При нормальной температуре в присутствии кислорода самопроизвольно протекает процесс окисления оксида азота NО:
NО → N203 → N02 → N204 → N205
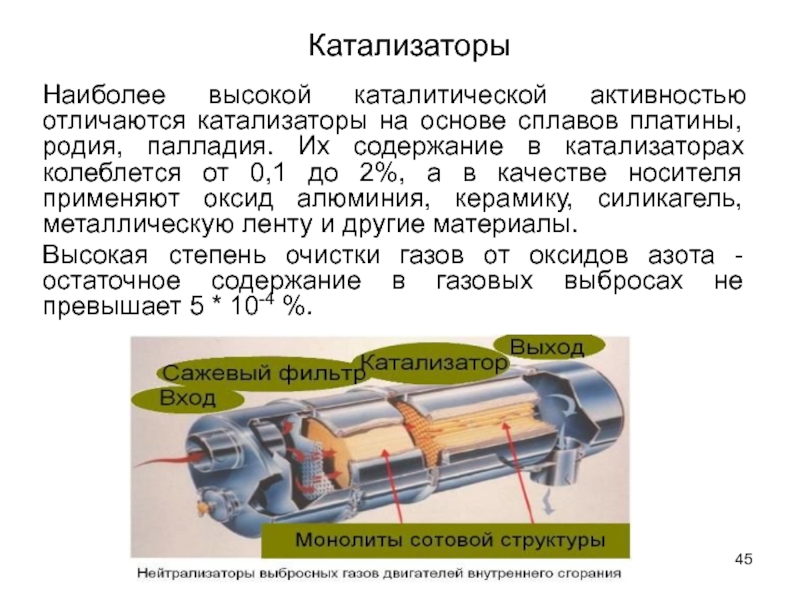
Слайд 45Наиболее высокой каталитической активностью отличаются катализаторы на основе сплавов платины, родия,
Высокая степень очистки газов от оксидов азота - остаточное содержание в газовых выбросах не превышает 5 * 10-4 %.
Катализаторы
Слайд 46Восстановители
В качестве восстановителей в очистных сооружениях используют метан, водород, природный газ,
Слайд 47Схемы реакции
Восстановление оксидов азота протекает по схемам:
4NО + СН4 = 2N2
2N02 + СН4 = N2 + С02 + 2Н20
или
2NО + 2СО = N2 + 2С02
2N02 + 4СО = N2 + 4С02
или
2NО + 2Н2 = N2 + 2Н20
2N02 + 4Н2 = N2 + 4Н20
или
6NО + 4NН3 = 5N2 + 6Н20
6N02 + 8NН3 = 7N2 + 12Н20
Слайд 49Очистка отходящих газов от аммиака.
Аммиак NН3, являющийся исходным сырьем для производства
В воздухе рабочей зоны его ПДКр.з. составляет 20 мг/м3, а в воздухе населенных пунктов ПДКм.р. и ПДКс.с. не превышают 0,2 мг/м3.
Слайд 50Способы очистки
Простейшим способом очистки отходящих газов от аммиака является его абсорбция
Иногда водную очистку дополняют доочисткой раствором серной кислоты с получением сульфата аммония:
2NНЗ + Н2S04 = (NH4)2S04
Этот процесс практически необратим и его можно проводить в простых одноступенчатых аппаратах.
Слайд 52Очистка отходящих газов от галогенов
и их соединений
Основными источниками поступления в
В дымовые газы фтор поступает в виде НF, SiF4 и тумана Н2SiF6. Для их выделения используют методы сухой и мокрой абсорбции
Слайд 54Сухая очистка от НF
В качестве сухих хемосорбентов используют известняк СаСО3, активированный
При пропускании сквозь слой молотого известняка отходящих газов протекает реакция:
2НF + СаСО3 = СаF2 + Н20 + СО2
Отработанный хемосорбент содержит 80—95% СаF2 и используется как товарный флюорит.
Степень очистки газовых выбросов от НF достигает 95%.
Слайд 55Мокрая очистка от НF
В основе очистки фторсодержащих газов методом мокрой абсорбции
Газообразный фтороводород растворяется в воде:
НF(г) +Н20 = НF(ж) = Н3О+ + F-
равновесие сильно сдвинуто вправо.
Парциальное давление НF над водным раствором очень мало и зависит от температуры и содержания НF в жидкой фазе: при повышении ее до 1 % и выше орошающая жидкость заменяется.
Слайд 56Основные источники поступления хлора и его соединений в атмосферу
1. Промышленное получение
2. Переработке руд титана, ниобия, тантала и других металлов методом хлорирующего обжига.
3.Получение соляной кислоты и многих хлорорганических соединений.
4.Печи сжигания хлорсодержащих промыш-ленных отходов и бытового мусора, содержащего полимерные материалы.
Слайд 57Способы очистки от хлора
Абсорбционные
Хемосорбционные
Сорбенты: вода, растворы щелочей, водорастворимых органических
чаще всего едкий натр, сода, известковое молоко.
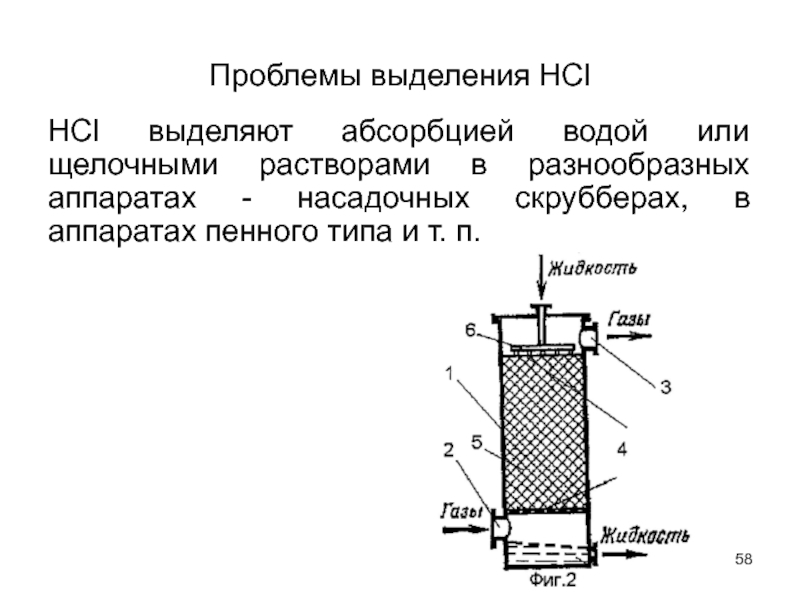
Слайд 58Проблемы выделения НСl
НСl выделяют абсорбцией водой или щелочными растворами в разнообразных
Слайд 59
Недостатком поглощения НСl водой в насадочных аппаратах является интенсивное образование тумана
Слайд 60Проблема утилизации НСl
Утилизация НСl отходящих газов представляет сложную проблему современной химической
Ряд направлений возможного использования хлороводорода из промышленных газов:
переработка в концентрированную соляную кислоту;
2) получение хлоридов некоторых металлов (СаСl2, FеСl2, ZnCl2, ВаСl2 и др.);
3) использование для целей гидрохлорирования и окислительного хлорирования органических соединений;
4) переработка в хлор методами простого и каталитического окисления, электролиза и химической конверсии
Слайд 61Очистка отходящих газов от углеводородов
Для рекуперации газообразных углеводородов и паров органических
Адсорбент - активные угли. Периодические адсорберы со стационарным слоем адсорбента работающие по четырех-, трех- и двухфазному циклам:
адсорбция
десорбция
сушка
4. охлаждение
Слайд 62Источники поступления Hg в атмосферу
1.Предприятия цветной металлургии
2.Теплоэнергетики
3.Химической и др.
В зависимости от состава и объема ртутьсодержащих выбросов их очистку проводят:
1.Физическими методами (конденсационные, абсорбционные, адсорбционные)
2.химическими (хемосорбционные) методами.
Слайд 63Очистка от ртути
Для предварительной очистки концентрированных по ртути газов используют физические
Присутствующий в сухих газовых потоках диоксид серы дезактивирует адсорбент, резко снижая его поглотительную способность по отношению к ртути.
При наличии в очищаемых газах кислорода и паров воды в адсорбенте происходит окисление SO2:
SO2 + H2O + 0,5O2 → H2SO4
Образующаяся серная кислота взаимодействует с ртутью с образованием HgSO4.
Слайд 64Высокотемпературное обезвреживание газов
Прямое сжигание применяют для обезвреживания газов от легко окисляемых
Слайд 66Тема 4. ОЧИСТКА СТОЧНЫХ ВОД
Методы очистки сточных вод можно условно подразделить
Деструктивные методы очистки сводятся к разрушению загрязняющих воду веществ путем их окисления или восстановления. Образующиеся при этом продукты распада удаляются из воды в виде осадков или газов или остаются в ней в форме растворимых минеральных солей.
Регенеративные методы позволяют извлекать и утилизировать содержащиеся в воде ценные вещества. Регенеративные методы далеко не всегда очищают воду до такого состояния, в котором ее можно сбрасывать в водоемы. В этих случаях воду доочищают деструктивными методами
Слайд 67Основные стадии очистки сточных вод
механическая очистка, предназначенная для освобождения воды от
удаление из воды растворенных в ней химических соединений физико-химическими, химическими, электрохимическими, биологическими методами.
Во многих случаях приходится применять комбинации из указанных методов
Слайд 68Основные методы очистки сточных вод
для удаления грубодисперсных частиц - отстаивание, флотация,
2) для удаления мелкодисперсных и коллоидных частиц - коагуляция, флокуляция, электрические методы осаждения;
3) для очистки от неорганических соединений - дистилляция, ионообмен, обратный осмос, реагентное осаждение, методы охлаждения, электрические методы;
Слайд 69Основные методы очистки сточных вод
4) для очистки от органических соединений -
5) для очистки от газов и паров - отдувка, нагрев, реагентные методы;
6) для уничтожения вредных веществ - термическое разложение.
Слайд 70Очистка сточных вод от взвешенных частиц
Сравнительно крупные частицы размером более 15
С этой целью на пути движения сточных вод устанавливают разнообразные решетки, сетки и сита, которые могут быть подвижными или неподвижными;
нередко их совмещают с дробилками для измельчения загрязнений.
Слайд 72Песколовки
После процеживания сточные воды поступают в песколовки, предназначенные для отделения более
Слайд 73При движении воды в резервуаре песколовки на ее дно оседают взвеси
Осадок с помощью скребков перемещается в специальный бункер, откуда удаляется на песковую площадку для обезвреживания.
Песколовки облегчают условия работы сооружений для дальнейшей очистки стоков.
Слайд 74Для выделения более мелких органических и минеральных взвесей используется метод отстаивания
первичные устанавливают перед сооружениями для биологической очистки воды,
вторичные используют для осветления сточных вод, уже прошедших биологическую очистку.
Различают отстойники периодического и непрерывного действия. По направлению движения воды они делятся на горизонтальные, вертикальные и радиальные.
Слайд 76Для удаления всплывающих примесей: масел, жиров, смол, нефти и нефтепродуктов, плавающих
Отделение этих примесей от воды осуществляется за счет разности их плотностей.
Слайд 78Механические примеси нередко отделяют на гидроциклонах и центрифугах, где частицы взвеси
Механическая очистка сточных вод обычно является предварительной и предшествует более глубоким методам очистки стоков.
Слайд 79Для отделения тонкодиспергированных твердых или жидких веществ, не осевших при отстаивании,
Слайд 80Физико-химические методы очистки
сточных вод
ФХ - методы для освобождения стоков от
Слайд 81Флотация
Для удаления из сточных вод тонкодисперсных нерастворимых взвесей, которые отстаиваются очень
Слайд 82Флотация
Флотационные установки широко применяют для очистки сточных вод нефтеперерабатывающих, целлюлозно-бумажных, кожевенных,
Слайд 84Метод адсорбции
Для глубокой очистки сточных вод от растворимых органических соединений (фенолов,
Слайд 85Метод адсорбции
Очищаемую воду пропускают через фильтр, загруженный сорбентом (динамическая адсорбция), после
Самым эффективным, но и самым дорогим сорбентом, применяемым в схемах водоочистки, является активированный уголь. Дешевле – торф, его сжигают.
Слайд 86Ионообменная очистка
Для извлечения из сточных вод металлов (цинка, меди, хрома, никеля,
Слайд 87В процессах водоочистки используют природные неорганические и органические иониты
цеолиты, глинистые минералы,
К органическим - гуминовые кислоты почв и углей.
И синтетические иониты: неорганические (силикагели и труднорастворимые оксиды и гидроксиды алюминия, хрома, циркония) и органические (главным образом ионообменные смолы).
Слайд 89Ионообменные смолы
В водоочистных сооружениях - синтетические ионообменные смолы, высокомолекулярные соединения:
при контакте
RS03Н + NаСl = RSО3Nа + НСl
при контакте с анионитом
RОН + NаСl = RСl + NаОН
В воде иониты не растворяются, а набухают, причем размеры их микропор возрастают от 0,5 - 1,0 нм до 4 нм, а объем ионита увеличивается в 1,5 - 3,0 раза. Набухание влияет на селективность ионита, так как при малом размере его пор крупные ионы не могут достичь внутренних функциональных групп.
Слайд 90Экстракция
Для очистки сточных вод от фенолов, масел, органических кислот и других
Слайд 91Требования к экстрагенту:
1) растворять извлекаемое вещество гораздо лучше, чем вода,
2) обладать хорошей селективностью по отношению к извлекаемым примесям;
3) иметь низкую растворимость в сточной воде и не образовывать с ней устойчивых эмульсий;
4) существенно отличаться от сточной воды по плотности, так как значительная разность плотностей обеспечивает быстрое и полное разделение фаз;
5) регенерироваться простым и дешевым способом;
6) не взаимодействовать с извлекаемым веществом, так как это может затруднить регенерацию экстрагента и увеличить его потери;
7) по возможности не быть токсичным и взрывоопасным и не вызывать коррозии материала аппарата.
Слайд 92Экстракция
Экстракция осуществляется в колонных и других аппаратах с насадкой.
Если плотность экстрагента
Слайд 93Целесообразность
Определяется ценностью извлекаемых примесей и их концентрацией. Для каждого вещества существует
Слайд 94Эвапорация и десорбция
Сточные воды с летучими примесями (сероводородом, сероуглеродом, аммиаком и
Эвапорацию (отгонку с водяным паром) сточных вод осуществляют в периодически действующих аппаратах или в дистилляционных колоннах непрерывного действия.
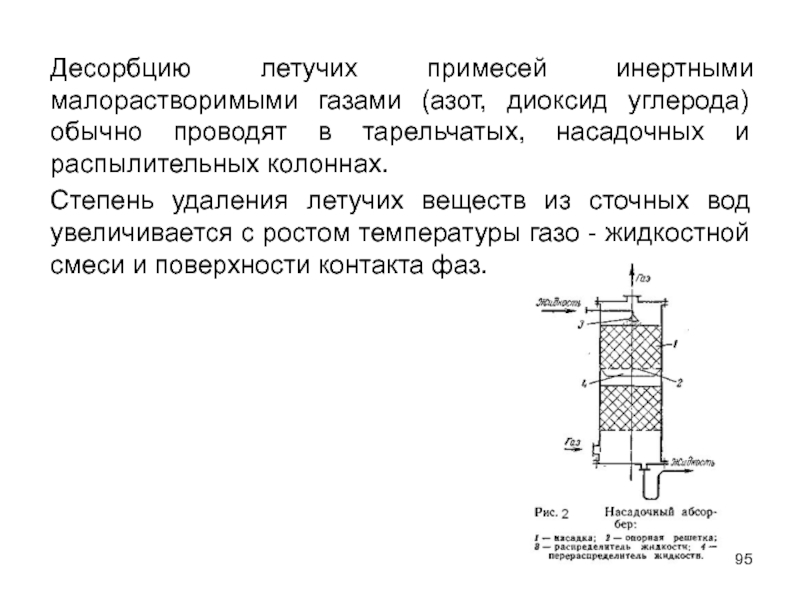
Слайд 95Десорбцию летучих примесей инертными малорастворимыми газами (азот, диоксид углерода) обычно проводят
Степень удаления летучих веществ из сточных вод увеличивается с ростом температуры газо - жидкостной смеси и поверхности контакта фаз.
Слайд 96Аэрация
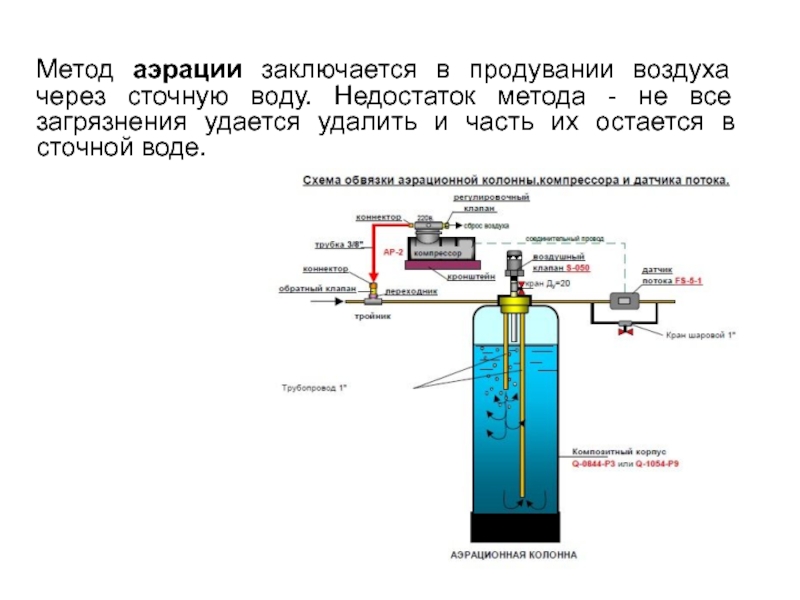
Если сточные воды содержат дурно пахнущие вещества - меркаптаны, амины, сероводород,
Слайд 97Метод аэрации заключается в продувании воздуха через сточную воду. Недостаток метода
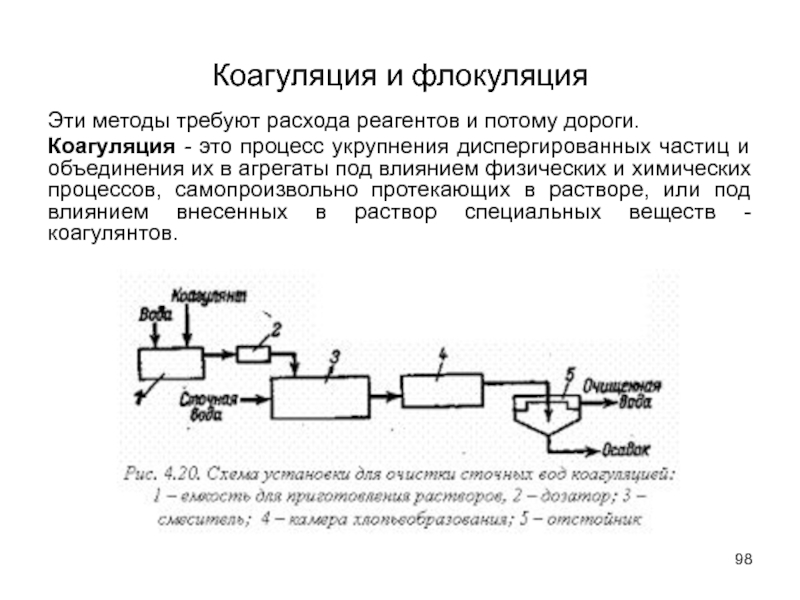
Слайд 98Коагуляция и флокуляция
Эти методы требуют расхода реагентов и потому дороги.
Коагуляция -
Слайд 99В процессах водоочистки в качестве коагулянтов используют соли железа (FeCl3), алюминия
Иногда для коагулирования достаточно изменить рН. Например, при подкислении бытовых стоков выпадают в осадок мыла и труднорастворимые в воде высокомолекулярные жирные кислоты. Удобно использовать в качестве коагулянтов феррохромовые шлаки: они одновременно нейтрализуют кислые стоки и освобождают их от взвесей и коллоидов
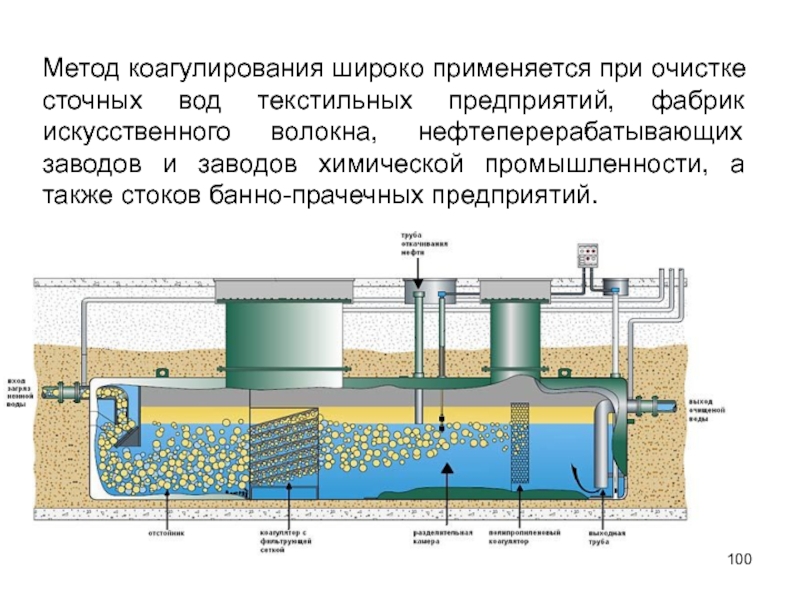
Слайд 100Метод коагулирования широко применяется при очистке сточных вод текстильных предприятий, фабрик
Слайд 101Флокуляция
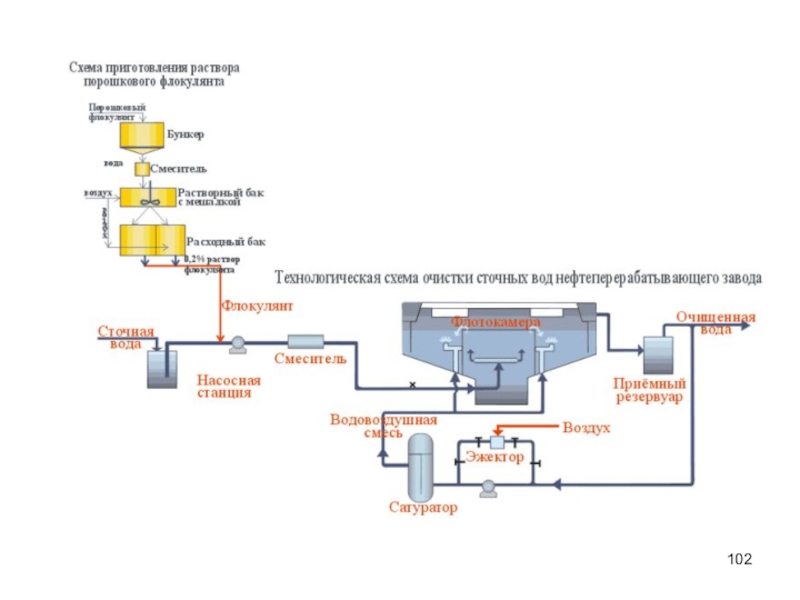
Процесс агрегации взвешенных частиц при добавлении в сточную воду высокомолекулярных соединений.
Флокуляцию
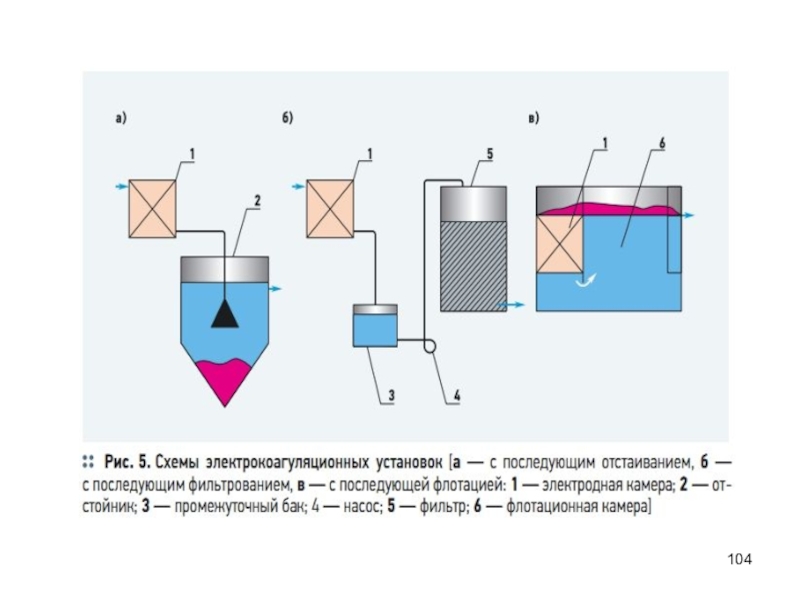
Слайд 103Электрохимические методы очистки
сточных вод
Электрофлотация, электрокоагуляция, электродиализ, анодное окисление и катодное
Электрофлотация – процесс очистки сточных вод от взвешенных частиц при помощи пузырьков газа, образующихся при электролизе воды. На аноде образуются пузырьки кислорода, а на катоде – водорода.
Электрокоагуляция – процесс очистки сточных вод от взвешенных частиц. Под действием тока происходит растворение металла анода (железа или алюминия), которые в виде катионов встречаясь с гидроксидными группами, образуют гидроксиды металлов в виде хлопьев. Наступает интенсивная коагуляция.
Электродиализ - процесс очистки сточных вод основанный на разделении ионизированных веществ под действием электродвижущей силы, создаваемой в растворе по обе стороны мембраны.
Слайд 106Процессы анодного окисления разработаны для очистки сточных вод от цианидов, тиоцианатов,
В процессе электрохимического окисления все эти, в том числе и достаточно сложные органические соединения полностью распадаются с образованием С02, Н20, NН3 или переходят в более простые и нетоксичные вещества, которые можно удалить из сточных вод другими методами.
Например:
CN- + 2OH- - 2e → CNO- + H2O
CNO- + 2H2O → NH4+ + CO32-
или
CNO- + 4OH- - 6e → 2CO2 + N2 + 2H2O
Процессы катодного восстановления используют для извлечения из сточных вод и последующей рекуперации ионов тяжелых и редких металлов (свинца, ртути, хрома, олова).
Например:
Cr2O72- +14H+ + 12e → 2Cr3+ + 7H2O
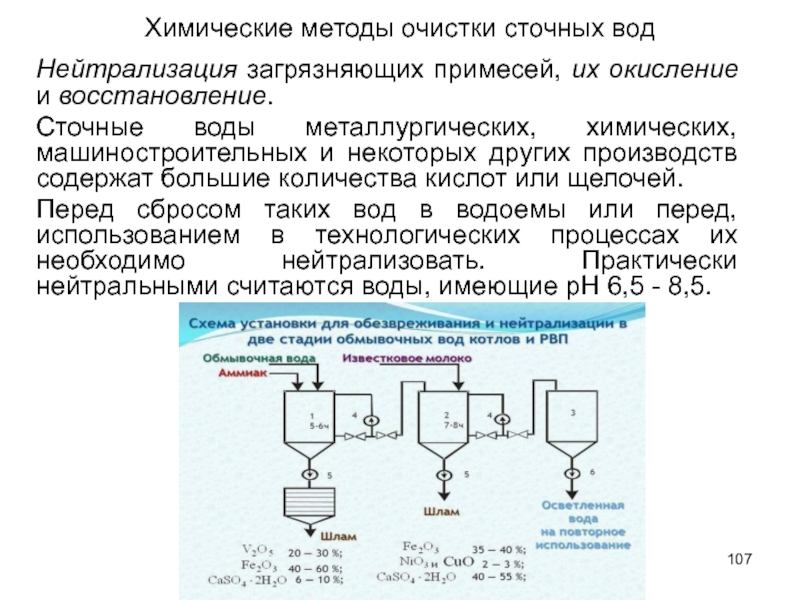
Слайд 107Химические методы очистки сточных вод
Нейтрализация загрязняющих примесей, их окисление и восстановление.
Сточные
Перед сбросом таких вод в водоемы или перед, использованием в технологических процессах их необходимо нейтрализовать. Практически нейтральными считаются воды, имеющие рН 6,5 - 8,5.
Слайд 108Способы проведения нейтрализации
смешение кислых и щелочных стоков,
фильтрование сквозь нейтрализующие материалы,
сорбция кислых газов щелочными водами
сорбция аммиака кислыми водами.
Выбор способа нейтрализации зависит от объема и концентрации сточных вод, от режима их поступления, наличия и стоимости реагентов.
Нейтрализация смешением может быть осуществлена, если на одном или соседних предприятиях имеются и кислые, и щелочные стоки, не загрязненные другими компонентами.
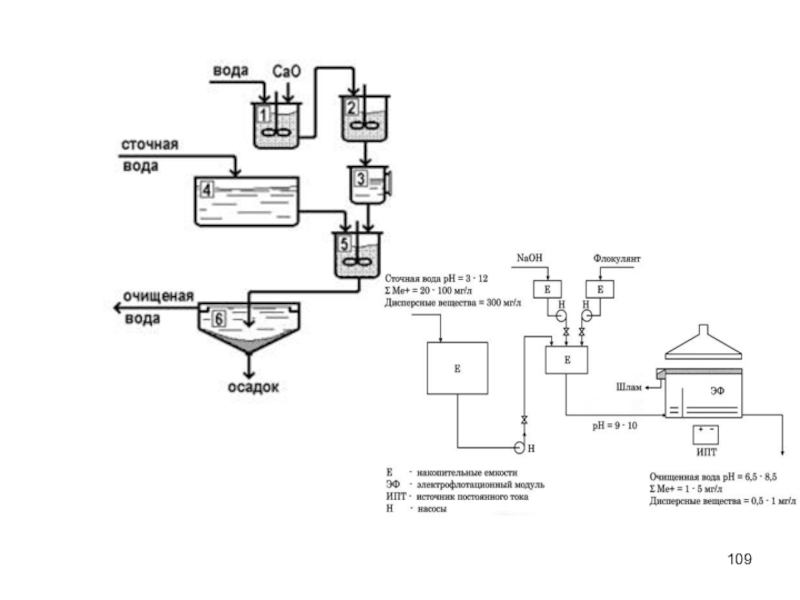
Слайд 110Реагенты
Для нейтрализации кислых сточных вод в качестве реагентов используются щелочи (NаОН,
При нейтрализации кислых стоков твердыми реагентами (магнезит, доломит, известняк и т. д.) или твердыми промышленными отходами (золы, шлаки сталеплавильного и доменного производства и т. д.) сточные воды очищают, фильтруя их сквозь слой реагента.
Для нейтрализации щелочных стоков используют отходящие газы, содержащие С02, S02, N02, N203 … Это позволяет не только нейтрализовать сточные воды, но и одновременно производить высокоэффективную очистку самих газов от вредных компонентов.
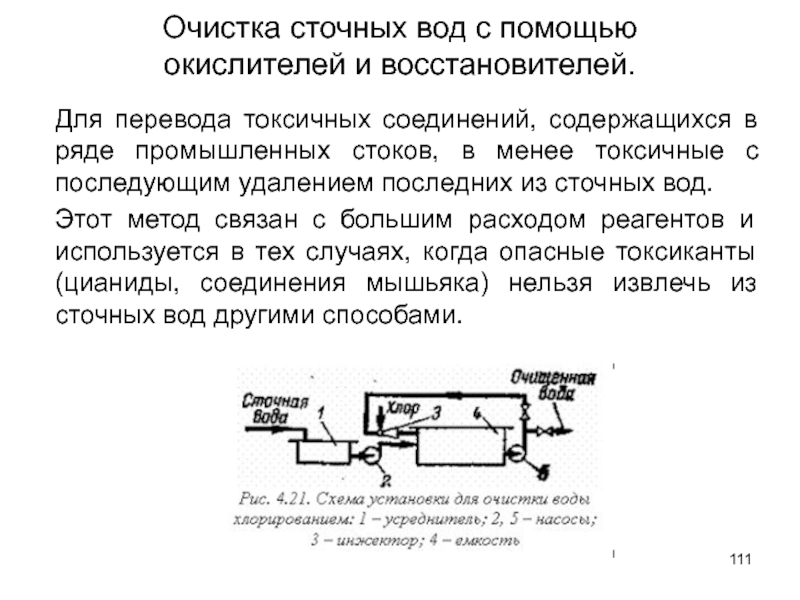
Слайд 111Очистка сточных вод с помощью
окислителей и восстановителей.
Для перевода токсичных соединений,
Этот метод связан с большим расходом реагентов и используется в тех случаях, когда опасные токсиканты (цианиды, соединения мышьяка) нельзя извлечь из сточных вод другими способами.
Слайд 112Окислители
В качестве окислителей используют хлор, озон О3, пероксид водорода Н202, пиролюзит
Чаще всего в системах водоочистки используют хлор и хлорсодержащие соединения, способные выделять «активный» хлор. При введении хлора в воду образуются соляная и хлорноватистая кислоты:
Сl2 + Н20 = НСl + НСl0
Хлорноватистая кислота частично диссоциирует:
НСl0 = H+ +ClO-
Сумма соединений Сl2 + НСl0 + Сl0- называется свободным «активным» хлором.
Его источниками могут быть также хлорная известь Са(Сl0)2, гипохлориты (например, NаСlO), хлориты (например, NаСl02, диоксид хлора СlO2).
Слайд 113Процесс хлорирования проводят в хлораторах периодического и непрерывного действия.
В этих
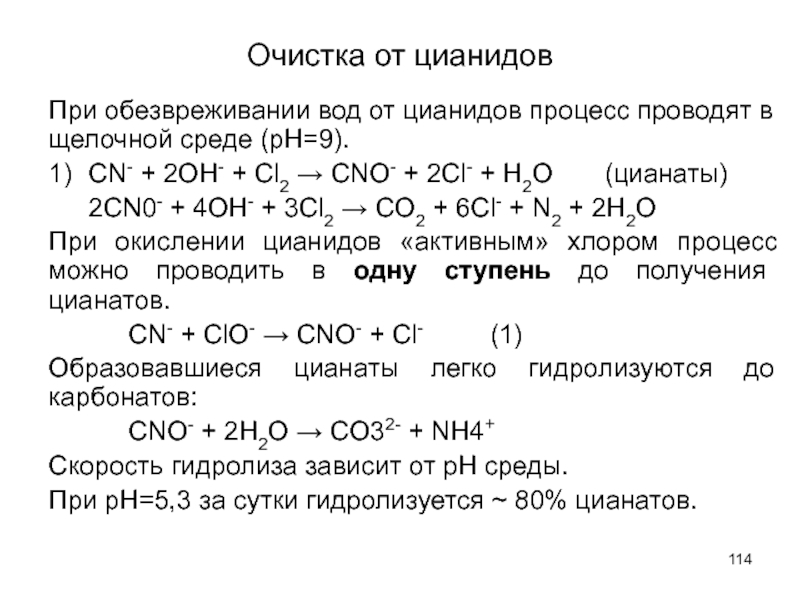
Слайд 114Очистка от цианидов
При обезвреживании вод от цианидов процесс проводят в щелочной
1) CN- + 2OH- + Cl2 → CNO- + 2Cl- + H2O (цианаты)
2CN0- + 4OH- + 3Cl2 → CO2 + 6Cl- + N2 + 2H2O
При окислении цианидов «активным» хлором процесс можно проводить в одну ступень до получения цианатов.
CN- + ClO- → CNO- + Cl- (1)
Образовавшиеся цианаты легко гидролизуются до карбонатов:
CNO- + 2Н2О → CO32- + NН4+
Скорость гидролиза зависит от рН среды.
При рН=5,3 за сутки гидролизуется ~ 80% цианатов.
Слайд 115В двухступенчатом процессе цианиды окисляются до N2 и CO2.
На первой стадии
2CNO- + 3ClO- + Н2О → 2CO2 + N2 +2ОН- + 3Cl-
рН в пределах 8-11.
Контроль полноты окисления проводят по остаточному «активному» хлору, концентрация которого должна быть не менее 5-10 мг/л.
Товарный хлорат кальция содержит до 33 % «активного» хлора, а гипохлорит кальция до 60%.
Слайд 116Пероксид водорода
Окислитель - пероксид водорода легко разлагает нитраты, нитриты, альдегиды и
В кислой и щелочной средах он разлагается по уравнениям:
2H+ + H2O2 +2e- → 2H2O
2OH- + H2O2 + 2e- → 2H2O +2O2-
В кислой среде более отчетливо выражена окислительная функция, а в щелочной – восстановительная.
В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту – в азотную, сульфиды в сульфаты. Цианиды в цианаты окисляются в щелочной среде (рН=9-12).
В разбавленных растворах процесс окисления органических веществ протекает медленно, поэтому используют катализаторы - ионы металлов переменной валентности (Fe2+, Cu2+, Mn2+, Co2+...)
Слайд 117Пероксид водорода
В процессах водообработки используют и восстановительные свойства H2O2 .
В
H2O2 +Cl2 → O2 + 2HCl
H2O2 +NaClO → NaCl + O2 + H2O
Эти реакции используют при дехлорировании воды.
Н2О2 используется также для обесцвечивания сточных вод: при рН 7-10 пероксид водорода быстро разлагает активные красители, причем присутствие катализаторов (сульфатов железа или меди) ускоряет процесс разложения в 8 - 10 раз.
Слайд 118Окисление кислородом воздуха
Используют при очистке сточной воды от железа для окисления
4Fe2+ + O2 +2H2O → 4Fe3+ + 4OH-
Fe3+ + 3H2O → Fe(OH)3 + 3H+
Окисление проводят при аэрировании воздуха через сточную воду в башнях с насадкой. Образующийся гидроксид железа отстаивают в контактном резервуаре, а затем отфильтровывают.
Слайд 119Окисление кислородом воздуха
Кислородом воздуха окисляют также сульфидные стоки целлюлозных, нефтеперерабатывающих и
Процесс окисления гидросульфидной и сульфидной серы :
S2- → S → S4O62- → S2O32- → SO32- → SO42-
При этом идет изменение рН.
Слайд 120Окисление пиролюзитом
Для очистки промышленных стоков от соединений мышьяка (Ш) успешно применяют
Н3АsО3 + Мn02 + Н2S04 = Н3Аs04 + МnS04 + Н2О
причем мышьяк (III) переходит в менее токсичный мышьяк (V).
Повышение температуры способствует увеличению степени окисления.
Оптимальный режим окисления - расход Мn02 четырехкратный по сравнению со стехиометрическим, кислотность воды 30-40 г/л, температура воды 70-8000С.
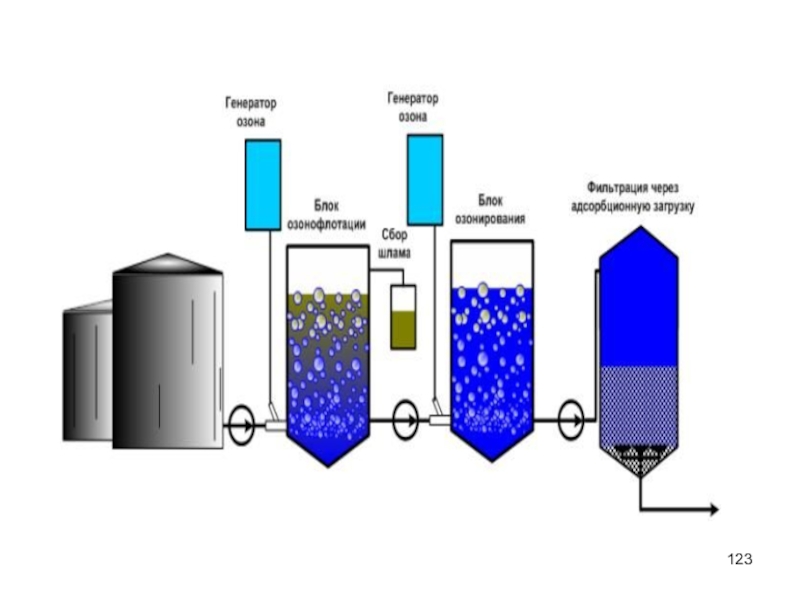
Слайд 121Озонирование
От фенолов, нефтепродуктов, сероводорода, соединений мышьяка, поверхностно-активных веществ, цианидов, канцерогенных ароматических
Слайд 122Озонирование
В сточную воду озон подают в виде озоно-воздушной или озоно-кислородной смеси
Озонирование промышленных сточных вод осуществляют в барботажных, насадочных, тарельчатых колоннах и других контактных аппаратах.
Процесс очистки ускоряют при совместном применении озона и ультразвуковой обработки или ультрафиолетового облучения сточных вод.
Так, ультрафиолетовое облучение ускоряет процесс окисления примесей в промышленных стоках в 102 - 104 раз.
Слайд 124Восстановительная очистка
Используются для сточных вод, содержащих легко-восстанавливаемые вещества. Часто применяются для
Слайд 125Восстановители
В качестве восстановителей используют активированный уголь, органические отходы (например, газетную бумагу),
Слайд 126Очистка от соединений Сr и Hg
4Н2Сr04 + 6NаНS03 + ЗН2S04 =
или
2СrО3 + ЗН2S03 (SO2 + H2O) = Cr2(S04)3 + ЗН20
Последний процесс позволяет сочетать улавливание хрома из сточных вод с очисткой отходящих газов от диоксида серы.
Ртуть неорганических соединений, содержащихся в сточных водах, сравнительно легко восстанавливается до металлической, которая затем выделяется отстаиванием, фильтрованием или флотацией.
Слайд 127Удаление тяжелых металлов
Hg, Cr, Cd,Co, Zn, Pb, Cu, Ni, Mn, As
В различных отраслях промышленности используются соединения тяжелых металлов, что приводит к загрязнению ими сточных вод.
Для удаления распространены реагентные методы очистки.
Перевод растворимых в воде веществ в нерастворимые при добавлении различных реагентов с последующим отделением образующихся осадков.
Слайд 128Осадение ионов металлов
В качестве реагентов для осаждения тяжелых металлов используют гидроксиды
Осаждение ионов металлов происходит в виде гидроксидов, при различных значениях рН, которое зависит от природы металла, концентрации, температуры, содержанию примесей.
Эффективность больше при совместном осадении нескольких ионов металлов
Слайд 130Очистка от соединений ртути
Неорганические соединения ртути
В производственных сточных водах может
Неорганические соединения ртути : оксид HgO, хлорид (сулема) HgCl2 ,сульфат HgSO4 , сульфид (киноварь) HgS , нитрат Hg(NO3)2 и др. В них токсичны ионы Hg2+, поэтому наиболее опасны хорошо растворимые и легко диссоциирующие соли.
Слайд 131Органические соединения Hg
Органические соединения ртути применяют при консервировании древесины, для защиты
Слайд 132Очистка от металлической Hg
Металлическая ртуть может быть удалена из сточных вод
Частицы, прошедшие с фильтратом или не успевшие осесть, окисляют хлором или NaOCl до HgCl2.
Затем воду обрабатывают восстановителем (NaHSO4 , Na2SO3) для их удаления и связывания остатков свободного хлора. Ртуть осаждают сульфидом натрия с последующим коагулированием образующегося сульфида ртути хлоридом железа.
Слайд 133Очистка от неорганической ртути
Для удаления из сточных вод ионов неорганической ртути
В качестве восстановителей применяют сульфид натрия Na2S, гидросульфит натрия NаНS03 или сероводород, которые переводят растворимые ионы ртути в труднорастворимый сульфид.
Произведение растворимости HgS в воде = 1,6*10-52, что отвечает остаточной концентрации в растворе = 2.5*10-21 мг/л.)
Затем обрабатывают раствор хлоридами натрия, калия, магния, кальция в количестве 0,1 г/л. В этих условиях сульфид ртути осаждается в виде гранул (добавляют коагулянты: сульфаты Al, Fe), который затем отфильтровывают.
Слайд 134Органические соединения
Их сначала разрушают с помощью сильных окислителей (например, газообразным хлором),
Слайд 135Очистка от соединений Zn,Cu, Ni, Pb, Cd, Co.
При обработке кислых сточных
При рН=7 осаждается гидроксид-сульфат цинка состава ZnSO4∙3Zn(OH)2, а при повышении рН до 8,8 составу осадка соответствует формула ZnSO4∙5Zn(OH)2.
В сильнощелочной среде твердая фаза представляет собой в основном гидроксид.
Слайд 136Общая схема выделения ионов металлов
В общем выделение данных ионов Ме2+ щелочами
Ме2+ + 2ОН- = Ме(ОН)2↓
Для цинка выпадение в осадок его гидроксида соответствует рН=5,4. При рН=10,5 начинается растворение амфотерных гидроксидов цинка, а при достижении рН=12 происходит образование комплекса:
Zn(OH)2 + 2OH- = [Zn(OH)4]2-
Осаждение гидроксида меди происходит при рН=5,3.
Осаждение гидроксида никеля начинается при рН=6,7. Как и для меди его растворимость сильно зависит от рН.
Перечисленные металлы также хорошо отделяются от раствора в виде карбонатов или гидроксид-карбонатов ((МеОН)2СО3)↓.
Слайд 137Очистка от ионов свинца
Находящиеся в растворе переводят в осадок в виде
Pb2+ + 2OH- = Pb(OH)2↓
2Pb2+ + 2OH- +CO32- = (PbOH)2CO3↓
Pb2+ + CO32- = PbCO3↓
Выпадение в осадок гидроксида свинца начинается при рН=6,0.
Наиболее дешевым методом является получение карбоната свинца с использованием в качестве реагента - осадителя известняка, мела или мрамора, которыми загружают фильтры, через которые профильтровывают очищаемые стоки.
При увеличении рН>7 эффективность очистки от ионов свинца значительно повышается вследствие появления гидроксид - ионов наряду с карбонат - ионами и образование гидроксид - карбоната свинца. Наибольшая степень очистки достигается при рН=9,5. Степень очистки составляет 90%.
Слайд 138Концентрации ионов кобальта и кадмия в стоках обычно чрезвычайно малы по
Слайд 139
Обработка сточных вод щелочными реагентами позволяет снизит содержание тяжелых металлов в
Более глубокая очистка при использовании щелочных реагентов не достигается.
Слайд 140Очистка от солей железа
В природных водах содержание железа колеблется от 0,01
В значительных количествах железо содержится в сточных водах химических, металлургических, машиностроительных, нефтехимических, химико-фармацевтических и др. производств.
При содержании железа более 1мг/л вода приобретает бурый цвет. При движении такой воды по трубопроводам на их стенках откладываются соединения железа и железобактериии, уменьшая сечение трубопровода.
Слайд 141Методы обезжелезивания вод
Аэрация, реагентные методы, электродиализ, адсорбция, обратный осмос.
Слайд 142Аэрирование
В процессе аэрирования происходит окисление двухвалентного железа в трехвалентное
4Fe2+ + O2
Fe3+ + 3H2O = Fe(OH)3 + 3H+
или суммарно
4Fe2+ + O2 + 10H2O = 4Fe(OH)3 + 8H+
В присутствии гидрокарбонатных ионов в воде процесс протекает по следующей реакции
4Fe2+ +8HCO3- + O2 + 2H2O = 4Fe(OH)3↓ + 8CO2↑
На окисление 1мг двухвалентного железа расходуется 0,143 мг кислорода. Для обеспечения высокой скорости химической реакции содержание кислорода в воде должно быть 0,5-0,9 мг на 1 мг железа.
Слайд 143Реагентные методы
При высоком содержании железа в воде аэрационным методом его полностью
Для этой цели используют хлор, хлорат кальция (хлорную известь), перманганат калия, озон, оксид кальция (известь), карбонат натрия (соду) и др. Реагенты дозируются в воду перед осветлителями или отстойниками.
Fe(HCO3)2 + Cl2 + Ca(HCO3)2 = 4Fe(OH)3↓ + CaCl2+ 6CO2↑
Скорость данной реакции больше с повышением рН.
В случае использования хлората кальция его используют в виде 1-2%-го раствора, который дозируют непосредственно в сточную воду.
Слайд 144Окисление перманганатом калия
проходит по уравнению
3Fe(HCO3)2 + KMnO4 + 2H2O =
Если железо содержится в виде органических соединений или коллоидных частиц, применяют озонирование.
При этом на 1 масс. ч. железа требуется 1 масс. ч. озона.
Слайд 145Очистка от соединений марганца
Соединения марганца содержатся в сточных водах металлургических, машиностроительных
При концентрации марганца более 0,05 мг/л вода окрашивается в темный цвет.
Удаление из воды марганца может быть достигнуто следующими методами :
обработкой воды перманганатом калия;
аэрацией, совмещенной с известкованием;
фильтрованием воды через марганцевый песок или марганцевый катионит;
окислением озоном, хлором или диоксидом хлора.
Слайд 146При обработке воды перманганатом калия достигается одновременная очистка от марганца и
3Mn2+ + 2MnO4- + 2H2O = + MnO2↓ + 4H+
Удаление марганца аэрацией с подщелачиванием воды применяют при одновременном присутствии в ней марганца и железа.
При аэрации воды удаляется часть диоксида углерода и происходит ее насыщение кислородом воздуха. При удалении СО2 возрастает рН сточной воды, что способствует ускорению процессов окисления и гидролиза железа и частично марганца с образованием гидроксидов.
Слайд 147Биохимические методы очистки сточных вод
Основаны на способности микроорганизмов использовать для своего
Потребляя органические вещества, микроорганизмы частично разрушают их, превращая в СО2, Н2О, нитрат-, и сульфат-ионы, частично используют для образования собственной биомассы.
Слайд 148Биохимическую очистку сточных вод можно проводить как в искусственных условиях –
Слайд 149Аэробные и анаэробные методы
Анаэробная очистка сточных вод протекает без доступа кислорода
Слайд 150Аэробная очистка
Для аэробной очистки используют аэробные группы микроорганизмов, для жизнедеятельности которых
Слайд 151Биологические фильтры
Резервуары, заполненные крупнозернистыми материалами - гравием, керамзитом, шлаком, крупным песком,
Слайд 152Проходя сквозь загрузку биофильтра, сточные воды оставляют на ней органические вещества,
Эти вещества образуют на поверхности зерен фильтра биопленку, в которой развиваются микроорганизмы. В результате из сточных вод удаляются органические загрязнения. Биопленка имеет вид слизистых обрастаний толщиной 1 - 3 мм и более. Цвет ее изменяется с изменением состава сточных вод от серовато-желтого до темно-коричневого.
Слайд 154Бактерии
Биоценоз активной пленки включает несколько групп аэробных бактерий, грибы, дрожжи; развивающиеся
Слайд 155Аэротенки
В них медленно движется смесь активного ила и сточной воды, постоянно
Слайд 157Основные проблемы
В результате биохимической образуются сильно влажные осадки, которые необходимо утилизировать
Как правило, осадки сточных вод представляют собой труднофильтрующиеся суспензии.
Слайд 159Уплотнение осадка
Обработка начинается с уплотнения осадка гравитационным или флотационным методом -
При снижении давления растворенный воздух выделяется в виде мелких пузырьков, а осадок активного ила становится более плотным.
Слайд 160Стабилизация осадка
Уплотненный осадок подвергается стабилизации - разрушению его органической составляющей до
Стабилизация осуществляется с помощью микроорганизмов в анаэробных и аэробных условиях.
В анаэробных условиях осадок сбраживается в двухъярусных отстойниках, осветлителях - перегнивателях, метантенках.
Слайд 162Аэробная стабилизация
Это продолжительное аэрирование осадка;
в результате пневматического или механического аэрирования
Слайд 163Кондиционирование
Стабилизированный осадок подвергают коагуляции. Далее проводят процесс изменения структуры осадка и
Его можно проводить и безреагентным методом, в том числе тепловой обработкой, замораживанием с последующим оттаиванием, электрокоагуляцией.
Влажность кондиционированного осадка снижается с 92 - 94 до 70 - 75%, он хорошо уплотняется и поступает на обезвоживание.
Слайд 164Обезвоживание осадков
Производят на иловых площадках - обвалованных со всех сторон участках
Обычно иловые площадки делают для очистных сооружений производительностью
10 000 м3/сут.
Их располагают в виде каскада из 4 - 8 площадок.
Слайд 165Обезвоженный осадок высушивается на барабанных, ленточных, распылительных и других сушилках, в
Твердые осадки сточных вод могут стать важным ресурсом органических удобрений, если не содержат тяжелых металлов или других токсических компонентов.
Слайд 168Поля фильтрации
Перспективна биохимическая очистка сточных вод в естественных условиях - на
В этих случаях для очистки сточных вод используется очищающая способность самой почвы. Фильтруясь сквозь слой почвы, вода оставляет в ней взвешенные, коллоидные и растворенные примеси.
Микроорганизмы почвы окисляют органические загрязняющие вещества, превращая их в простейшие минеральные соединения - диоксид углерода, воду, соли.
Слайд 170Наиболее интенсивно протекают эти процессы в верхних горизонтах почвы (0,2-0,4 м),
Регулируя водно-воздушный режим территории, орошаемой сточными водами, можно достичь высоких степеней очистки и повышения плодородия орошаемых земель, которые извлекают из сточных вод и удерживают элементы питания растений. Почвенная очистка сточных вод существенно эффективнее искусственной.
Слайд 171Поля фильтрации
Используют только для биохимической очистки воды; их территории отчуждаются у
Высокие нормы нагрузки (15 - 90 м3/га сточных вод в сутки) позволяют устраивать их лишь на хорошо фильтрующих почвах, а многолетнее обильное орошение приводит к вымыванию из почвы питательных веществ и ее деградации.
Поэтому биохимическая очистка воды на полях фильтрации значительно менее выгодна, чем на земледельческих полях орошения (ЗПО).
Слайд 172ЗПО
На земледельческих полях орошения очистка сточных вод происходит непосредственно на производственных
Норма сточных вод, подаваемых на единицу площади ЗПО, должна соответствовать потребности в удобрениях и воде произрастающих культур.
Для устройства ЗПО пригодны любые, даже бросовые земли, объем подготовительных работ сравнительно невелик, которые в основном сводятся к устранению неровностей рельефа.
Подача сточных вод в почву происходит либо с поверхности, либо из труб, проложенных на небольшой глубине.
Слайд 173Для обезвреживания яиц гельминтов, содержащихся в фекальных городских стоках, перед выпуском
Болезнетворные бактерии, содержащиеся в сточных водах, при попадании в почву довольно быстро погибают.
Тем не менее на ЗПО не рекомендуется выращивать культуры, идущие в пищу человеку. Обычно поля орошения используют под технические и кормовые культуры.
Слайд 174Биологические пруды
Используется способность природных вод к самоочищению.
Биологические пруды представляют собой
Анаэробные пруды служат для предварительной очистки высококонцент-рированных сточных вод; глубина таких прудов достигает 2,5 - 3 м.
Слайд 175Аэробные пруды
Их располагают секциями, от двух до пяти прудов в каждой.
Глубина воды в первом пруду составляет 1 м, в последующих - до 1,5 - 2,0 м.
Если аэробные пруды предназначены для полной биологической очистки, то время пребывания в них сточных вод должно быть не менее 15 - 20 сут; если они используются для доочистки, то время сокращается до 2 сут.
Слайд 176После биологической очистки сточных вод на искусственных сооружениях общее содержание в
Для полного обеззараживания сточных вод их необходимо хлорировать или уничтожить болезнетворные бактерии другими методами.
Слайд 177Термические методы очистки сточных вод
На химических предприятиях образуются сточные воды, содержащие
Такие воды могут быть обезврежены термическими методами.
Слайд 179К термическим методам относятся:
концентрирование сточных вод с последующим выделением растворенных веществ:
жидкофазное
окисление органических веществ в присутствии катализатора при атмосферном и повышенном давлениях
огневое обезвреживание.
Слайд 180Концентрирование сточных вод
Используют для обезвреживания минеральных сточных вод.
Он позволяет выделять
Данный процесс обычно проводят в две стадии:
стадия концентрирования и
стадия выделения сухих веществ.
Слайд 181Методы концентрирования
С использованием одноступенчатых и многоступенчатых выпарных установок. Недостатки:
энергоемкость проведения процесса
накипеобразование,
Слайд 182Установки вымораживания.
Данный процесс заключается в том, что при температуре ниже
Вымораживание проводят под вакуумом либо при помощи специального холодильного агента.
Наиболее распространенными хладоагентами являются аммиак, диоксид углерода, бутан, пропан, изобутан, хладоны (CCl2F2, CCl3F, CClF3).
Методы концентрирования
Слайд 183Методы концентрирования
Кристаллогидратные установки. В данном процессе концентрирование сточной воды происходит с
При этом концентрация растворенных веществ в воде повышается, а при плавлении кристаллов образуется вода, из которой выделяются пары гидратообразующего агента.
Температуру при гидратообразовании поддерживают выше и ниже температуры окружающей среды.
Слайд 184Выделение веществ из концентрированных растворов
Для выделения веществ из концентрированных растворов используют
Слайд 185Кристаллизация
Вещества, растворимость которых существенно возрастает с повышением температуры (положительная растворимость), кристаллизуют
Если с ростом температуры растворимость веществ уменьшается, то кристаллизацию проводят при нагревании раствора.
Вещества мало изменяющие растворимость при изменении температуры, кристаллизуют путем испарения воды при постоянной температуре - изотермическая кристаллизация.
Положительной растворимостью обладают, например, растворы MgCl2, MgSO4, NaCl; отрицательной - растворы CaSO4, CasiO3 и др.
Слайд 186Кристаллизация
Кристаллизацию соли проводят также введением в концентрированный раствор веществ, уменьшающих ее
Слайд 187После кристаллизации в аппаратах любой конструкции полученные кристаллы отделяют от маточного
Маточный раствор и промывные воды должны быть возвращены на стадию концентрирования или направлены на очистку с целью дальнейшего использования.
В процессе кристаллизации основного вещества образующиеся кристаллы часто бывают загрязнены примесями.
Слайд 188Сушка
Наиболее удобны для данного процесса распылительные сушилки. (Высокая скорость сушки, до
Для отделения высушенного материала от газового потока используют циклоны, рукавные фильтры, скрубберы, электрофильтры
Слайд 189Термоокислительные методы обезвреживания
По теплотворной способности химические промышленные стоки делят на сточные
При использовании термоокислительных методов все органические вещества, загрязняющие сточные воды, полностью окисляются кислородом воздуха при высоких температурах до нетоксичных соединений. Выбор конкретного метода зависит от объема сточных вод, их состав и теплотворной способности, экономичности процесса и требований предъявляемых к очищенным водам.
Слайд 190Метод жидкофазного окисления
Этот метод очистки основан на окислении органических веществ, растворенных
При высоких давлениях растворимость в воде кислорода значительно возрастает, что способствует ускорению процесса окисления органических веществ.
Эффективность процесса окисления увеличивается с повышением температуры. Летучие вещества при условиях процесса окисляются в основном в парогазовой фазе, а нелетучие - в жидкой фазе. С увеличением концентрации органических примесей в воде экономичность процесса жидкофазного окисления возрастает.
Слайд 191Метод парофазного каталитического окисления
Это гетерогенное каталитическое окисление кислородом воздуха при высокой
Процесс протекает весьма интенсивно в паровой фазе в присутствии медно-хромового, цинк-хромового, медно-марганцевого или другого катализатора.
Установки характеризуются высокой производительностью по сточной воде и высокой степенью обезвреживания, достигающей 99,8%. Основной недостаток установок - возможность отравления катализаторов соединениями фосфора, фтора, серы. Поэтому необходимо предварительное удаление каталитических ядов из сточных вод.
Слайд 192Огневой метод
Сущность метода - распыление сточных вод непосредственно в топочные газы,
Если сточные воды содержат только минеральные вещества, огневой метод нецелесообразно применять.
В процессах обезвреживания сточных вод различного состава могут образовываться оксиды щелочных и щелочно - земельных металлов (CaO, MgO, BaO, K2O и др.). Некоторые из этих оксидов могут взаимодействовать с компонентами дымовых газов, например
Na2O + CO2 = Na2CO3
При диссоциации хлоридов в дымовых газах образуются хлор и хлороводород. Органические соединения содержащие серу, фосфор, галогены могут образовывать SO2, SO3, P2O5 и др. Присутствие этих веществ в дымовых газах вызывает значительную коррозию аппаратуры.
Слайд 193ЗАЩИТА ЛИТОСФЕРЫ ОТ ЗАГРЯЗНЕНИЙ
Твердые отходы, поступающие в биосферу за счет техногенной
Наибольшую сложность представляет обезвреживание и утилизация промышленных отходов, существенно превосходящих сельскохозяйственные и бытовые как по масштабам их скапливания, так и по разнообразию состава и свойств.
Практически все виды отходов содержат ценные вещества, и их рациональная утилизация дает дополнительные сырьевые ресурсы, охраняя в то же время биосферу от загрязнения.
Слайд 194Утилизация отходов горнодобывающей промышленности
Исследования и полупромышленные испытания этих отходов показали, что
Обогащение угля с целью снижения содержания в нем серы сопровождается образованием серного колчедана, содержащего 42 -46% серы и 5 - 8% углерода.
Н-р,в Подмосковном угольном бассейне запасы серного колчедана достигают 60 млн. т.
Слайд 195Серный колчедан FeS2 является потенциальным сырьем для производства серной кислоты.
Использование
Процесс совместной термической обработки может быть выражен уравнением:
2 FeSO4 + 6 FeS2 + 1602 = 14S02 + 4Fe2O3
Слайд 196Породы основные и попутно извлекаемые часто содержат мел СаСОз, который может
Основой для производства почти всех известных видов строительных материалов могут служить так называемые горелые породы - пустые породы, обожженные при подземных пожарах или при самовозгорании терриконов.
Слайд 197Среди извлекаемых при горных работах пород нередко встречаются пластичные глины, которые
Слайд 198Утилизация твердых отходов металлургии и энергетики
Металлургические шлаки также представляют собой ценное
Так, гранулированные доменные шлаки являются прекрасным материалом для дорожного строительства. В смеси с вязкими битумами они успешно заменяют горячие асфальтобетонные смеси, причем их возможно укладывать даже на влажное основание. Битумошлаковые покрытия дорог в 2,5 раза дешевле железобетонных.
Слайд 199Сталеплавильные шлаки используются в качестве оборотного продукта (в виде флюса в
Ряд шлаков с высоким содержанием оксида кальция и фосфатов находит применение в сельском хозяйстве и используется в качестве известковых мелиорантов для кислых почв. Отвальные шлаки полиметаллических рудников, обогатительных фабрик и предприятий цветной металлургии содержат большое количество железа, меди, цинка, свинца и др.
Слайд 200По химическому составу их можно условно подразделить на три группы:
К первой
Вторую группу составляют медные шлаки, содержащие цинк, свинец, значительные количества железа и малые количества меди. Из этих шлаков целесообразно извлекать Zn, Pb, Sn.
В третью группу можно объединить оловянные и свинцовые шлаки и некоторые медные шлаки с высоким содержанием Zn, Pb, Sn из которых экономически целесообразно извлечение этих ценных металлов даже без комплексной переработки шлаков.
Слайд 201Золошлаковые отходы тепловых электростанций, выход которых в России и странах ближнего
Высокое содержание СаО в золе сланцев и торфа позволяет использовать ее в качестве известкового мелиоранта для улучшения кислых почв.
Слайд 202Зола некоторых углей и нефтей содержит многие металлы, причем их содержание
Слайд 203В зависимости от концентрации металлов в золе иногда становится экономически выгодным
Так, зола бурых углей некоторых месторождений содержит до 1 кг/т урана;
зола торфа содержит значительные количества V, Са, Cu, Ni, Zn, РЬ;
в золе нефтей содержание V205 достигает 65%.
Однако, несмотря на это, утилизация огромных масс зол и шлаков, скапливающихся на золоотвалах ТЭС, в настоящее время осуществляется совершенно недостаточно.
Слайд 204Утилизация твердых отходов химической промышленности
В промышленности неорганического синтеза наибольшее количество твердых
При производстве двойного суперфосфата, фосфорной кислоты и в ряде других химических производств образуется крупнотоннажный твердый отход фосфогипс, содержащий 80-90% гипса, 0,5-0,6%фосфорной кислоты, 5-6% глины.
Основная масса фосфогипса сбрасывается в отвалы, в которых содержатся десятки миллионов тонн этого отхода.
Возможна переработка фосфогипса в серную кислоту и известь, а также использование его в качестве химического мелиоранта для солонцовых почв.
Слайд 205При переработке и обогащении сырья в калийной промышленности ежегодно образуются миллионы
Галитовые отходы могут быть использованы в качестве вторичного сырья для получения соды, хлора, поваренной соли, однако их переработка затруднена присутствием сульфатов, хлорида калия и других примесей.
Утилизация твердых отходов химической промышленности
Слайд 206В производстве серной кислоты основными отходами являются пиритный огарок и различные
На 1 тонну кислоты приходится не менее 0,55 т огарка. В настоящее время огарок используют главным образом в цементной промышленности, однако, он может найти применение в производстве чугуна и для получения минеральных пигментов - железного сурика, охры.
Слайд 207Опасные отходы
Особо токсичные и радиоактивные отходы, которые по разным причинам не
Для захоронения отходов их заключают в металлические капсулы, а затем в кубы из отвердевшего жидкого стекла, рассчитанные на неопределенно долгое время хранения, и помещают под землей, в геологических выработках (брошенные угольные шахты, соляные копи, иногда специально созданные полости). Иногда в контейнерах из материалов, стойких к действию морской воды, отходы опускают в глубокие впадины морского дна.
Захоронение особо опасных отходов - одна из наиболее трудноразрешимых проблем охраны окружающей среды, так как места для их абсолютно безопасного изолирования от биосферы пока не найдено.
Слайд 208Использование промышленных и коммунально-бытовых отходов в сельском хозяйстве
Весьма перспективным является использование
В большинстве случаев мелиоративное использование промышленных отходов имеет высокую экономическую эффективность.
Для успешного использования промышленных отходов в сельском хозяйстве необходимо глубокое и всестороннее изучение их свойств и влияния на основные агрохимические характеристики почвы и качество сельскохозяйственной продукции.
Слайд 209Применение промышленных отходов для мелиорации кислых почв
Большинство пахотных земель в основных
Неблагоприятные агрохимические свойства кислых почв могут быть устранены их известкованием. При этом происходит вытеснение катионов водорода из ППК, а образующаяся Н2СО3 распадается до Н20 и С02.
Слайд 210В качестве известковых мелиорантов
могут быть использованы кальций содержащие промышленные отходы:
отходы металлургической
золы (зола горючих сланцев, золы уноса ТЭС, каменноугольные и буроугольные золы, торфяная зола);
отходы промышленности строительных материалов (карьерные отходы, отходы производства известнякового щебня, отходы цементных заводов, мраморная крошка);
отходы свеклосахарного производства (дефекационная и фильтр-прессная грязь);
крупнотоннажные отходы ряда других производств, в том числе отходы бумажной, кожевенной, содовой, асбестовой и других отраслей промышленности, а также флотационные отходы, получаемые при обогащении некоторых руд.