Ефимцева Татьяна Константиновна
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фазы и дизайны клинических испытаний презентация
Содержание
- 1. Фазы и дизайны клинических испытаний
- 2. Пути создания (жизненный цикл) ЛС
- 3. Процесс разработки нового ЛП Синтез и
- 4. Типы клинических исследований По цели исследования
- 5. Старт КИ. Формирование групп сравнения. Финиш
- 6. Фазы клинического испытания I: Первые КИ
- 7. I ФАЗА КИ Цель: впервые изучить
- 8. II ФАЗА КИ
- 9. Характеристика КИ ІІ фазы Сравнительные КИ
- 10. III ФАЗА КИ
- 11. IV ФАЗА КИ
- 12. Директива ЕС 2001/20, Приказ № 66
- 13. Технологии проведения КИ Проспективные Открытые, слепые (простое,
- 14. Технологии проведения КИ Дизайны Исследования в
- 15. Исследование в одной группе Открытое Не
- 16. Исследование в 2 параллельных группах Открытое,
- 17. Использование плацебо скрининг
- 18. Использование плацебо скрининг
- 19. Включение периода наблюдения скрининг
- 20. Исследование различных доз скрининг
- 21. Стратификация – разделение (расслоение) исследуемой выборки
- 22. Перекрестный дизайн
- 23. Технологии проведения КИ Этапы исследования Включение
- 24. Технологии проведения КИ Многоцентровые клинические испытания
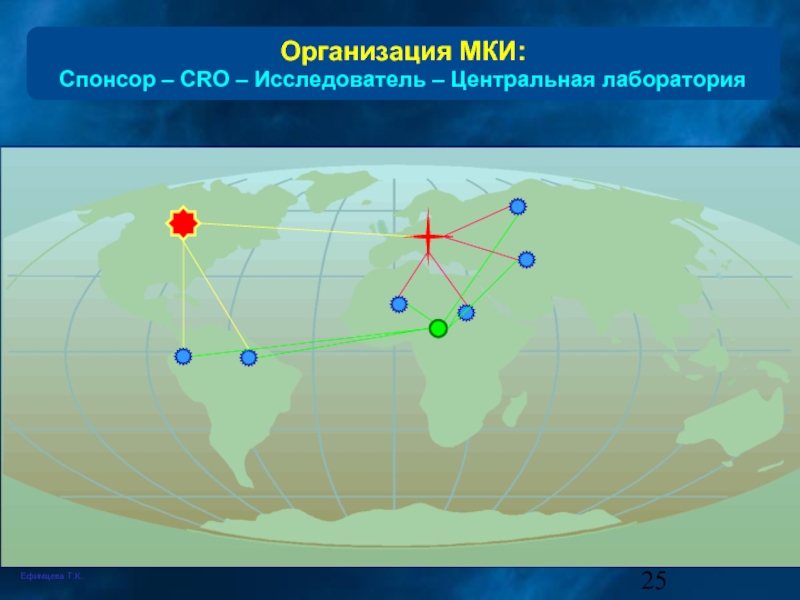
- 25. Организация МКИ: Спонсор – CRO – Исследователь
Слайд 1GCP. Законодательные и нормативные требования к проведению клинических испытаний лекарственных средств
Фазы
Слайд 2
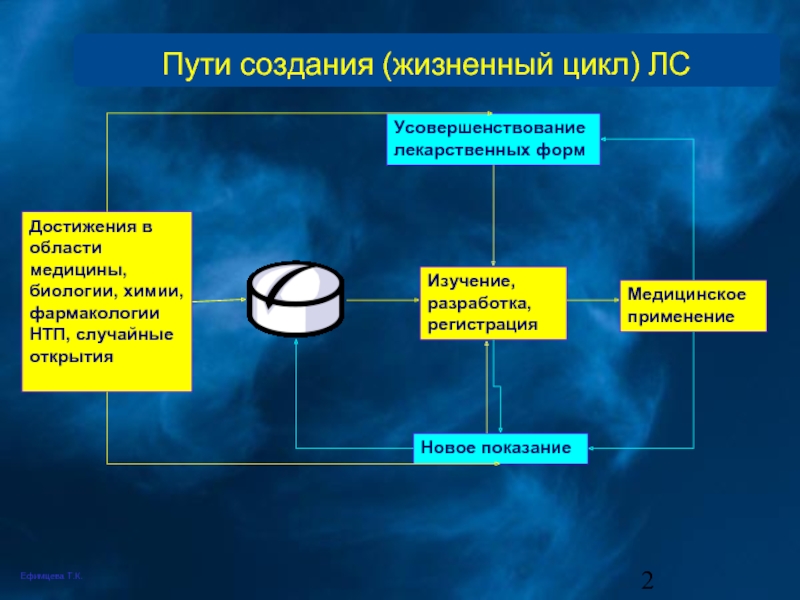
Пути создания (жизненный цикл) ЛС
Достижения в области медицины, биологии, химии, фармакологии
Изучение, разработка, регистрация
Медицинское применение
Новое показание
Усовершенствование лекарственных форм
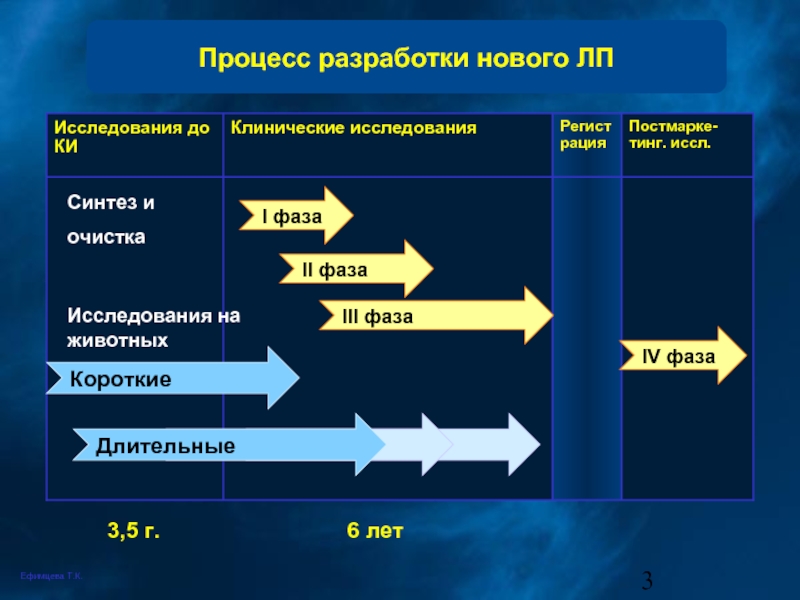
Слайд 3Процесс разработки нового ЛП
Синтез и
очистка
Исследования на животных
Короткие
Длительные
І фаза
ІІ фаза
ІІІ фаза
ІV
3,5 г.
6 лет
Слайд 4Типы клинических исследований
По цели исследования
Выдвигающие гипотезу - поисковые
Проверяющие гипотезу -
По временным параметрам
Одномоментное (поперечное) – однократное обследование участников или объектов исследования
Динамическое (продольное) - многократное
По соотношению времени сбора данных и формированию выборок
Проспективное (изучаемые группы формируют до сбора данных)
Ретроспективные (изучаемые группы формируют после сбора данных)
По отсутствию или наличию вмешательства
Пассивное (наблюдательное, обсервационное, неинтервенционное) – наблюдение за пассивным течением заболевания)
Активное (интервенционное, экспериментальное, клиническое испытание) - исследование медицинского вмешательства – метода лечения или профилактики
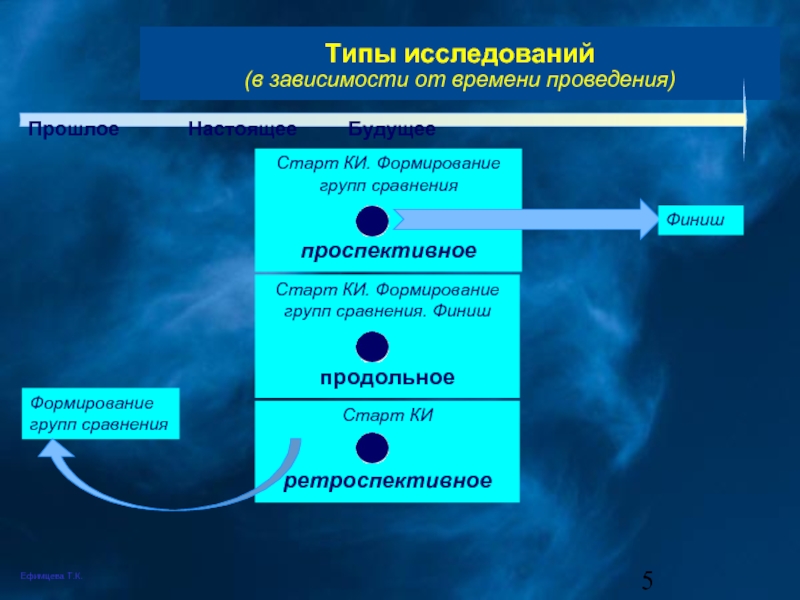
Слайд 5Старт КИ. Формирование групп сравнения. Финиш
продольное
Типы исследований
(в зависимости от времени
Прошлое Настоящее Будущее
Старт КИ. Формирование групп сравнения
проспективное
Формирование групп сравнения
Старт КИ
ретроспективное
Финиш
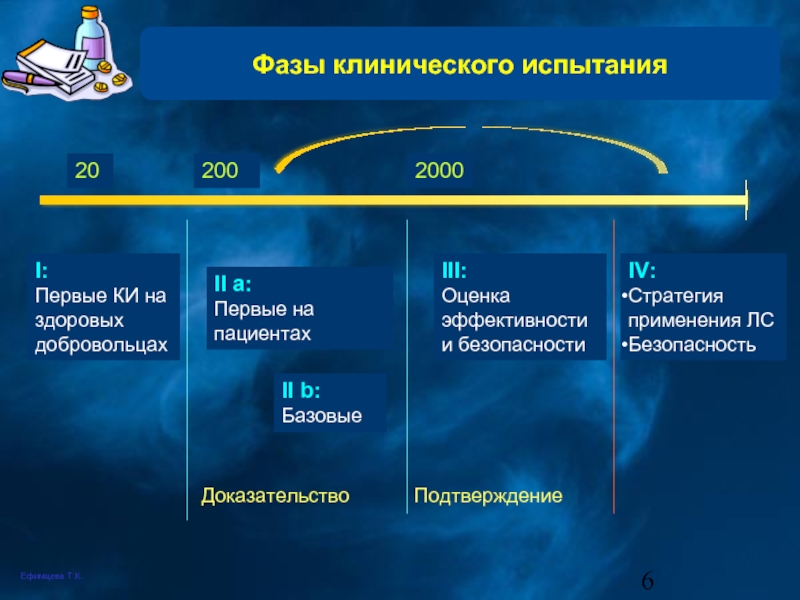
Слайд 6Фазы клинического испытания
I:
Первые КИ на здоровых добровольцах
II а:
Первые на пациентах
II b:
Базовые
III:
Оценка эффективности и безопасности
IV:
Стратегия применения ЛС
Безопасность
200
2000
20
Доказательство
Подтверждение
Слайд 7I ФАЗА КИ Цель: впервые изучить новое лекарственное средство на людях
Однократная доза:
переносимость,
фармакокинетические параметры,
фармакодинамические эффекты
Многократное введение:
эскалация доз
курсовое введение фиксированной дозы,
Определяют:
максимально переносимую дозу,
дозозависимый эффект
дозу для последующего изучения
? - Продолжать дальнейшую разработку
Слайд 8II ФАЗА КИ Первый опыт применения ЛС у пациентов с заболеванием,
ПРОБНЫЕ (pilot)
Оценка безопасности на небольших группах пациентов с конкретным заболеванием
Убедиться в активности ЛС и оценить краткосрочную безопасность
ОБШИРНЫЕ БАЗОВЫЕ (pivotal)
Оценка эффективности и безопасности
Определить оптимальный уровень дозирования
а
б
Слайд 9Характеристика КИ
ІІ фазы
Сравнительные КИ
Жесткие критерии включения
Контроль:
- плацебо
- препарат
- разные дозы изучаемого ЛС
- стандартное лечение
Слепые КИ
Рандомизированные
Слайд 10III ФАЗА КИ Оценить ЛС в условиях максимально приближенных к
Сравнительные ⇔ без сравнения
Слепые ⇔ открытые КИ
Рандомизация, стратификация
Длительные исследования
Контингент исследуемых
- менее жесткие условия включения в КИ,
- разные группы пациентов
Оцениваются
- редкие побочные реакции,
- безопасность при длит.применении,
- взаимодействие лекарств,
- оценка качества жизни, экономическая оценка методов лечения (фармакоэкономика)
Слайд 11IV ФАЗА КИ Получить более подробную информацию о безопасности и
КИ, тестирующие научную гипотезу:
Уточнение схем применения ЛП
Сравнение с другими стандартными курсами лечения
Изучение исходов, выживаемости
Исследования безопасности
Общая безопасность
Безопасность в особой популяции
Изучение определенных ПР
Обсервационные исследования
(неинтервенционные)
Слайд 12
Директива ЕС 2001/20, Приказ № 66
НЕИНТЕРВЕНЦИОННОЕ ИССЛЕДОВАНИЕ –
Исследование, в котором ЛС
Включение пациента в группу с определенным методом лечения в протоколе заранее не предусмотрено, а диктуется современной практикой, и назначение ЛС четко отделено от решения включить пациента в исследование.
Не применяют каких-либо специальных диагностических или мониторинговых процедур в отношении пациентов, а для анализа собранных данных используют эпидемиологические методы.
Слайд 13Технологии проведения КИ
Проспективные
Открытые, слепые (простое, двойное, тройное)
Рандомизированные, стратифицированные
Сравнительные (лечения эквивалентны,
Контроль: плацебо, активный контроль
Слайд 14Технологии проведения КИ
Дизайны
Исследования в одной группе
Исследования в параллельных группах
Перекрестная модель
Другие
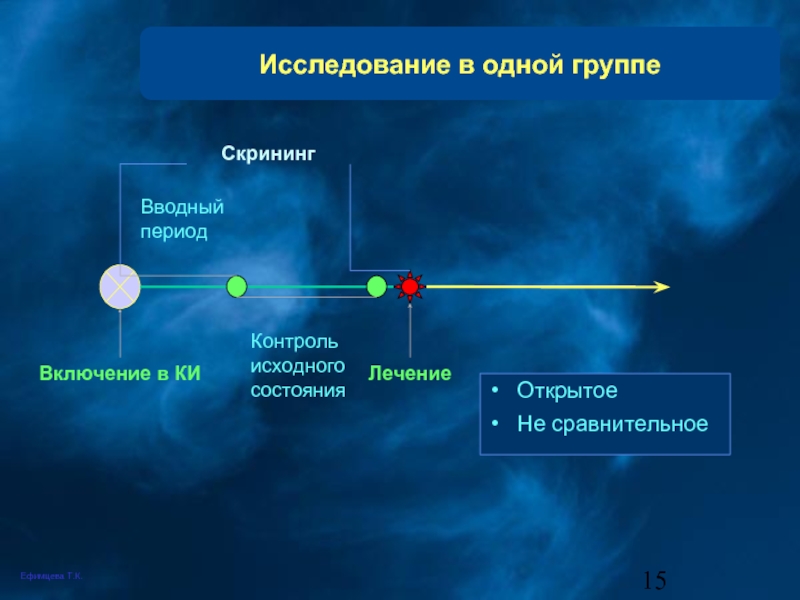
Слайд 15
Исследование в одной группе
Открытое
Не сравнительное
Скрининг
Включение в КИ
Лечение
Контроль исходного состояния
Вводный период
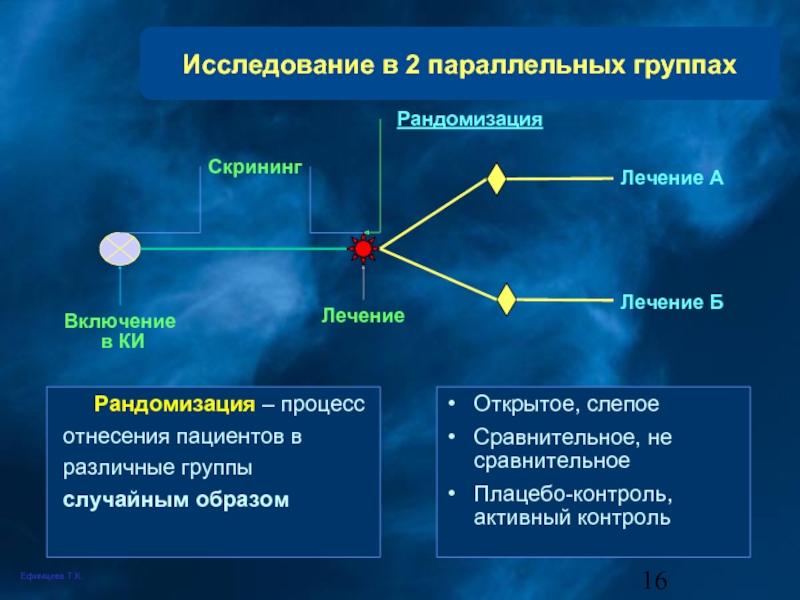
Слайд 16Исследование в 2 параллельных группах
Открытое, слепое
Сравнительное, не сравнительное
Плацебо-контроль, активный контроль
Рандомизация –
Включение
в КИ
Лечение
Лечение А
Лечение Б
Скрининг
Рандомизация
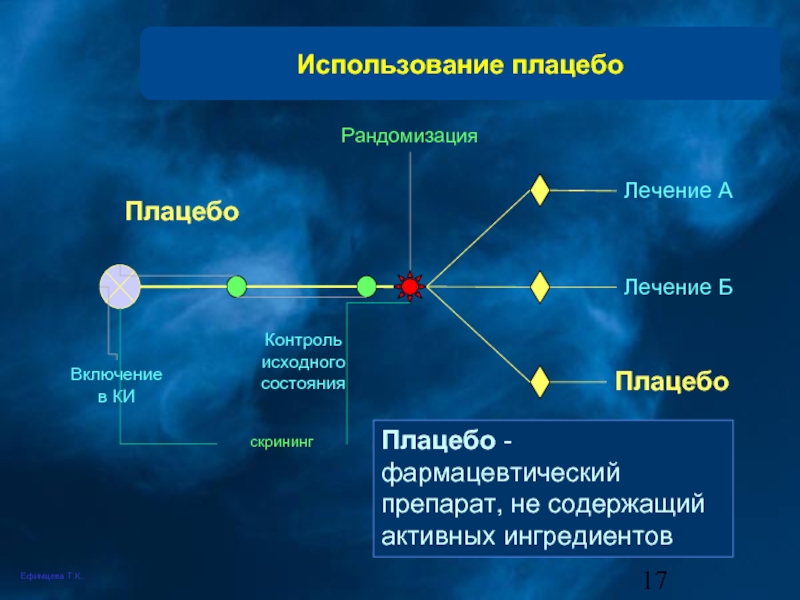
Слайд 17Использование плацебо
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Лечение А
Плацебо
Лечение Б
Плацебо - фармацевтический
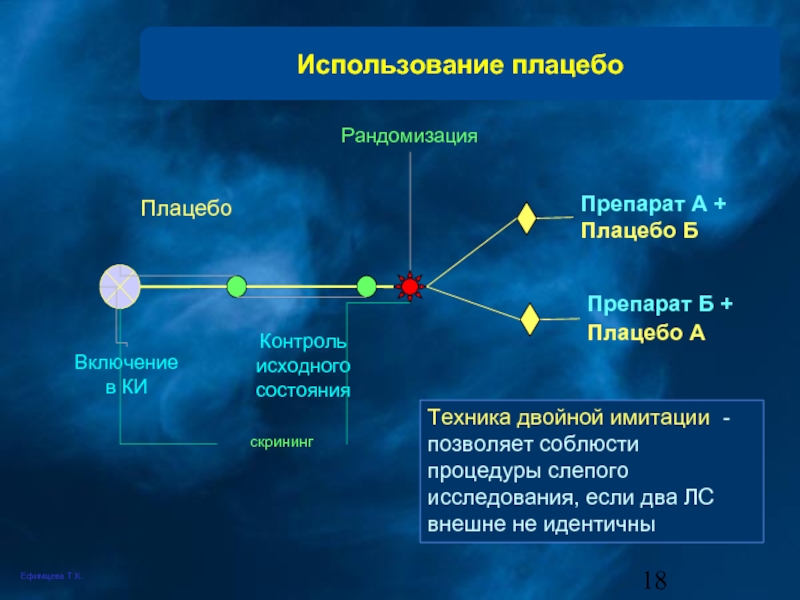
Слайд 18Использование плацебо
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Препарат А + Плацебо Б
Препарат
Техника двойной имитации - позволяет соблюсти процедуры слепого исследования, если два ЛС внешне не идентичны
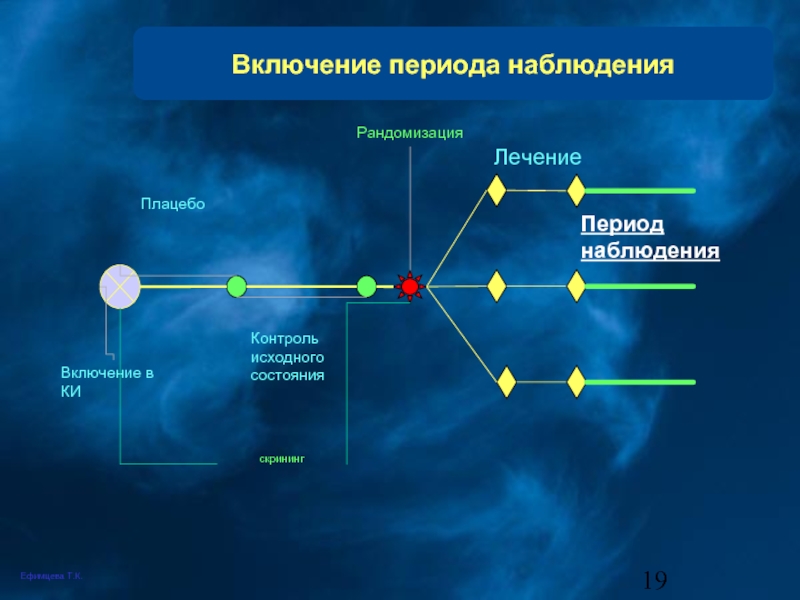
Слайд 19Включение периода наблюдения
скрининг
Включение в КИ
Плацебо
Контроль исходного состояния
Рандомизация
Период
наблюдения
Лечение
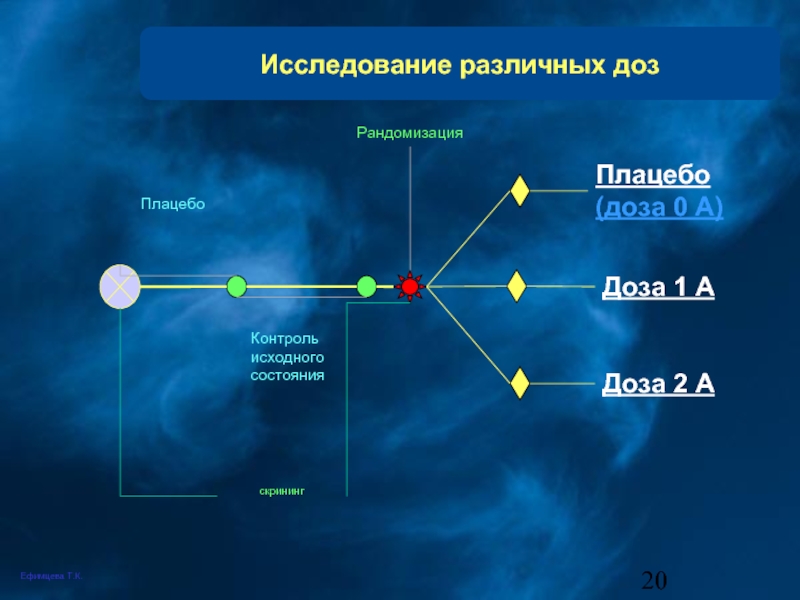
Слайд 20Исследование различных доз
скрининг
Плацебо
Контроль исходного состояния
Рандомизация
Плацебо (доза 0 А)
Доза 2 А
Доза
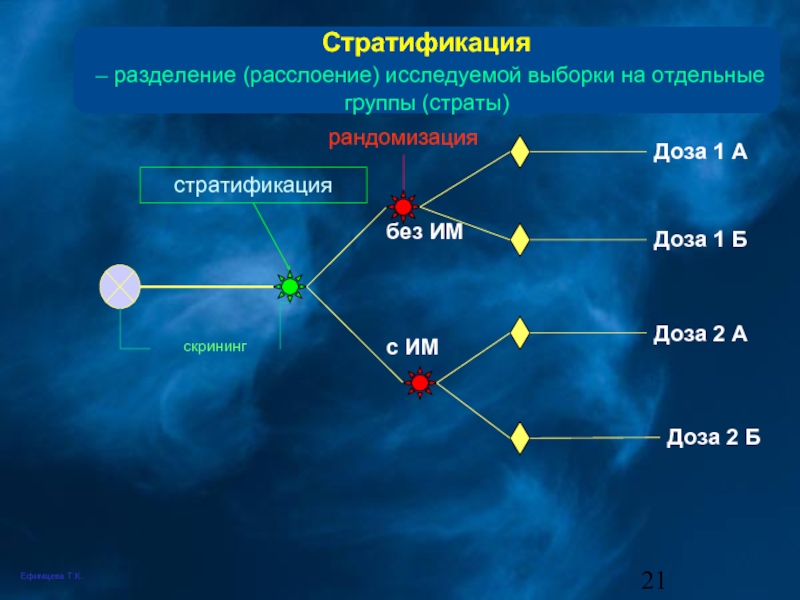
Слайд 21Стратификация
– разделение (расслоение) исследуемой выборки на отдельные группы (страты)
скрининг
Доза 1
Доза 2 Б
Доза 1 Б
Доза 2 А
рандомизация
стратификация
без ИМ
с ИМ
Слайд 22
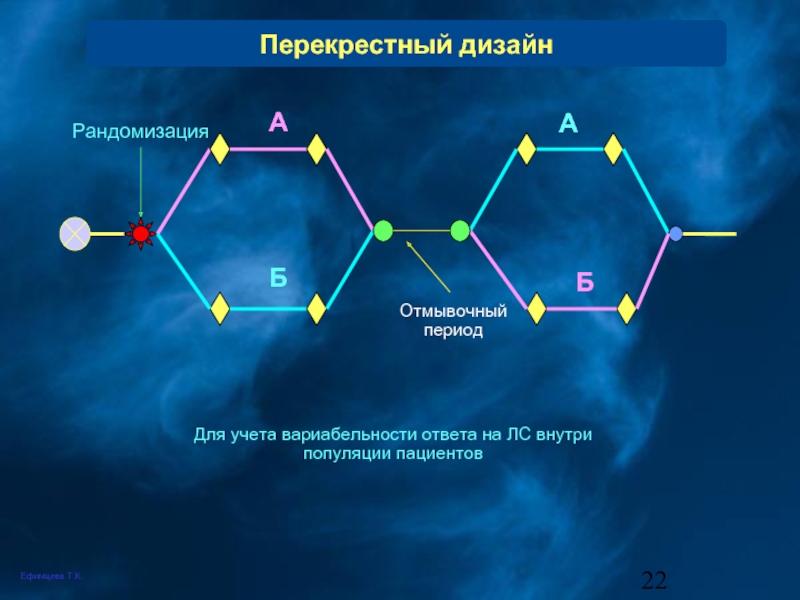
Перекрестный дизайн
Рандомизация
Отмывочный период
Для учета вариабельности ответа на ЛС внутри популяции пациентов
Б
А
А
Б
Слайд 23Технологии проведения КИ
Этапы исследования
Включение пациента в исследование
Скрининг
- Подготовительный (вводный) период
-
Период лечения
Период последующего наблюдения
Дизайн исследования зависит от фазы клинической разработки ЛП и задач, стоящих перед конкретным испытанием
Слайд 24Технологии проведения КИ
Многоцентровые клинические испытания -
- клиническое испытание, проводимое по единому
GCP