проведение
исследований биоэквивалентности
ВВЕДЕНИЕ
Presented by
John Gordon, Ph.D.
Consultant to WHO
e-mail: john_gordon@hc-sc.gc.ca
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дизайн и проведение исследований биоэквивалентности ВВЕДЕНИЕ Presented by John Gordon, Ph.D. Consultant to WHO e-mail: john_gordon@hc-sc.gc.ca презентация
Содержание
- 1. Дизайн и проведение исследований биоэквивалентности ВВЕДЕНИЕ Presented by John Gordon, Ph.D. Consultant to WHO e-mail: john_gordon@hc-sc.gc.ca
- 2. Kyiv, 2005-10-05 Предпосылки: Препарат, впервые вышедший на
- 3. Kyiv, 2005-10-05 Предпосылки: Разные препараты с одинаковым
- 4. Kyiv, 2005-10-05 Фармацевтическая эквивалентность Одинаковое количество одинакового
- 5. Kyiv, 2005-10-05 Иногда фармацевтической эквивалентности достаточно Водные
- 6. Kyiv, 2005-10-05 Иногда — нет Фармацевтическая эквивалентность
- 7. Kyiv, 2005-10-05 Фармацевтические эквиваленты Возможные различия Молекулярная
- 8. Kyiv, 2005-10-05 Требуются дополнительные данные Пероральные препараты
- 9. Kyiv, 2005-10-05 Требуются дополнительные данные Препараты системного
- 10. Kyiv, 2005-10-05 Выдача торговой лицензии многоисточниковых препаратов
- 11. Kyiv, 2005-10-05 Выдача торговой лицензии с помощью
- 12. Kyiv, 2005-10-05 Сравнительные фармакокинетические исследования Измерение AФИ
- 13. Kyiv, 2005-10-05 Биодоступность «Скорость и степень всасывания
- 14. Kyiv, 2005-10-05 Важные фармакокинетические параметры AUC: площадь
- 15. Kyiv, 2005-10-05 Зависимость концентрации в плазме от времени Cmax Tmax AUC время концентрация
- 16. Kyiv, 2005-10-05 Биоэквивалентность Два препарата считаются биоэквивалентными,
- 17. Kyiv, 2005-10-05 Терапевтическая эквивалентность Терапевтическая эквивалентность :
- 18. Kyiv, 2005-10-05 Сравнительные фармакодинамические исследования Не рекомендуются,
- 19. Kyiv, 2005-10-05 Сравнительные клинические исследования Невозможность определить
- 20. Kyiv, 2005-10-05 Сравнительные исследования in vitro В
- 21. Kyiv, 2005-10-05 Когда проводят исследования биоэквивалентности? Многоисточниковый
- 22. Kyiv, 2005-10-05 Исследования биоэквивалентности: Основные соображения о
- 23. Kyiv, 2005-10-05 «Золотые стандарты» схемы исследования Одна
- 24. Kyiv, 2005-10-05 Исследования с многократной дозой Клинически предпочтительнее? Менее чувствительны к различиям в составе
- 25. Kyiv, 2005-10-05 Исследования с многократной дозой проводятся,
- 26. Kyiv, 2005-10-05 Исследования с многократной дозой проводятся:
- 27. Kyiv, 2005-10-05 Перекрестный или параллельная схема исследований
- 28. Kyiv, 2005-10-05 Особенности параллельной схемы исследования Достаточно
- 29. Kyiv, 2005-10-05 Схема исследования с приемом натощак
- 30. Kyiv, 2005-10-05 Схема исследования с приемом после
- 31. Kyiv, 2005-10-05 Особенности схемы исследования с приемом
- 32. Kyiv, 2005-10-05 Особенности дизайна с приемом после
- 33. Kyiv, 2005-10-05 Воспроизводимая или невоспроизводимая схема исследований
- 34. Kyiv, 2005-10-05 Воспроизводимая схема исследования Обычно состоит
- 35. Kyiv, 2005-10-05 Воспроизводимая схема исследования Преимущества Больше
- 36. Kyiv, 2005-10-05 Обсуждение Вопросы Комментарии Мнения
Слайд 1Kyiv, 2005-10-05
СЕМИНАР-ТРЕНИНГ ПО КАЧЕСТВУ,
НАДЛЕЖАЩЕЙ ПРОИЗВОДСТВЕННОЙ ПРАКТИКЕ И БИОЭКВИВАЛЕНТНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Дизайн и
Слайд 2Kyiv, 2005-10-05
Предпосылки:
Препарат, впервые вышедший на рынок
Инновационный препарат
Качество
Безопасность и эффективность
Основаны на данных масштабных клинических испытаний
Высокая стоимость
Трата времени
Слайд 3Kyiv, 2005-10-05
Предпосылки:
Разные препараты с одинаковым AФИ
Препараты, вышедшие на рынок позднее
Генерические препараты
Многоисточниковые
препараты
Каким образом эти препараты получают разрешение на маркетинг?
Каким образом эти препараты получают разрешение на маркетинг?
Слайд 4Kyiv, 2005-10-05
Фармацевтическая эквивалентность
Одинаковое количество одинакового AФИ
Соли, эфиры
Одинаковая лекарственная форма
Сопоставимые лекарственные формы
Напр.,
таблетки и капсулы
Одинаковый путь доставки
Достаточно ли фармацевтической эквивалентности?
Одинаковый путь доставки
Достаточно ли фармацевтической эквивалентности?
Слайд 5Kyiv, 2005-10-05
Иногда фармацевтической эквивалентности достаточно
Водные растворы
Растворы для внутривенного введения
Внутримышечного, подкожного
Пероральные растворы
Препараты
для местного применения
Растворы для назального введения
Порошки для приготовления раствора
Газы
Растворы для назального введения
Порошки для приготовления раствора
Газы
Слайд 6Kyiv, 2005-10-05
Иногда — нет
Фармацевтическая эквивалентность сама по себе не обязательно обозначает
терапевтическую эквивалентность
терапевтическая эквивалентность :
Фармацевтическая эквивалентность
Некоторые показатели безопасности и эффективности при приеме одинаковых доз
терапевтическая эквивалентность :
Фармацевтическая эквивалентность
Некоторые показатели безопасности и эффективности при приеме одинаковых доз
Слайд 7Kyiv, 2005-10-05
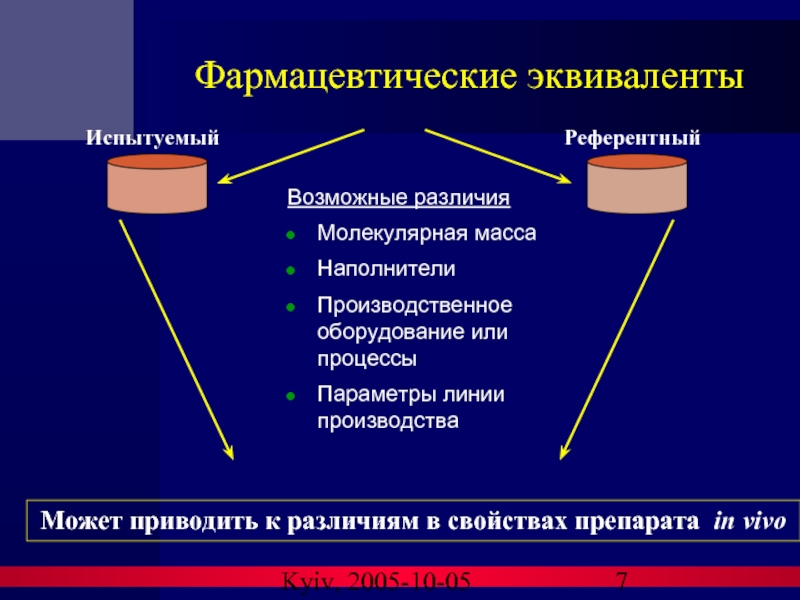
Фармацевтические эквиваленты
Возможные различия
Молекулярная масса
Наполнители
Производственное оборудование или процессы
Параметры линии производства
Испытуемый
Референтный
Может
приводить к различиям в свойствах препарата in vivo
Слайд 8Kyiv, 2005-10-05
Требуются дополнительные данные
Пероральные препараты немедленного высвобождения с системным действием
Обычно требуются
для пероральных препаратов твердых лекарственных
Использование при серьезных заболеваниях
Узкий терапевтический коридор
Проблемы с биодоступностью AФИ
Проблемный полиморфизм, взаимодействие вспомогательных веществ и воздействие производственного процесса
Использование при серьезных заболеваниях
Узкий терапевтический коридор
Проблемы с биодоступностью AФИ
Проблемный полиморфизм, взаимодействие вспомогательных веществ и воздействие производственного процесса
Слайд 9Kyiv, 2005-10-05
Требуются дополнительные данные
Препараты системного действия для перорального приема с модифицированным
высвобождением
Комбинированные препараты с фиксированной дозой системного действия
Если хотя бы один один компонент требует исследования
Не пероральные / не парентеральные препараты системного действия
Препараты не в форме раствора не системного действия
Комбинированные препараты с фиксированной дозой системного действия
Если хотя бы один один компонент требует исследования
Не пероральные / не парентеральные препараты системного действия
Препараты не в форме раствора не системного действия
Слайд 10Kyiv, 2005-10-05
Выдача торговой лицензии многоисточниковых препаратов
Масштабные клинические испытания для подтверждения безопасности
и эффективности
Взаимозаменяемость?
Подтверждение эквивалентности относительно референтного препарата (сравнения)
Взаимозаменяемость
Терапевтическая эквивалентность
Взаимозаменяемость?
Подтверждение эквивалентности относительно референтного препарата (сравнения)
Взаимозаменяемость
Терапевтическая эквивалентность
Слайд 11Kyiv, 2005-10-05
Выдача торговой лицензии с помощью эквивалентности
Методы, используемые для оценки эквивалентности:
Сравнительные
фармакокинетические исследования
Сравнительные фармакокинетические исследования
Сравнительные клинические испытания
Сравнительные испытания in vitro
Сравнительные фармакокинетические исследования
Сравнительные клинические испытания
Сравнительные испытания in vitro
Слайд 12Kyiv, 2005-10-05
Сравнительные фармакокинетические исследования
Измерение AФИ in vivo
“Некоторые” взаимосвязи между концентрацией
и безопасностью/эффективностью
Ключ — свойства препарата
Сравнительная биодоступность
Ключ — свойства препарата
Сравнительная биодоступность
Слайд 13Kyiv, 2005-10-05
Биодоступность
«Скорость и степень всасывания AФИ из лекарственной формы и поступления
в системный кровоток.»
Примечание:
Внутривенный путь доставки = 100% биодоступность
Примечание:
Внутривенный путь доставки = 100% биодоступность
Слайд 14Kyiv, 2005-10-05
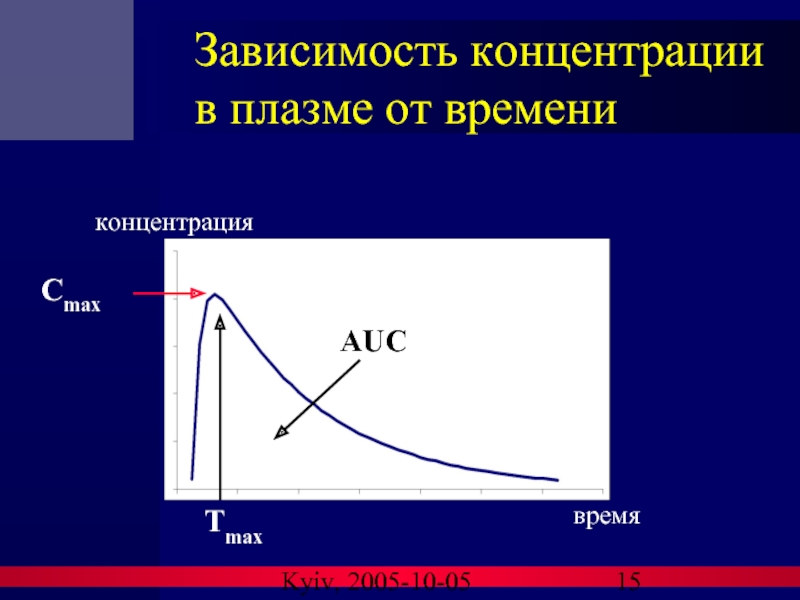
Важные фармакокинетические параметры
AUC: площадь под кривой зависимости концентрации от времени
⇒ измерение длительности биоэквивалентности
Cmax: зафиксированный пик концентрации лекарственного средства ⇒ измерение как степени всасывания, так и протяженности биоэквивалентности
tmax: время от момента приема препарата до достижения Сmax ⇒ измерение степени всасывания
Cmax: зафиксированный пик концентрации лекарственного средства ⇒ измерение как степени всасывания, так и протяженности биоэквивалентности
tmax: время от момента приема препарата до достижения Сmax ⇒ измерение степени всасывания
Слайд 16Kyiv, 2005-10-05
Биоэквивалентность
Два препарата считаются биоэквивалентными, если
они фармацевтически эквивалентны и
их биодоступность (скорость
и степень всасывания) после введения в одинаковой молярной дозе сходны в такой степени, что их эффекты будут по существу одинаковыми
Слайд 17Kyiv, 2005-10-05
Терапевтическая эквивалентность
Терапевтическая эквивалентность :
Фармацевтическая эквивалентность
Одинаковый профиль безопасности и эффективности после
приема в одной молярной дозе: биоэквивалентны
Взаимозаменяемость
Взаимозаменяемость
Слайд 18Kyiv, 2005-10-05
Сравнительные фармакодинамические исследования
Не рекомендуются, если:
AФИ всасывается в системный кровоток
есть
возможность провести фармакодинамические исследования
Местное действие / не всасывается в системный кровоток
Местное действие / не всасывается в системный кровоток
Слайд 19Kyiv, 2005-10-05
Сравнительные клинические исследования
Невозможность определить фармакокинетический профиль
Нехватка походящих фармакодинамических конечных точек
Недостаточная
чувствительность
Слайд 20Kyiv, 2005-10-05
Сравнительные исследования in vitro
В некоторых обстоятельствах могут заменять исследования in
vivo
Обсуждение требований относительно отмены
Обсуждение требований относительно отмены
Слайд 21Kyiv, 2005-10-05
Когда проводят исследования биоэквивалентности?
Многоисточниковый препарат в сравнении с инновационным
До-регистрационные изменения
Перекрестные исследования
Пост-регистрационные изменения
Существующие препараты в новых дозах
Слайд 22Kyiv, 2005-10-05
Исследования биоэквивалентности:
Основные соображения о схеме исследования
Минимизировать вариабельность, не связанную с
составом
Не допустить необъективности
ПОМНИТЬ: цель — сравнить свойства двух препаратов
Не допустить необъективности
ПОМНИТЬ: цель — сравнить свойства двух препаратов
Слайд 23Kyiv, 2005-10-05
«Золотые стандарты» схемы исследования
Одна доза, два периода, перекрестность
Здоровые добровольцы
Субъекты получают
каждый препарат однократно
Достаточный период вымывания
Достаточный период вымывания
Слайд 24Kyiv, 2005-10-05
Исследования с многократной дозой
Клинически предпочтительнее?
Менее чувствительны к различиям в составе
Слайд 25Kyiv, 2005-10-05
Исследования с многократной дозой проводятся, если:
Лекарственное средство сильнодействующее/токсичное при приеме
у здоровых добровольцев
Пациенты / отсутствие противопоказаний для лечения
Препарат продленного/модифицированного высвобождения
Кумуляция при использовании рекомендованного междозового интервала
В дополнение к исследованиям с однократной дозой
Пациенты / отсутствие противопоказаний для лечения
Препарат продленного/модифицированного высвобождения
Кумуляция при использовании рекомендованного междозового интервала
В дополнение к исследованиям с однократной дозой
Слайд 26Kyiv, 2005-10-05
Исследования с многократной дозой проводятся:
Нелинейная фармакокинетика при стат. анализе (или
т.н. насыщаемый метаболизм)
Оценка недостаточно специфична для исследования с однократной дозой
Оценка недостаточно специфична для исследования с однократной дозой
Слайд 27Kyiv, 2005-10-05
Перекрестный или параллельная схема исследований
Предпочтительнее перекрестная:
Сравнение на одном испытуемом
Меньше вариабельность
Обычно
требуется меньше испытуемых
Параллельная схема может быть полезна, если:
Лекарственные средства с очень продолжительным периодом полувыведения
Перекрестная схема не целесообразна
Параллельная схема может быть полезна, если:
Лекарственные средства с очень продолжительным периодом полувыведения
Перекрестная схема не целесообразна
Слайд 28Kyiv, 2005-10-05
Особенности параллельной схемы исследования
Достаточно испытуемых
Адекватная выборка
Завершение желудочно-кишечного транзита / процесс
всасывания
Обычно достаточно 72 часов
Обычно достаточно 72 часов
Слайд 29Kyiv, 2005-10-05
Схема исследования с приемом натощак или после еды
Предпочтительна схема исследования
с приемом натощак:
Минимизация вариабельности, не связанной с составом
Выше способность к определению различий состава
Минимизация вариабельности, не связанной с составом
Выше способность к определению различий состава
Слайд 30Kyiv, 2005-10-05
Схема исследования с приемом после еды проводятся, если:
прием натощак вызывает
сильный желудочно-кишечный (ЖК) дискомфорт
маркировкой предусмотрено условие приема после еды
маркировкой предусмотрено условие приема после еды
Слайд 31Kyiv, 2005-10-05
Особенности схемы исследования с приемом после еды
Рацион зависит от используемой
диеты и пищевых традиций
Основания для выбора схемы исследования с приемом после еды:
Избежание (ЖК) дискомфорта
Небольшое количество пищи для минимизации воздействия
Требуется в зависимости от особенностей вещества / лекарственной формы
Препараты модифицированного высвобождения
Основания для выбора схемы исследования с приемом после еды:
Избежание (ЖК) дискомфорта
Небольшое количество пищи для минимизации воздействия
Требуется в зависимости от особенностей вещества / лекарственной формы
Препараты модифицированного высвобождения
Слайд 32Kyiv, 2005-10-05
Особенности дизайна с приемом после еды (продолж.)
Требуется в зависимости от
особенностей вещества / лекарственной формы
Осложненная фармакокинетика
Известное воздействие пищи на лекарственное вещество
Свойства пищи, предусмотренные дизайном как наиболее неблагоприятные
Высокое содержание жиров
Высокий калораж
Горячая
Осложненная фармакокинетика
Известное воздействие пищи на лекарственное вещество
Свойства пищи, предусмотренные дизайном как наиболее неблагоприятные
Высокое содержание жиров
Высокий калораж
Горячая
Слайд 33Kyiv, 2005-10-05
Воспроизводимая или невоспроизводимая схема исследований
Стандартный подход:
Невоспротзводимый
Однократный прием каждого препарата
Средняя
биоэквивалентность
Слайд 34Kyiv, 2005-10-05
Воспроизводимая схема исследования
Обычно состоит из четырех периодов
Каждый препарат принимают дважды
Вариабельность
внутри субъекта
Субъект X взаимодействие ингредиентов
Возможны различные подходы
Средняя биоэквивалентность
Индивидуальная биоэквивалентность
Субъект X взаимодействие ингредиентов
Возможны различные подходы
Средняя биоэквивалентность
Индивидуальная биоэквивалентность
Слайд 35Kyiv, 2005-10-05
Воспроизводимая схема исследования
Преимущества
Больше информации
Возможность различных подходов при оценке
Недостатки
Больше ответственности перед
добровольцами
Большее число приемов
Выше стоимость проведения
Большее число приемов
Выше стоимость проведения