- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Життя – це спосіб існування білкових тіл презентация
Содержание
- 1. Життя – це спосіб існування білкових тіл
- 2. Історія дослідження В 1728р. Я.Бекарі виділив із
- 3. Білки були вперше описані шведським хіміком Єнсом
- 4. Історія вивчення білків О.Я.Данилевський. Ф.Сенгер Л.Полінг
- 5. Перші тривимірні структури білків гемоглобіну і міоглобіну
- 6. Білки Порівняльні розміри білків та пептидів.
- 7. Що таке білки? Білки – це високомолекулярні біополімери , мономерами яких є залишки амінокислоти.
- 8. Гетеромерні біополімери міоглобін колаген гемоглобін
- 9. Різноманітність білкових молекул забезпечується різними комбінаціями 20 основних (золотих) амінокислот.
- 10. Розмір білка може вимірюватися за числом амінокислот
- 11. Найменший білок також важко визначити, багато
- 12. Хімічний склад білків
- 13. Класифікація білків
- 14. Хімічні властивості білків 1. Гідроліз (кислотно-основний, ферментативний),
- 15. Кольорові реакції на білки 1. Ксантопротеїнова –
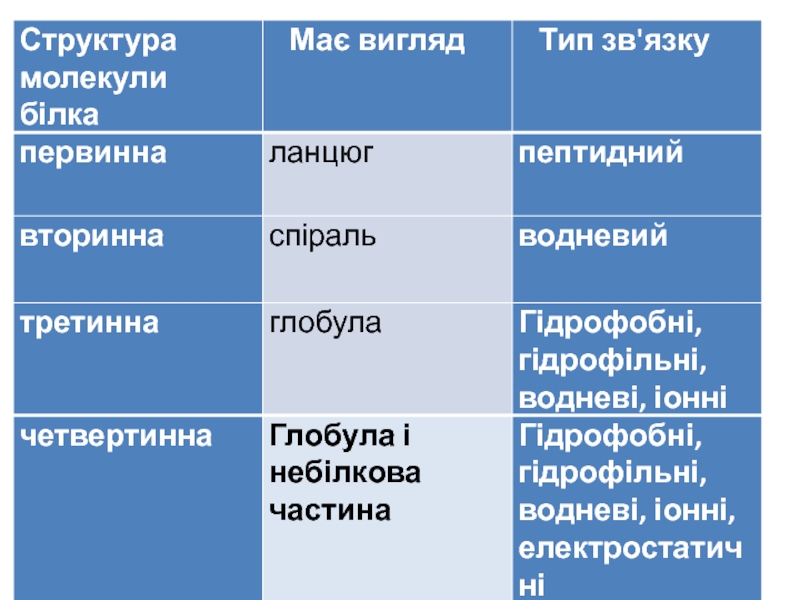
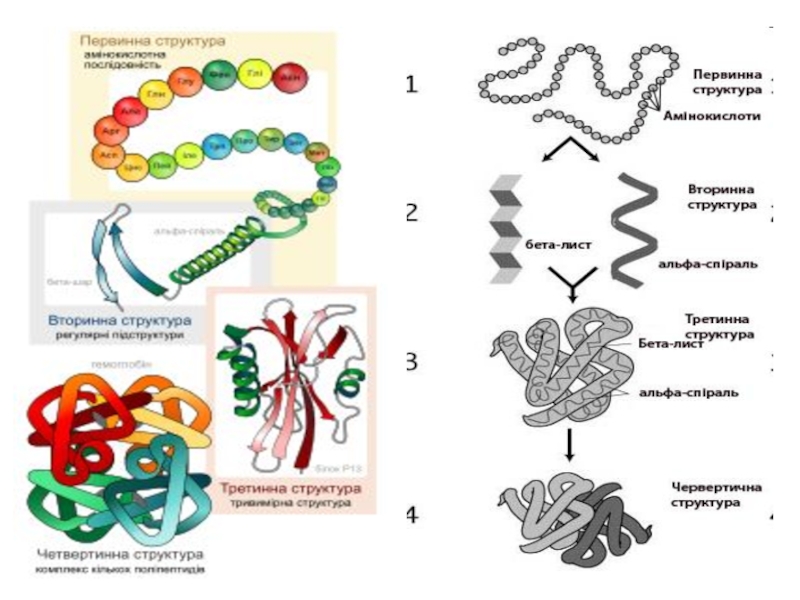
- 17. Структури білків Первинна структура білків — послідовність амінокислот у пептидному ланцюжку.
- 18. Вторинна структура білків — характеризує просторову організацію
- 19. Третинна структура білків зумовлена здатністю поліпептидної спіралі
- 20. Четвертинна структура білків— комплекс кількох молекул білка
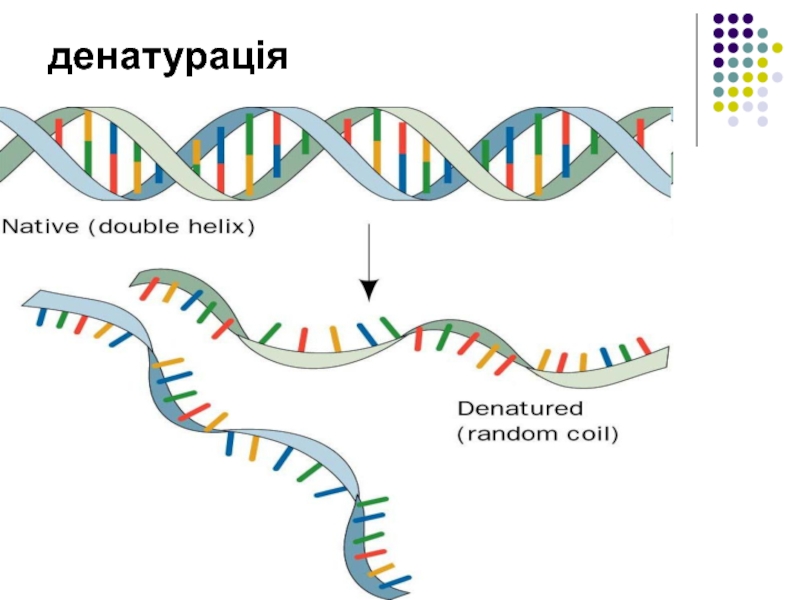
- 23. Властивості білків Денатурація — зміна високорівневої структури молекул.
- 24. денатурація
- 25. Амінокислоти
- 26. Назви основних амінокислот: Аланін.
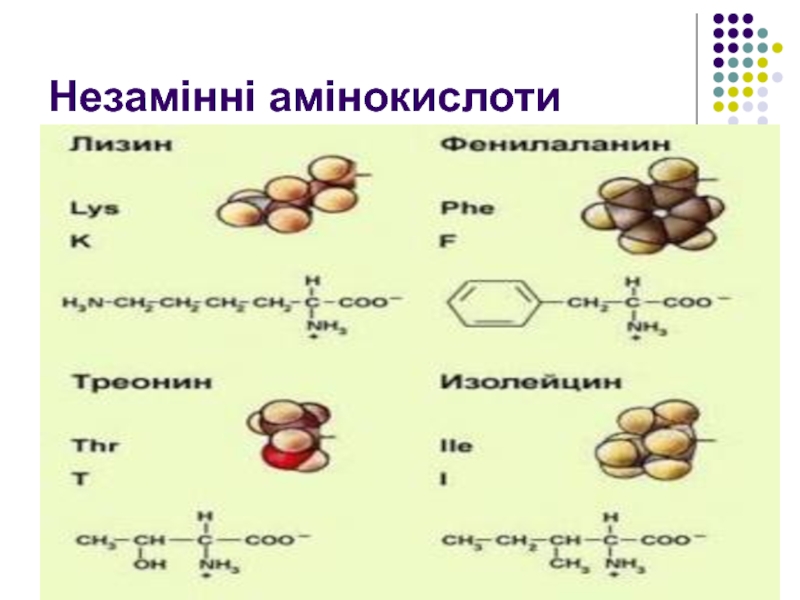
- 27. Незамінні амінокислоти
Слайд 2Історія дослідження
В 1728р. Я.Бекарі виділив із пшеничного борошна клейковину і дослідив
Білки були виділені в окремий клас біологічних молекул в 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці.
Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Антуан Франсуа де Фуркруа,
основоположник дослідження білків.
Слайд 3Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838
Слайд 5Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою
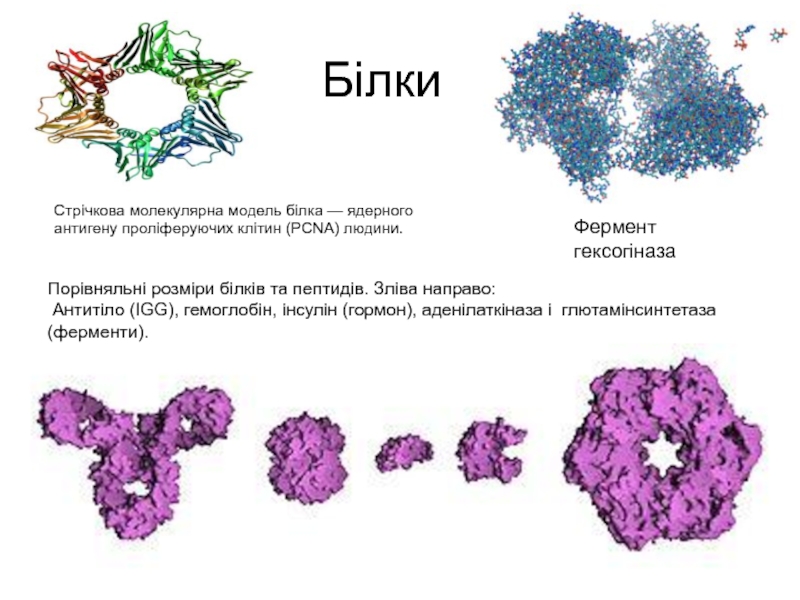
Слайд 6Білки
Порівняльні розміри білків та пептидів. Зліва направо:
Антитіло (IGG), гемоглобін,
Фермент гексогіназа
Стрічкова молекулярна модель білка — ядерного антигену проліферуючих клітин (PCNA) людини.
Слайд 7Що таке білки?
Білки – це високомолекулярні біополімери , мономерами яких є
Слайд 9Різноманітність білкових молекул забезпечується різними комбінаціями 20 основних (золотих) амінокислот.
Слайд 10Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної
Слайд 11
Найменший білок також важко визначити, багато білків. що мають ензиматичну активність,
Слайд 12 Хімічний склад білків
Елементарний склад:
Грен, 1809 р. Браконно, 1820 р
C – 55 -60%
глікокол(гідроліз желатину) 19-24%
N – 15- 18%
H – 6-8%
S – 0.4-2%
Деякі метали
Гемоглобін – C3032H4816O872N780S8Fe4.
Mr білка яйця = 36 000,
Mr білка мязів = 1 500 000
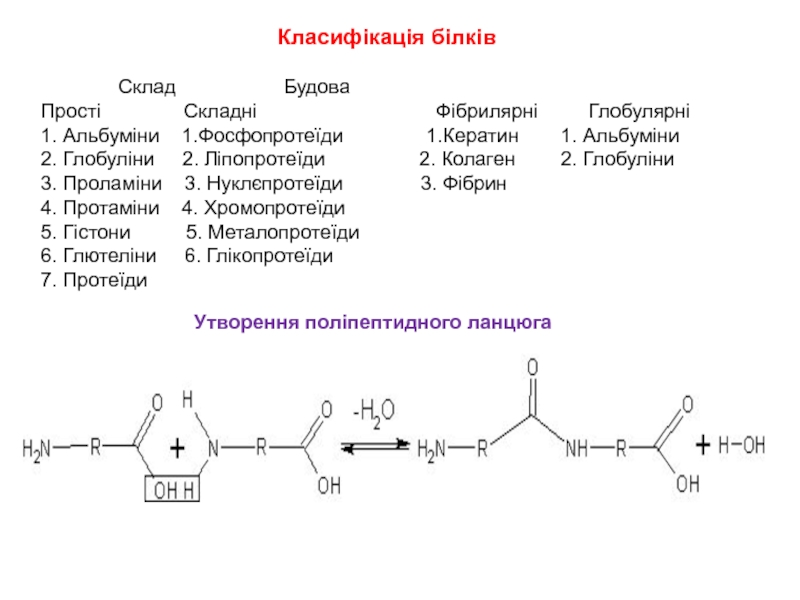
Слайд 13Класифікація білків
Склад
Прості Складні Фібрилярні Глобулярні
1. Альбуміни 1.Фосфопротеїди 1.Кератин 1. Альбуміни
2. Глобуліни 2. Ліпопротеїди 2. Колаген 2. Глобуліни
3. Проламіни 3. Нуклєпротеїди 3. Фібрин
4. Протаміни 4. Хромопротеїди
5. Гістони 5. Металопротеїди
6. Глютеліни 6. Глікопротеїди
7. Протеїди
Утворення поліпептидного ланцюга
Слайд 14Хімічні властивості білків
1. Гідроліз (кислотно-основний, ферментативний), в результаті якого утворються амінокислоти.
2.
Денатурований білок втрачає свої біологічні властивості.
Слайд 15Кольорові реакції на білки
1. Ксантопротеїнова – взаємодія з концентрованою азотною кислотою,
2. Біуретова – взаємодія слаболужних розчинів білків с розчином сульфату міді (II), в результаті якої зявляється фиолетово-синє забарвлення.
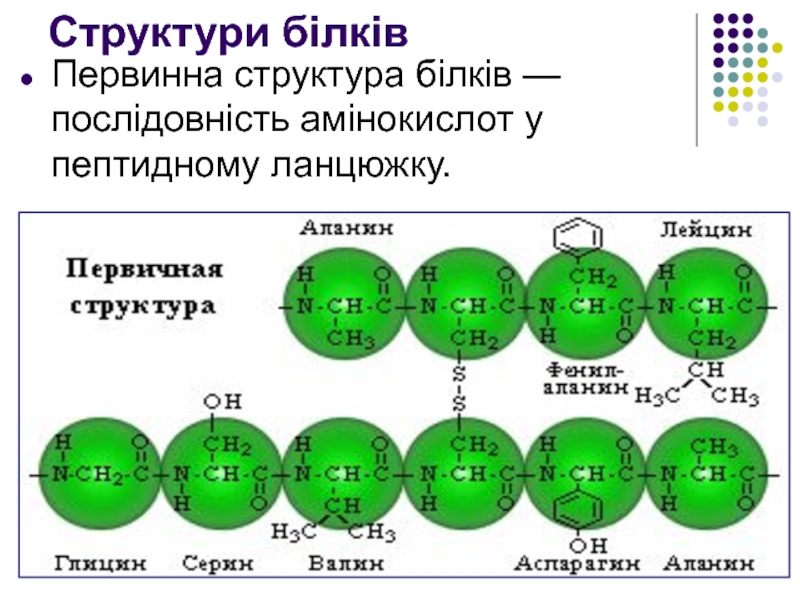
Слайд 17Структури білків
Первинна структура білків — послідовність амінокислот у пептидному ланцюжку.
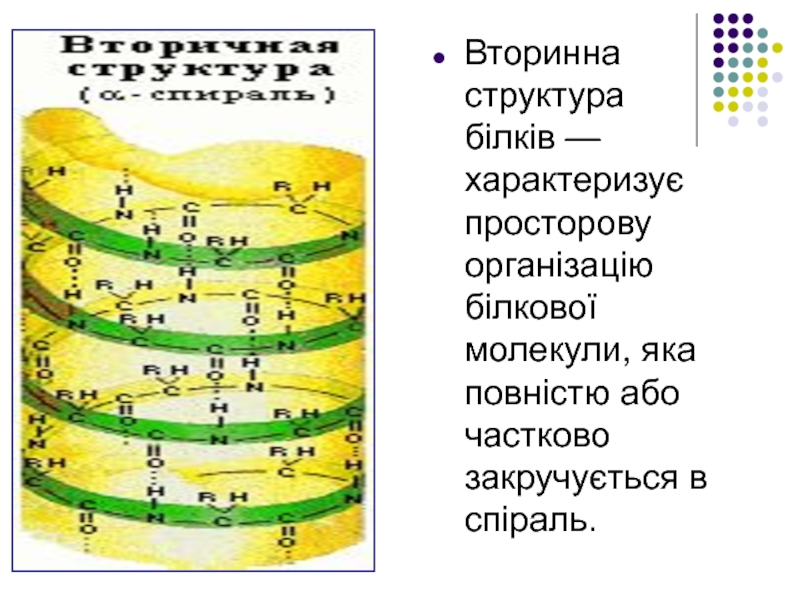
Слайд 18
Вторинна структура білків — характеризує просторову організацію білкової молекули, яка повністю або
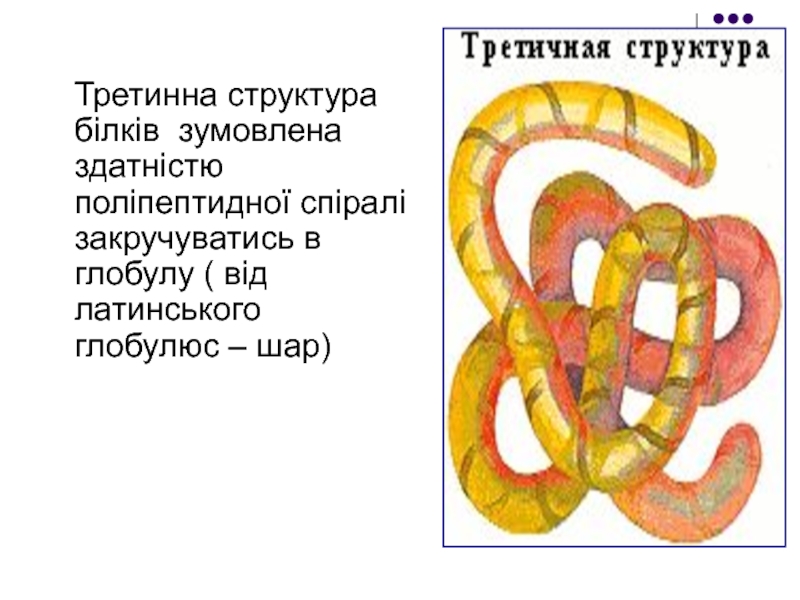
Слайд 19Третинна структура білків зумовлена здатністю поліпептидної спіралі закручуватись в глобулу (
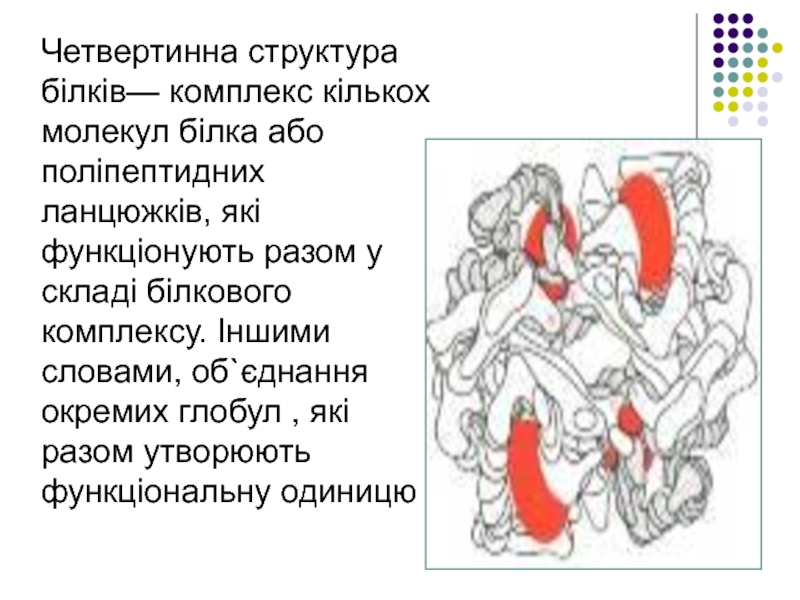
Слайд 20Четвертинна структура білків— комплекс кількох молекул білка або поліпептидних ланцюжків, які
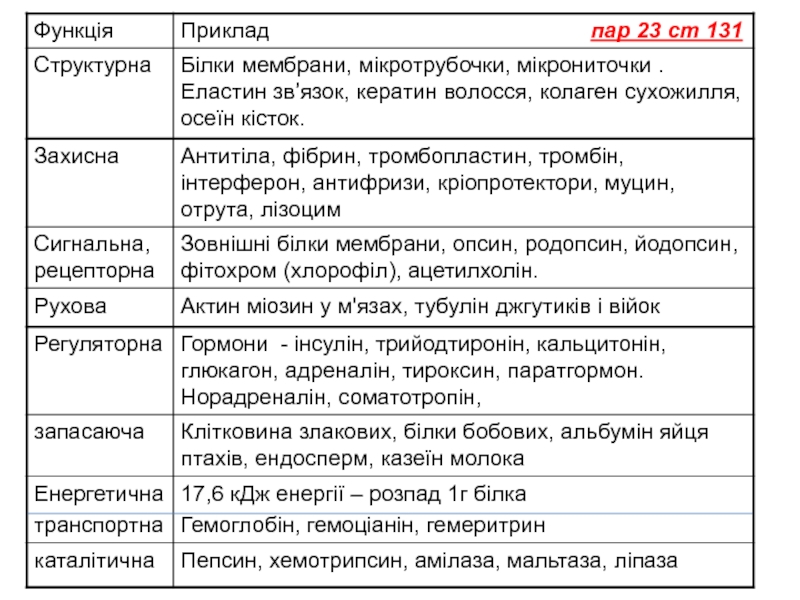
Слайд 23Властивості білків
Денатурація — зміна високорівневої структури молекул.
Ренатурація — відновлення структури білка на початковій
Деструкція - процес порушення первинної структури білків.
Слайд 26Назви основних амінокислот:
Аланін.
Аргінін. 12. Лізин
Аспарагін. 13. Метіонін
Аспарагінова кислота. 14. Пролін
Валін. 15. Серин.
Гістидин. 16. Тирозин
Гліцин. 17. Треонін
Глутамін. 18. Триптофан
Глутамінова кислота. 19. Фенілаланін.
Ізолейцин. 20. Цистеїн.
Визначити кислі, основні, нейтральні,
полярні, неполярні,
позитивно- та негативно заряджені,
замінні, незамінні, .
Пар 21, форзац підручника