- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Введение в биохимию. Строение и функции белков презентация
Содержание
- 1. Введение в биохимию. Строение и функции белков
- 2. БИОХИМИЯ – наука, изучающая химический состав
- 3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ – ПОЗНАНИЕ ХИМИЧЕСКИХ
- 4. Метаболизм – совокупность химических превращений
- 5. Метаболизм Катаболизм –
- 6. БЕЛКИ (протеины) – ВЫСОКОМОЛЕКУЛЯРНЫЕ
- 7. Функции белков Каталитические (ферменты) Регуляторные
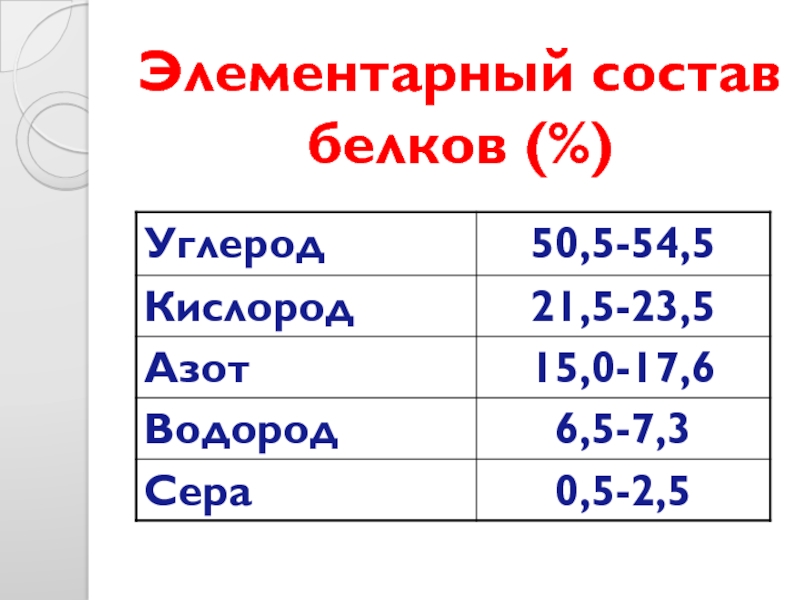
- 8. Элементарный состав белков (%)
- 9. БЕЛКИ – биополимеры, структурными единицами которых
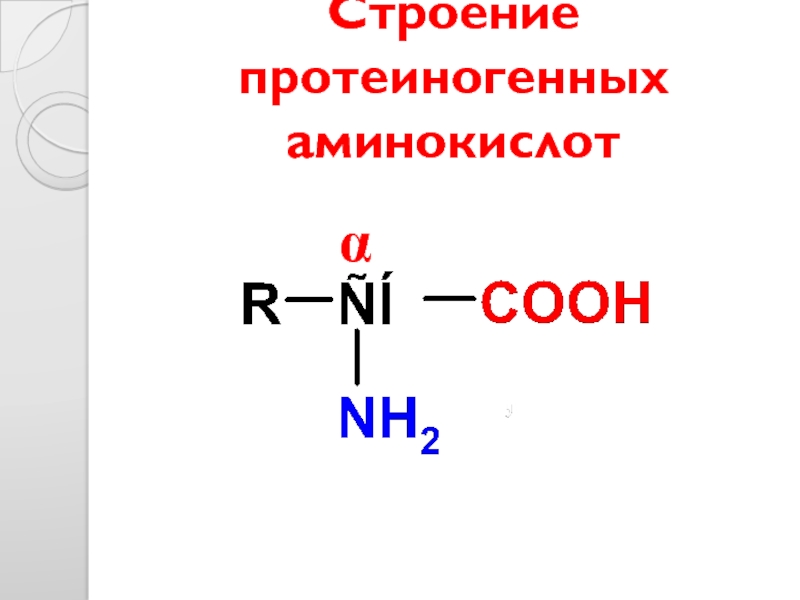
- 10. Строение протеиногенных аминокислот α
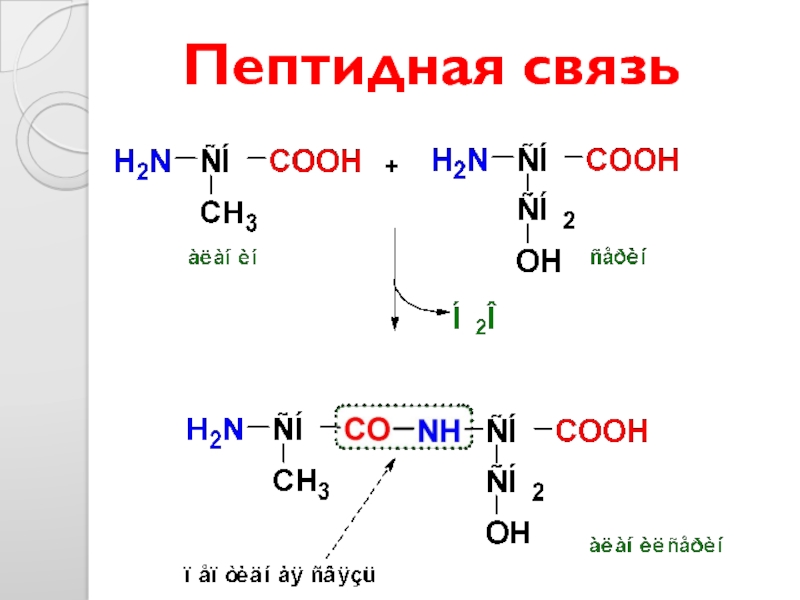
- 11. Пептидная связь
- 12. Классификация производных аминокислот 2-10 аминокислотных остатков –
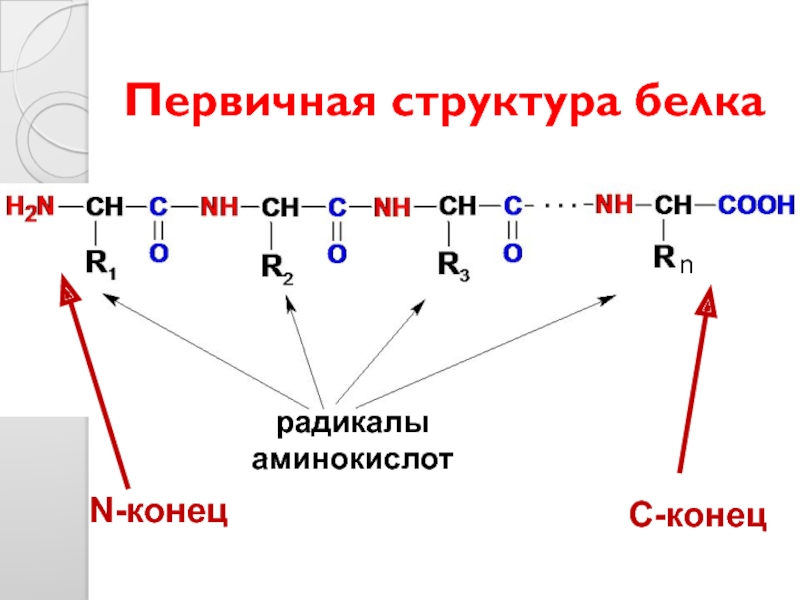
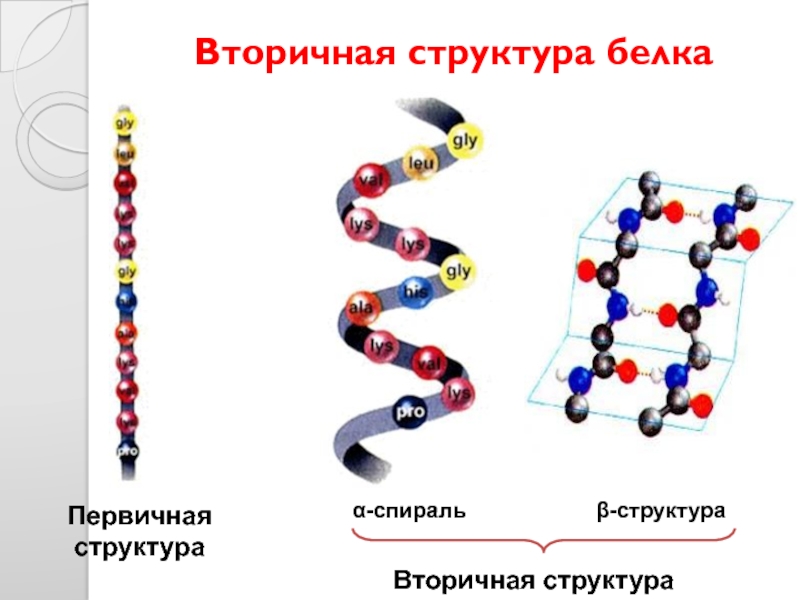
- 13. Первичная структура белка n N-конец С-конец радикалы аминокислот
- 14. Первичная структура определяет: Физико-химические свойства (размер, массу,
- 15. Закономерности первичной стуктуры 1. Чем важнее
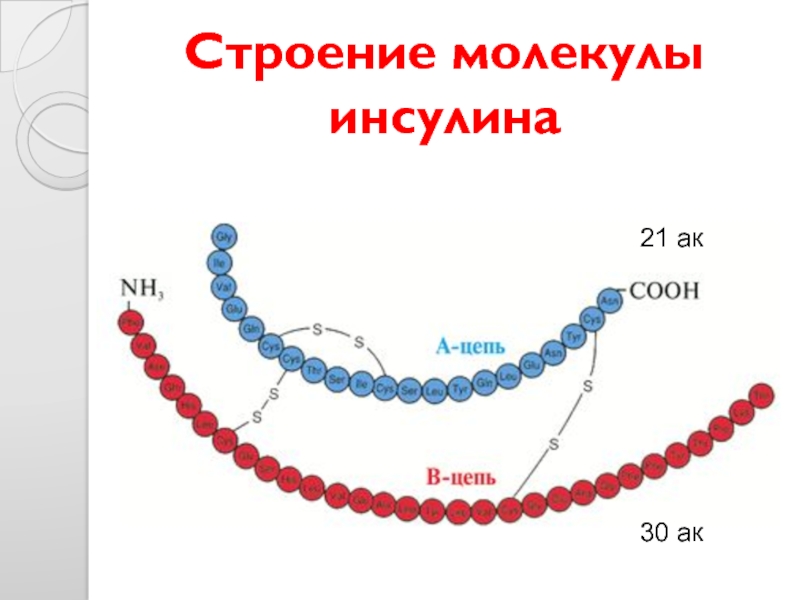
- 16. Строение молекулы инсулина 21 ак 30 ак
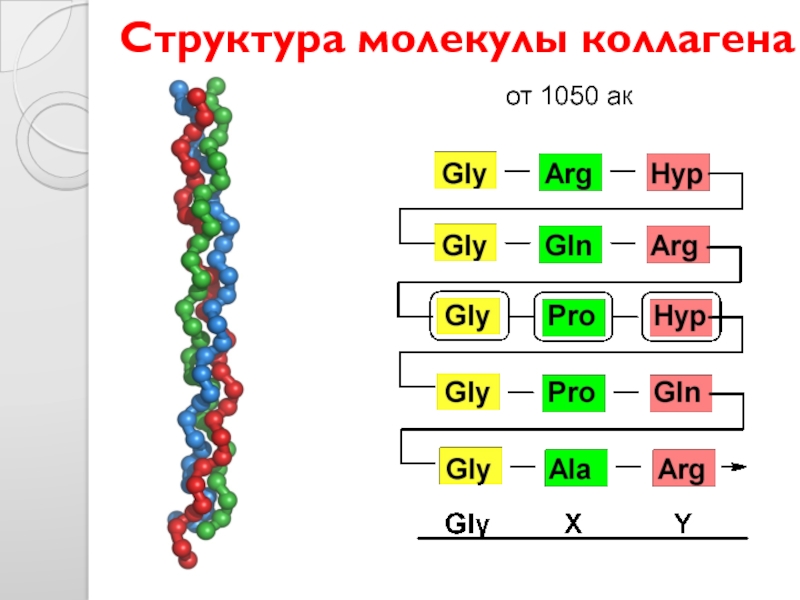
- 17. Структура молекулы коллагена от 1050 ак
- 18. растяжение
- 19. Закономерности первичной стуктуры 2. Чем важнее
- 20. Закономерности первичной стуктуры 3. Чем ближе
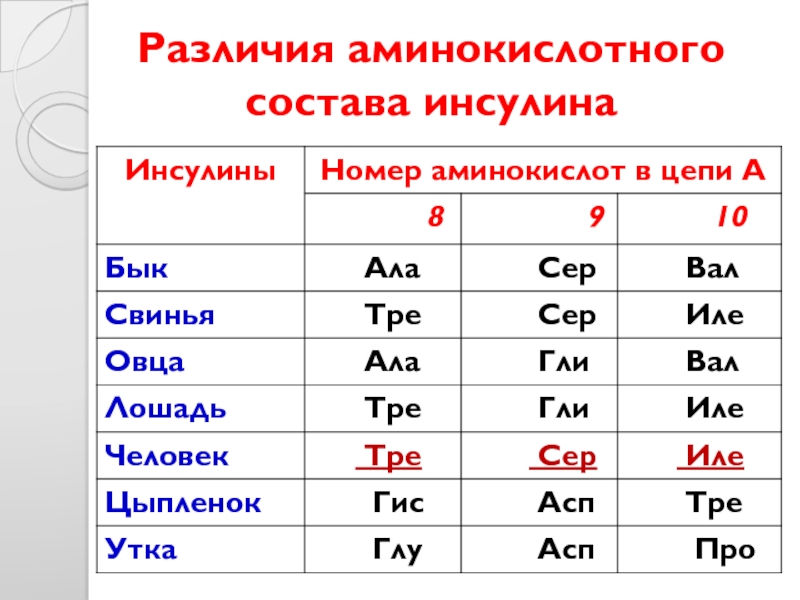
- 21. Различия аминокислотного состава инсулина
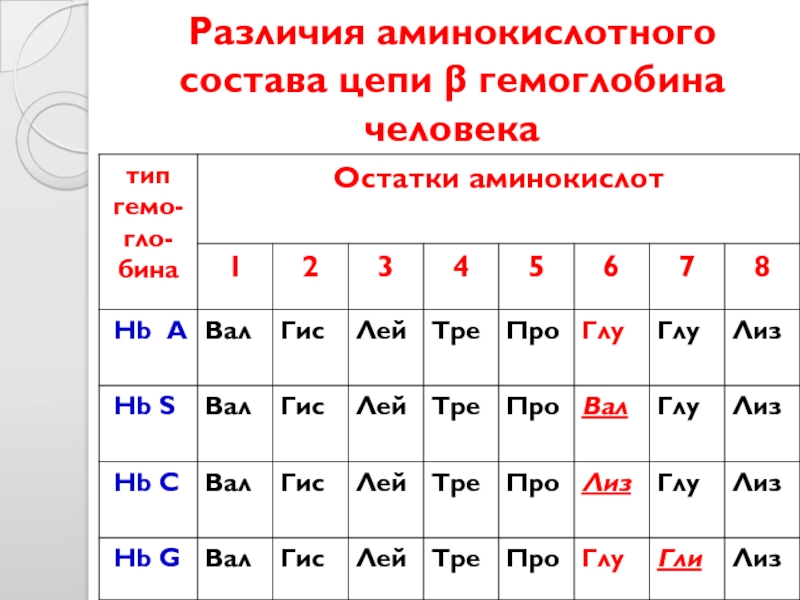
- 22. Различия аминокислотного состава цепи β гемоглобина человека
- 23. Методы изучения I структуры белка Методы
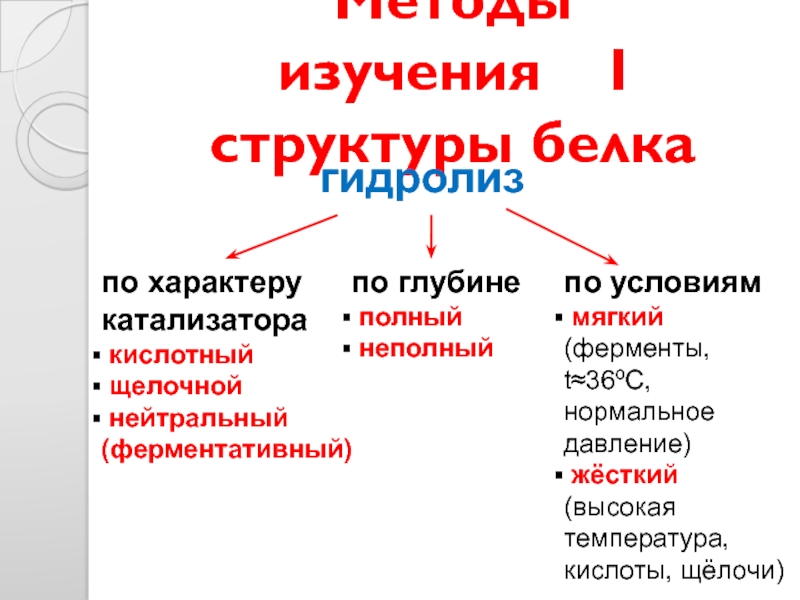
- 24. Методы изучения I структуры белка гидролиз
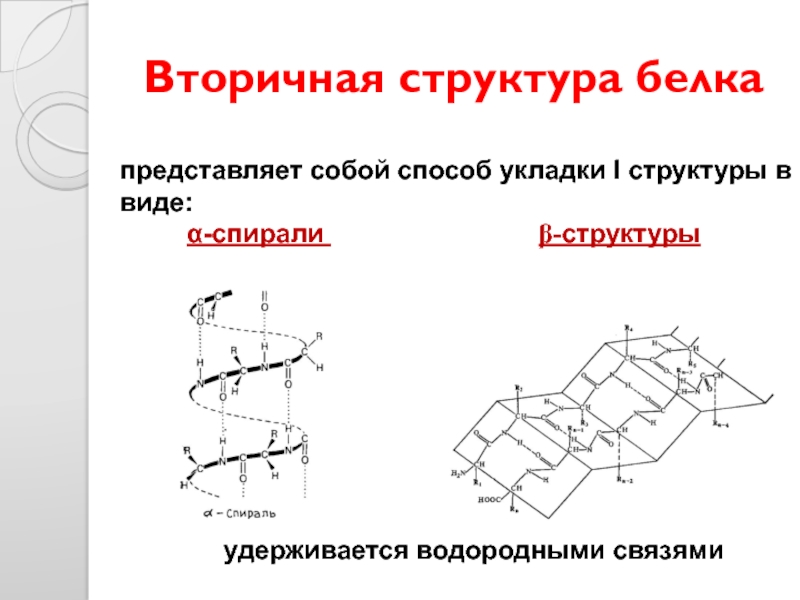
- 25. представляет собой способ укладки I структуры в
- 26. Вторичная структура белка Первичная структура α-спираль
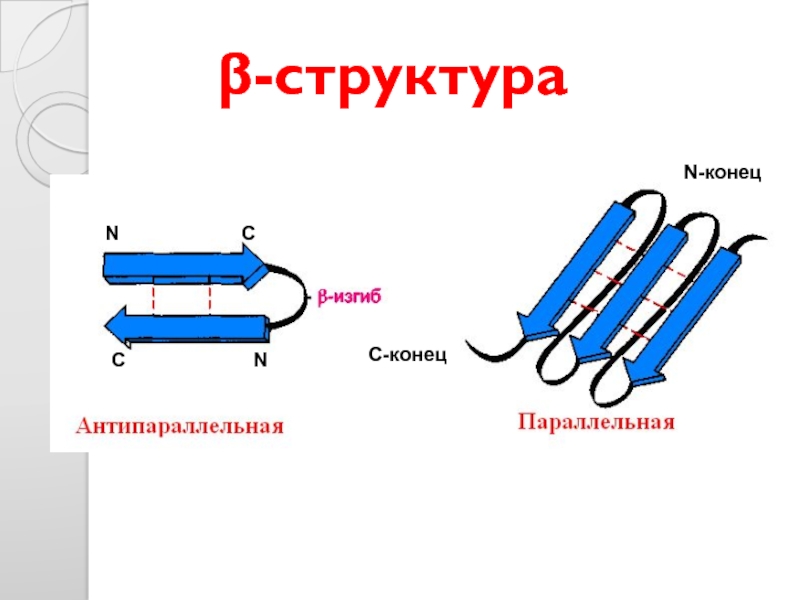
- 27. β-структура С-конец N-конец N
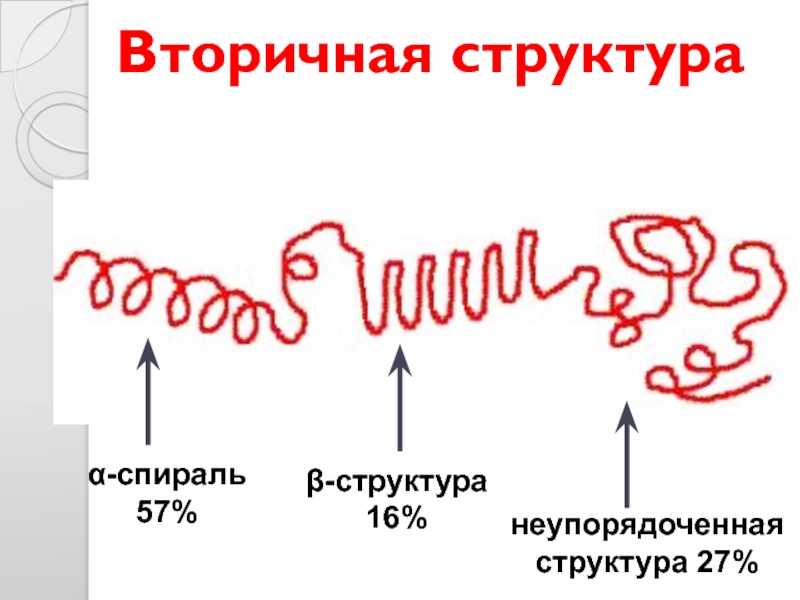
- 28. Вторичная структура α-спираль 57% β-структура 16% неупорядоченная структура 27%
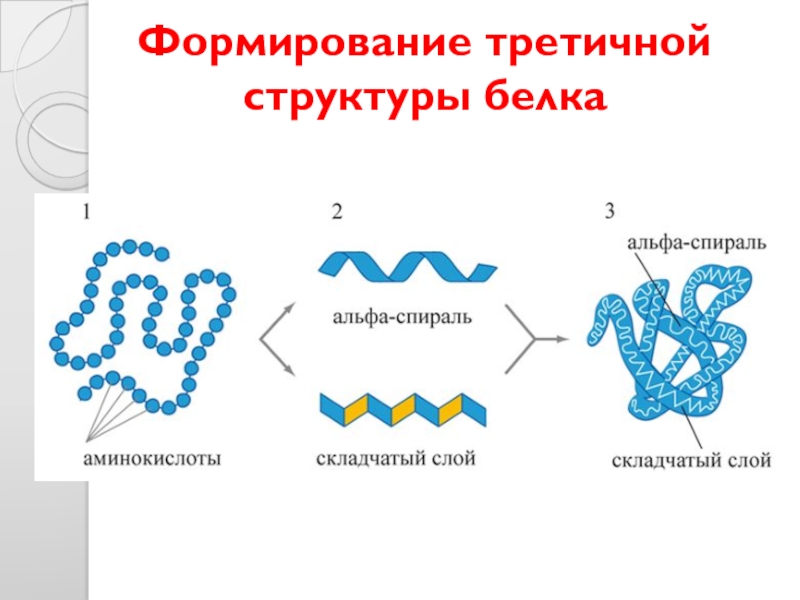
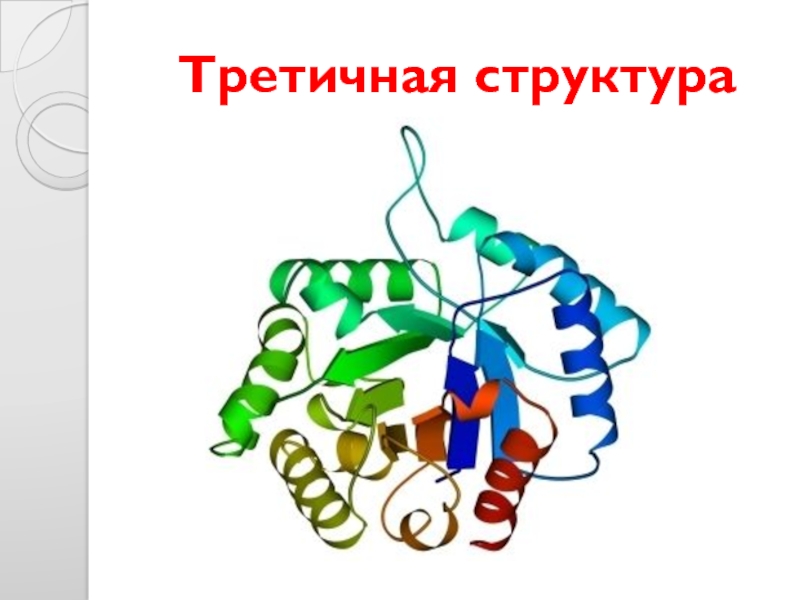
- 29. Формирование третичной структуры белка
- 30. Третичная структура
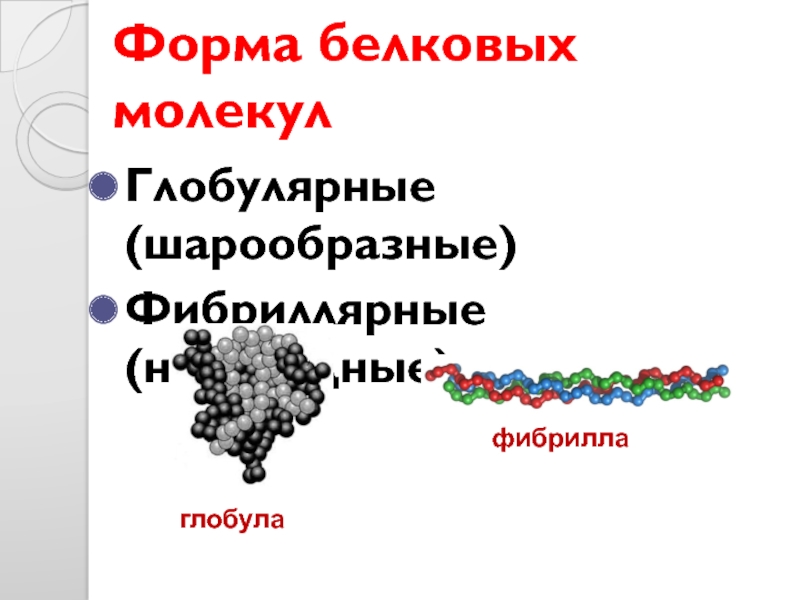
- 31. Форма белковых молекул Глобулярные (шарообразные) Фибриллярные (нитевидные) глобула фибрилла
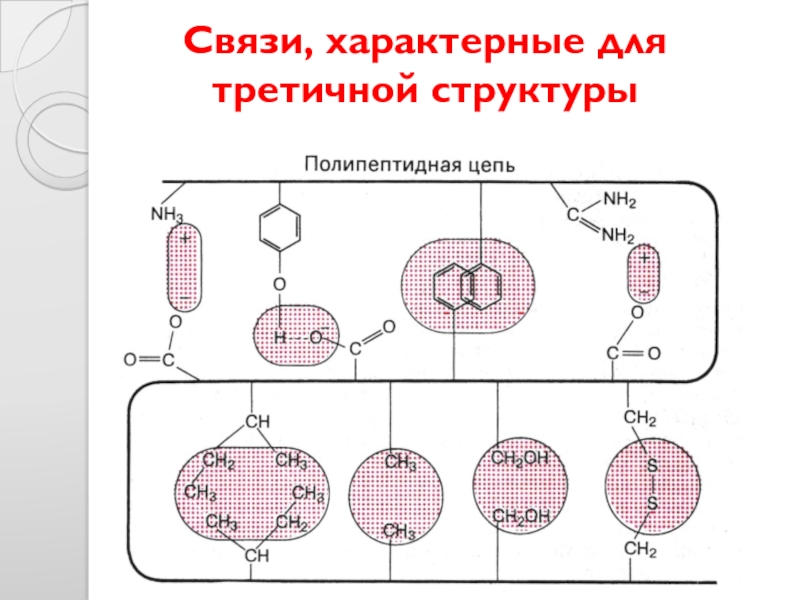
- 32. Связи, характерные для третичной структуры
- 33. Доменное строение глобулярных белков Домен – часть
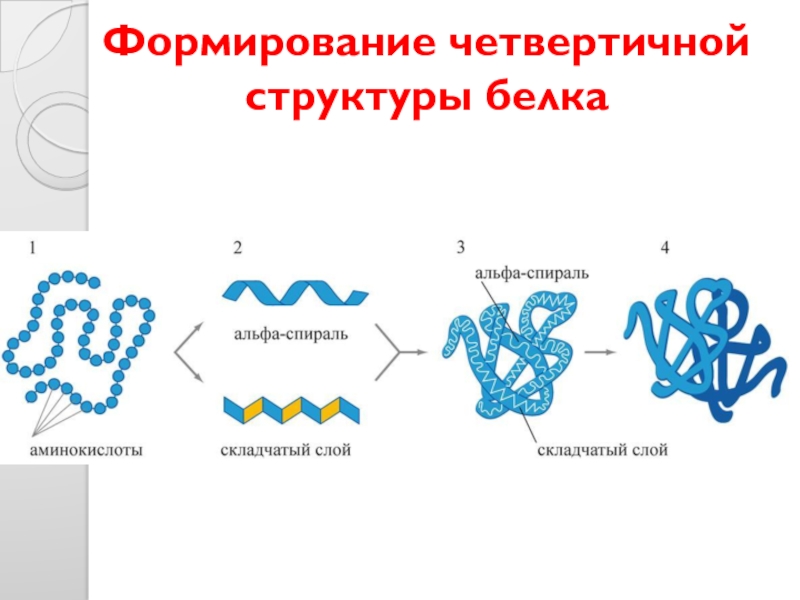
- 34. Формирование четвертичной структуры белка
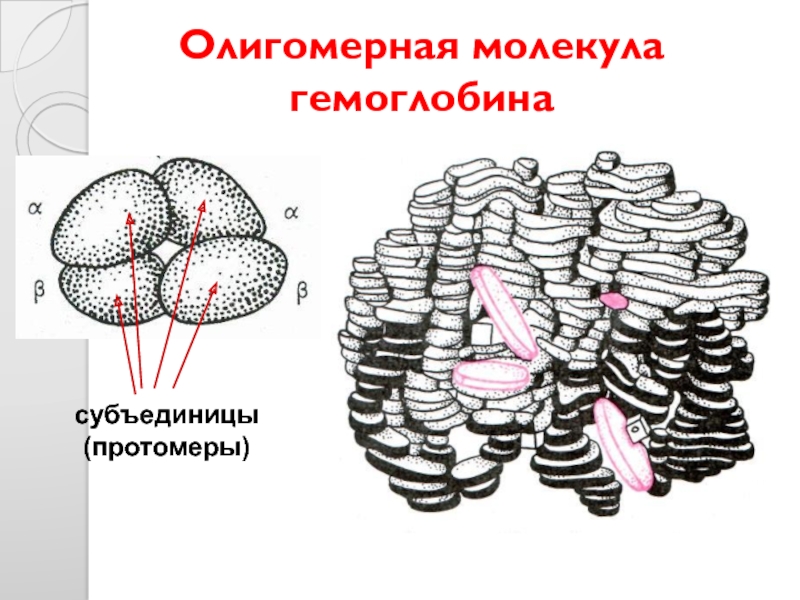
- 35. Олигомерная молекула гемоглобина субъединицы (протомеры)
- 36. Важнейшие свойства белков: Способность к специфическим взаимодействиям
- 37. Образование белково-лигандного комплекса Происходит только в определённом
- 38. активный центр
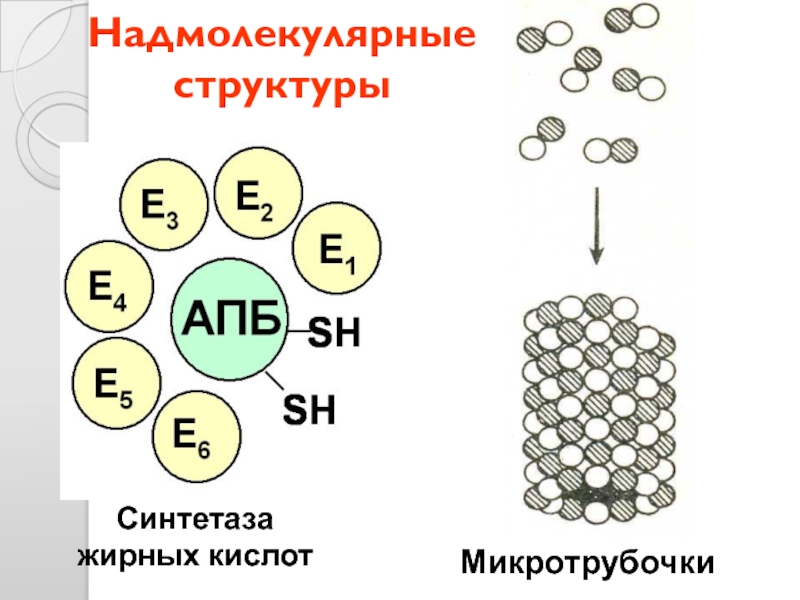
- 39. Надмолекулярные структуры Синтетаза жирных кислот Микротрубочки
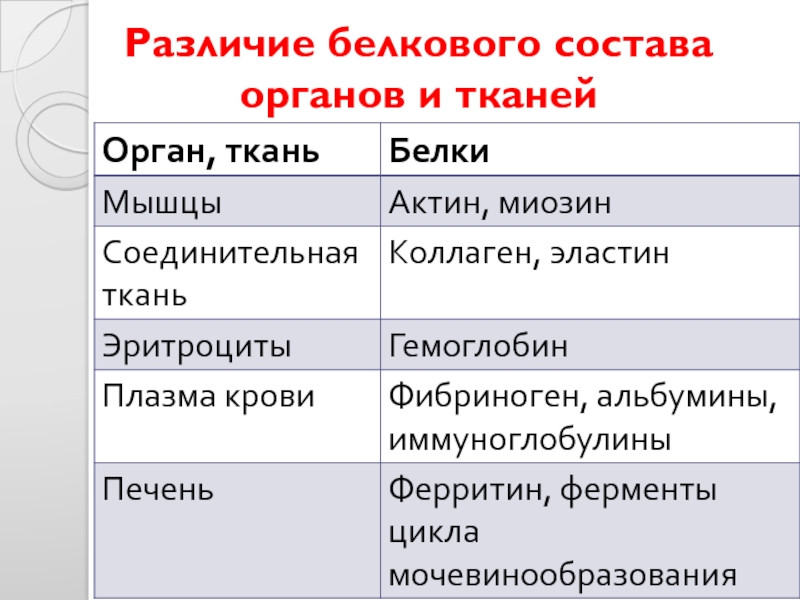
- 40. Различие белкового состава органов и тканей
- 41. Типы классификации белков По форме молекулы. По
- 42. Классификация по функциям Каталитические (ферменты) Регуляторные
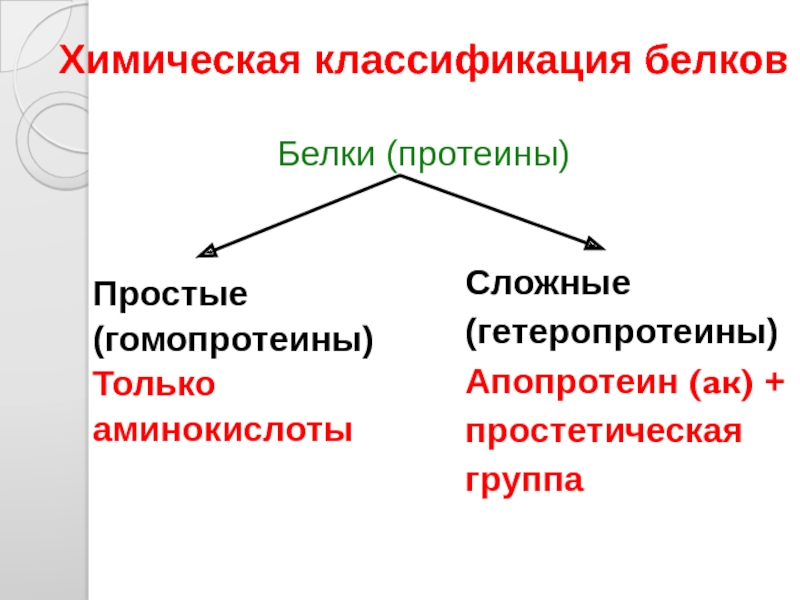
- 43. Химическая классификация белков п Белки (протеины)
- 44. Сложные: Нуклеопротеины; Хромопротеины; Гликопротеины; Фосфопротеины; Липопротеины; Металлопротеины
- 45. Классификация белков
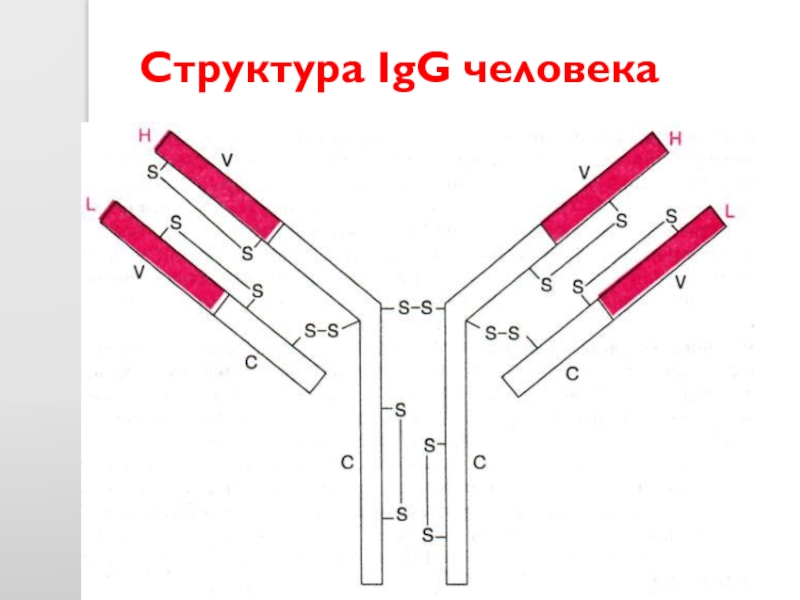
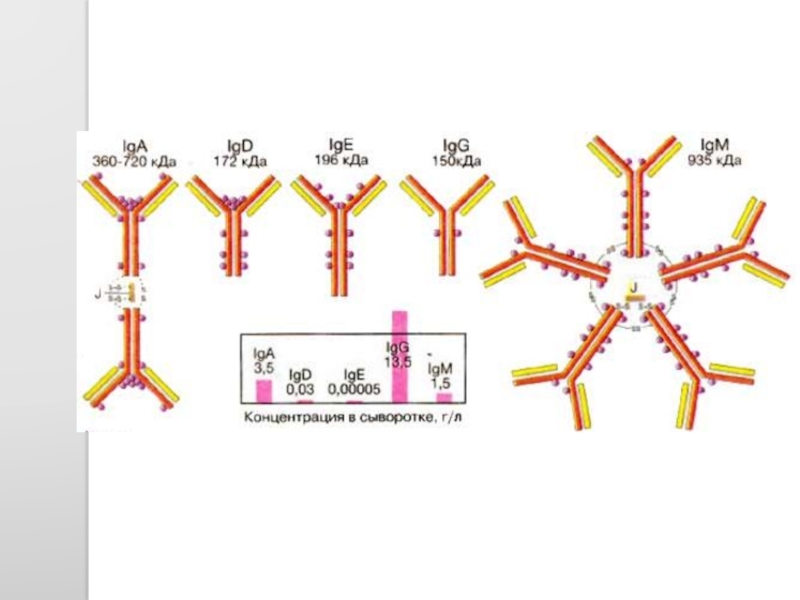
- 46. Структура IgG человека
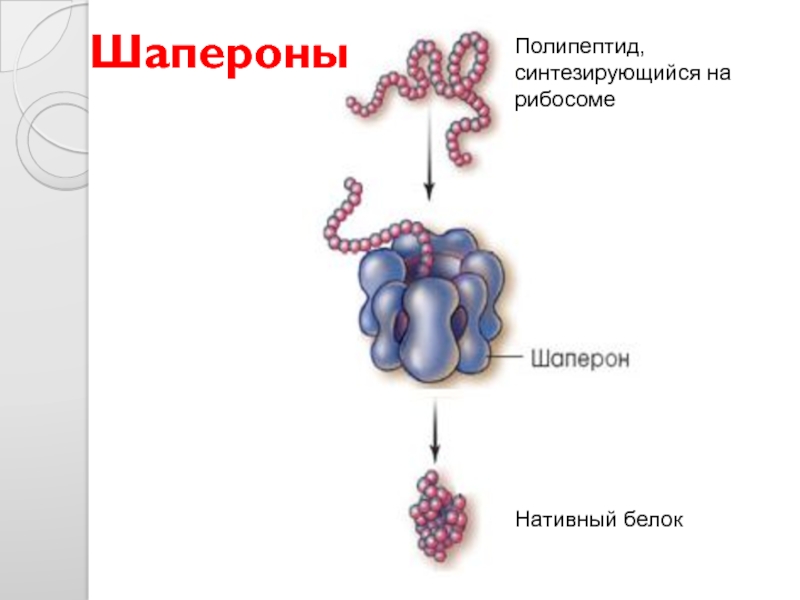
- 48. Шапероны Полипептид, синтезирующийся на рибосоме Нативный белок
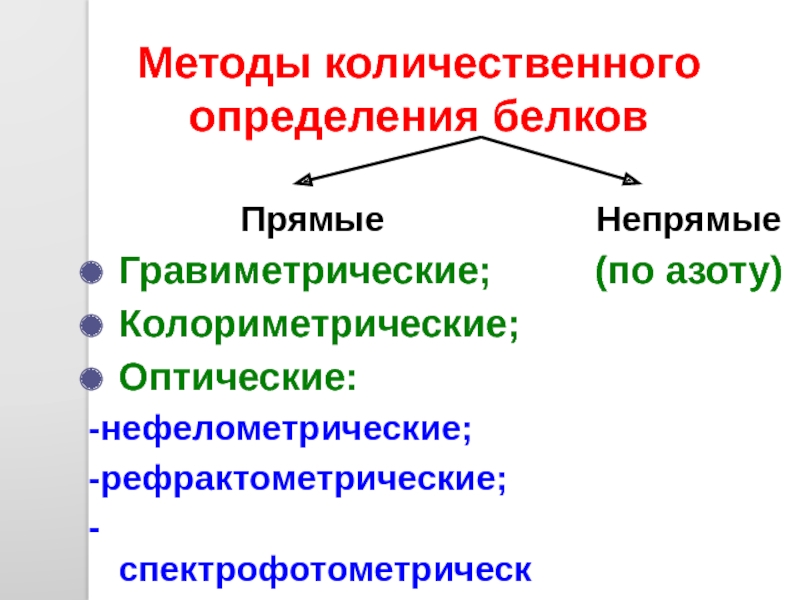
- 49. Методы количественного определения белков Непрямые (по азоту) Прямые Гравиметрические; Колориметрические; Оптические: -нефелометрические; -рефрактометрические; -спектрофотометрические
- 50. Методы выделения и очистки белков Гомогенизация; Экстракция; Высаливание; Диализ; Хроматография; Электрофорез.
Слайд 1КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по биохимии
Тема:
ВВЕДЕНИЕ в
Строение и функции белков
КРАСНОДАР
2015
Слайд 2БИОХИМИЯ –
наука, изучающая химический состав живых организмов, химические процессы, которые
Слайд 3ГЛАВНАЯ ЗАДАЧА БИОХИМИИ –
ПОЗНАНИЕ ХИМИЧЕСКИХ ОСНОВ ЖИЗНИ, УСЛОВИЙ И МЕХАНИЗМОВ
Слайд 4Метаболизм –
совокупность химических превращений веществ от момента поступления их
Слайд 5 Метаболизм
Катаболизм –
совокупность поэтапных ферментативных процессов расщепления
Идет с высвобождением энергии – экзэргонический процесс
Анаболизм –
совокупность поэтапных ферментативных процессов построения сложных веществ из более простых предшественников.
Идет с затратой энергии, эндэргонический процесс
Слайд 6БЕЛКИ (протеины) –
ВЫСОКОМОЛЕКУЛЯРНЫЕ АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, МАЛО ОТЛИЧАЮЩИЕСЯ
Слайд 7Функции белков
Каталитические (ферменты)
Регуляторные (гормоны)
Рецепторая (мембранные, цитозольные и др.
Транспортные (Нb, трансферрин)
Защитные (Ig, шапероны)
Сократительные (актин, миозин)
Структурные (коллаген, эластин)
Питательные (казеин, овальбумин)
Слайд 9БЕЛКИ –
биополимеры, структурными единицами которых (мономерами) являются
Слайд 12Классификация производных аминокислот
2-10 аминокислотных остатков – пептид,
10-100 ─" ─
> 100 ─" ─ белок
Молекулярная масса белков
от 10000 Да до нескольких миллионов Да
Слайд 14Первичная структура определяет:
Физико-химические свойства (размер, массу, растворимость, заряд и т.д.)
Все последующие
Биологическую активность белка
Видовую и тканевую специфичность белка
Слайд 15Закономерности первичной стуктуры
1. Чем важнее роль белка в процессах
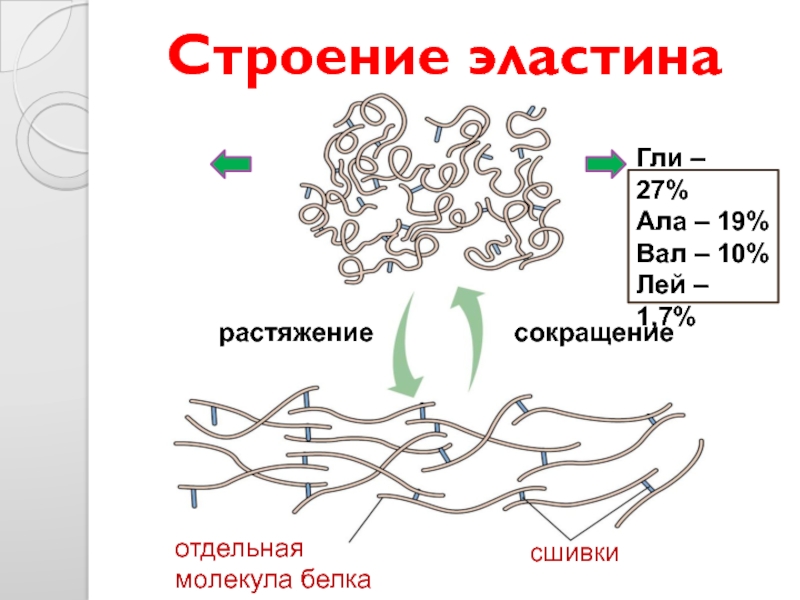
Слайд 18растяжение сокращение
отдельная молекула белка
сшивки
Строение эластина
Гли – 27%
Ала – 19%
Вал – 10%
Лей – 1,7%
Слайд 19Закономерности первичной стуктуры
2. Чем важнее роль белка в процессах
Слайд 20Закономерности первичной стуктуры
3. Чем ближе расположены виды на эволюционной лестнице,
Слайд 23Методы изучения I структуры белка
Методы «меток» – определение концевых аминокислот
Гидролиз
Хроматография
Секвенирование
Слайд 24Методы изучения I структуры белка
гидролиз
по характеру катализатора
кислотный
щелочной
нейтральный
по глубине
полный
неполный
по условиям
мягкий (ферменты, t≈36ºC, нормальное давление)
жёсткий (высокая температура, кислоты, щёлочи)
Слайд 25представляет собой способ укладки I структуры в виде:
удерживается водородными связями
Вторичная структура белка
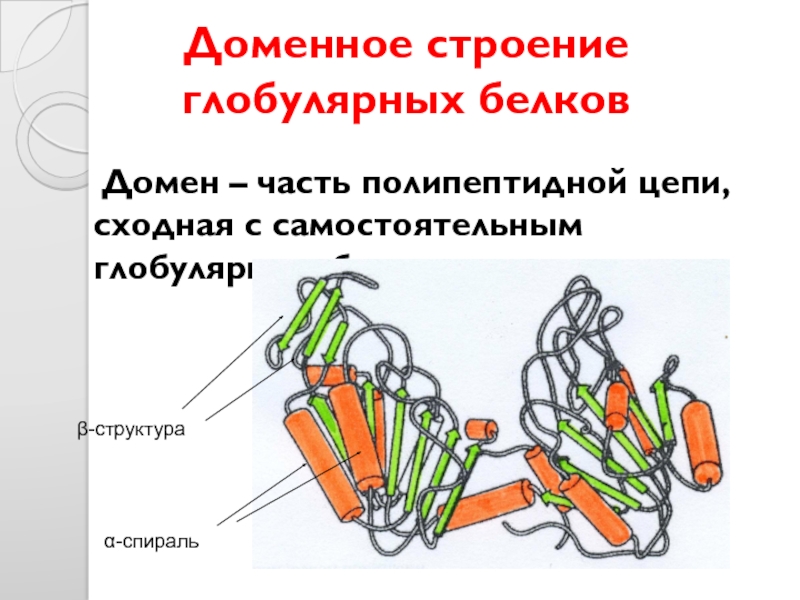
Слайд 33Доменное строение глобулярных белков
Домен – часть полипептидной цепи, сходная с самостоятельным
α-спираль
β-структура
Слайд 36Важнейшие свойства белков:
Способность к специфическим взаимодействиям (образование белково-лигандных комплексов)
Способность к самосборке
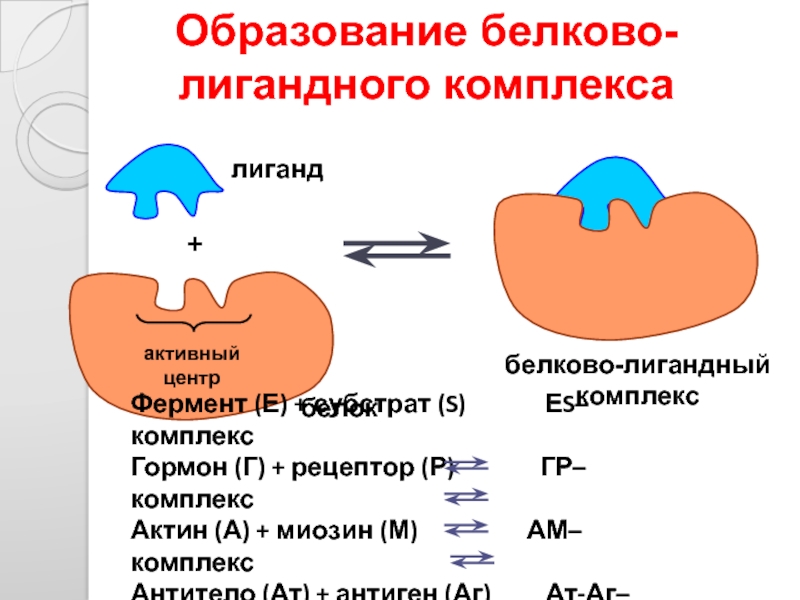
Слайд 37Образование белково-лигандного комплекса
Происходит только в определённом месте белка, который называется центр
Взаимодействие высокоизбирательно
Быстрое насыщение
Взаимодействие обратимо
Слайд 38
активный центр
лиганд
белок
белково-лигандный комплекс
+
Образование белково-лигандного комплекса
Фермент (Е) + субстрат (S)
Гормон (Г) + рецептор (Р) ГР–комплекс
Актин (А) + миозин (М) АМ–комплекс
Антитело (Ат) + антиген (Аг) Ат-Аг–комплекс
Слайд 41Типы классификации белков
По форме молекулы.
По физико-химическим свойствам.
По происхождению.
По биологической ценности.
По функциям.
По
Слайд 42Классификация по функциям
Каталитические (ферменты)
Регуляторные (гормоны)
Транспортные (Нb,
Защитные (Ig, шапероны)
Сократительные (актин, миозин)
Структурные (коллаген, эластин)
Питательные (казеин, овальбумин)








 100 ─" ─" alt="">
100 ─" ─" alt="">