- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Цитология старения. Окислительная теория старения презентация
Содержание
- 1. Цитология старения. Окислительная теория старения
- 2. Aging is defined when two criteria are
- 3. Impressive progress have been done in the
- 4. Теории и гипотезы старения, альтернативные теломерной 1.
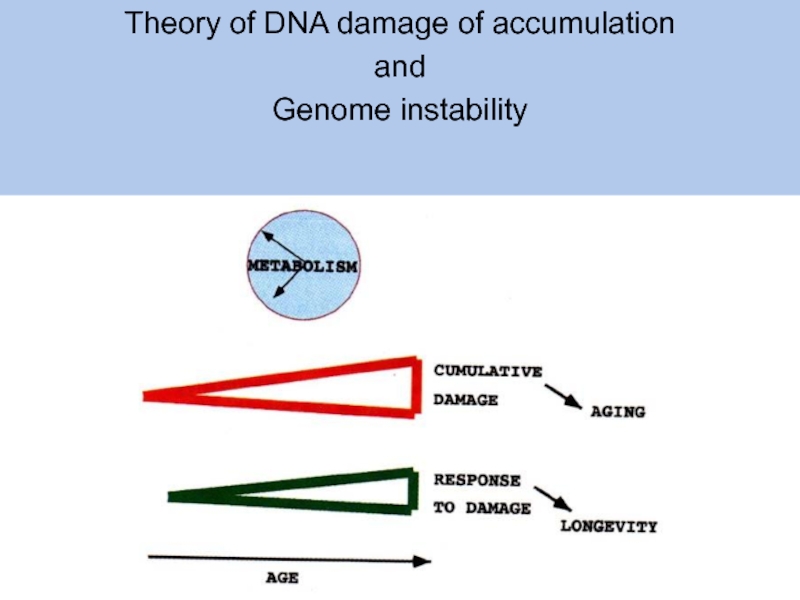
- 5. Theory of DNA damage of accumulation and Genome instability
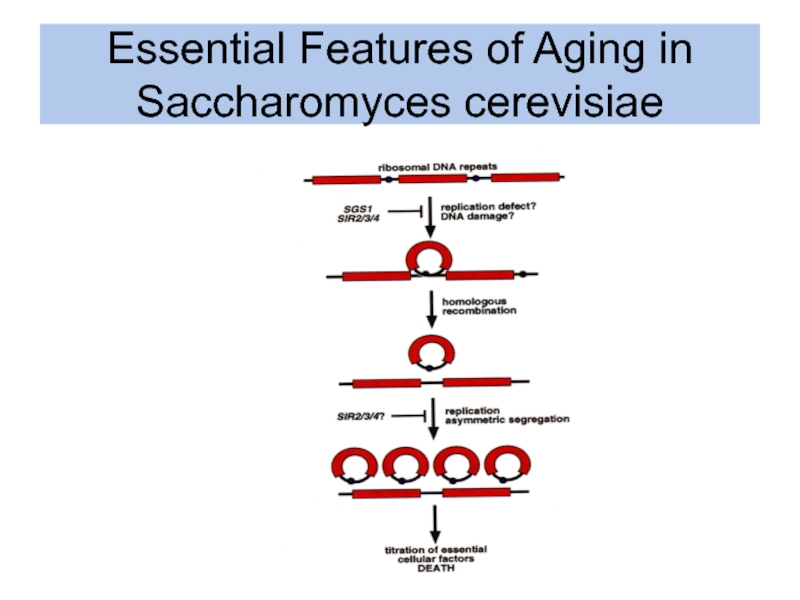
- 6. Essential Features of Aging in Saccharomyces cerevisiae
- 7. Дэнхем Харман Denham Harman (February 14, 1916 November
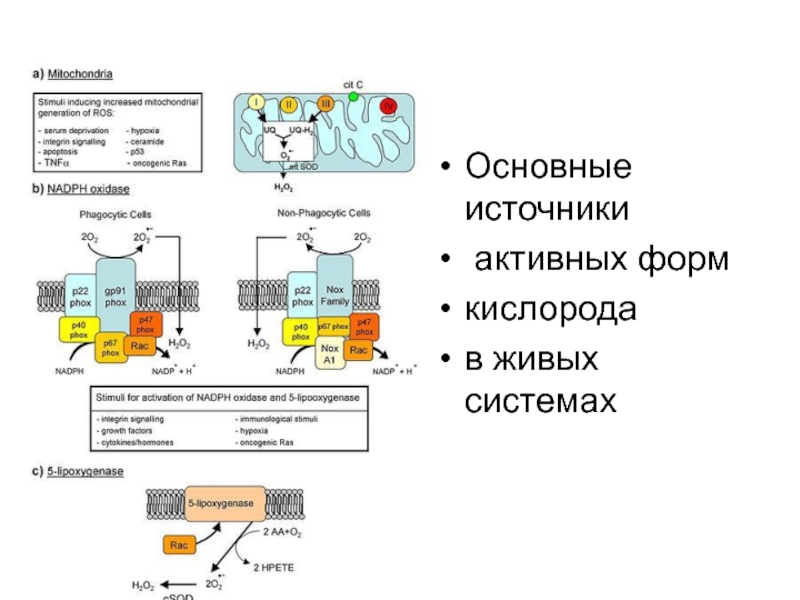
- 8. Основные источники активных форм кислорода в живых системах
- 9. Free radical theory or the theory of
- 10. Дыхательная цепь митохондрий Комплекс I (НАДН дегидрогеназаКомплекс
- 11. Слабость окислительной теории старения Согласно окислительной теории,
- 12. Вне всякого сомнения, АФК способны ускорять старение
- 13. Сближение окислительной и теломерной теорий старения В
- 15. Можно ли замедлить старение? С помощью антиоксидантов,
- 16. Нестареющие организмы Существует мнение, что некоторые виды
- 17. Голый землекоп (лат. Heterocephalus glaber) — небольшой роющий грызун) — небольшой роющий грызун семейства землекоповых) —
- 18. Голый землекоп — одно из млекопитающих, обладающих
- 19. Во главе колонии находится единственная самка-производительница (матка,
- 21. Гиалуроновая кислота У голых землекопов даже
- 22. TianTian, AzpuruaTian, Azpurua, HineTian, Azpurua, Hine, VaidyaTian,
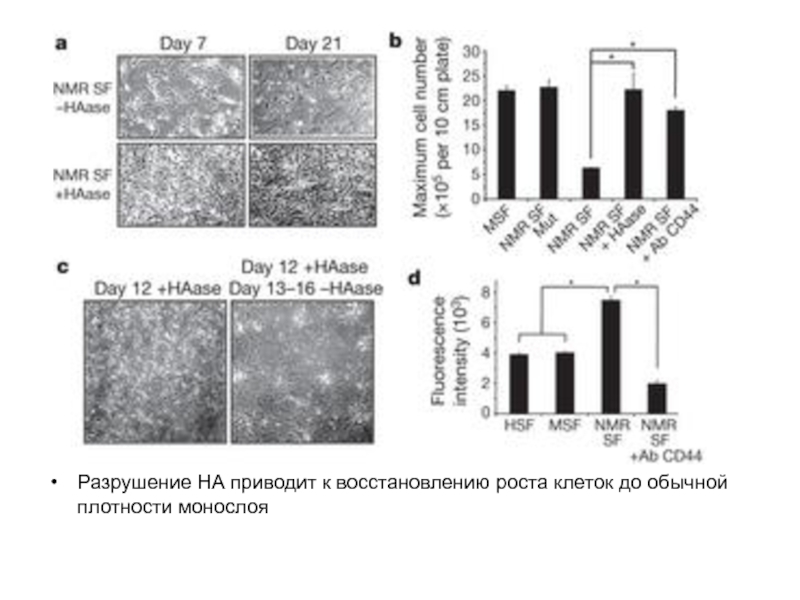
- 23. Разрушение НА приводит к восстановлению роста клеток до обычной плотности монослоя
- 24. Чтобы подтвердить причастность сахаров к устойчивости голых
- 25. Снижение калорийности питания и его экспериментальные модели
- 26. Карликовые мыши Эймса Одной из интересных моделей
- 27. Мыши, гомозиготные по мутации "little" (lit/lit), имеют
- 28. Р66shc Предполагается, что p66shc вовлечен в феноптоз,
- 29. Рапамицин и метформин Ингибирование TOR–сигналинга генетическим или
- 30. Программируемая клеточная смерть
- 31. Caenorhabditis elegans Biochemical model for the
- 32. Пути апоптоза Apoptotic pathways are genetically very
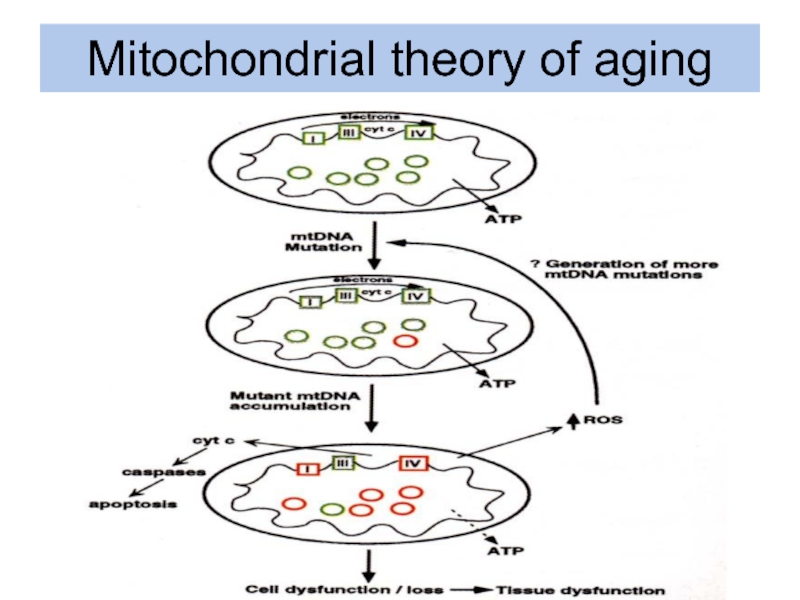
- 33. Mitochondrial theory of aging
- 34. В.П.Скулачев
- 35. Работы В.П.Скулачёва SkQ1 – это эффективный антиоксидант.
- 36. Концепция Михаила Батина Фонд «Наука против
- 37. 2.В природе существуют животные с пренебрежимым старением.
- 38. 3. Учёным удалось обратить назад развитие клетки
- 39. 5. Аргументация против продления жизни сводится
- 40. Итак, продлить жизнь сверх положенного человеку лимита
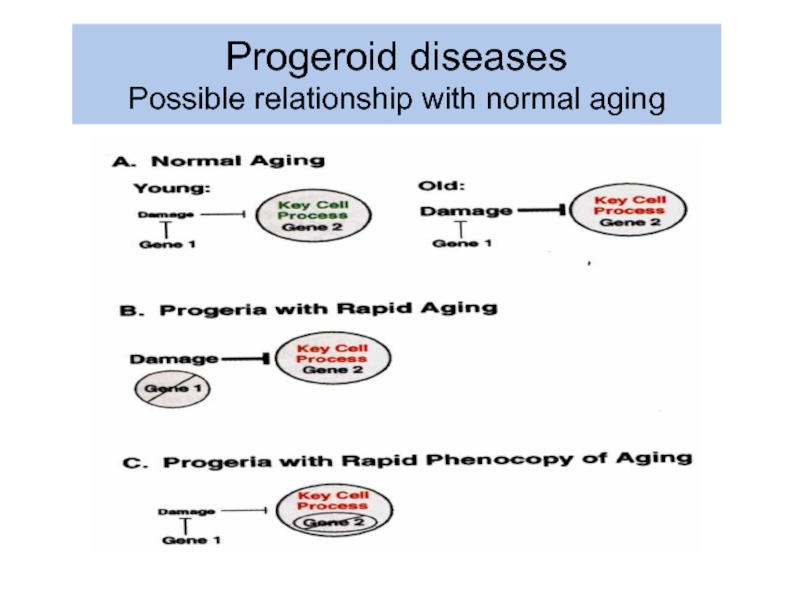
- 42. Progeroid diseases Possible relationship with normal aging
Слайд 2Aging is defined when two criteria are met.
First, the probability
Second, characteristic changes in phenotype occur in all individuals over time due to the limiting processes.
Слайд 3Impressive progress have been done in the framework of two main
and
stochastic aging.
Слайд 4Теории и гипотезы старения,
альтернативные теломерной
1. Окислительная теория (Дэнхем Харман, 1956)
2. Репарационные
Слайд 7Дэнхем Харман
Denham Harman (February 14, 1916 November 25, 2014)
B 1954 году
Слайд 9Free radical theory or the theory of reactive oxygen species (ROS)
(Harman 1981)
ROS:
superoxide anion
hydrogen peroxide
hydroxyl radical
ROS have been shown to cause molecular damage relatively indiscriminately to proteins, lipids, and nucleic acids.
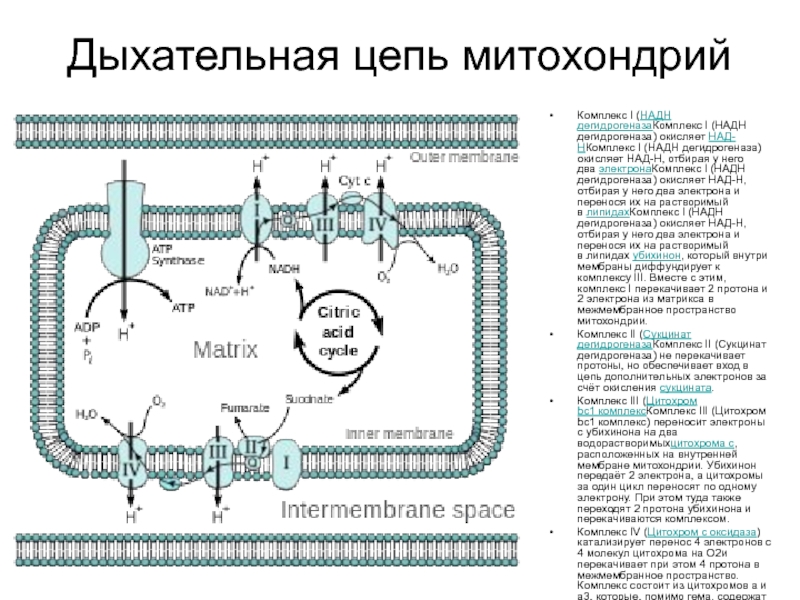
Слайд 10Дыхательная цепь митохондрий
Комплекс I (НАДН дегидрогеназаКомплекс I (НАДН дегидрогеназа) окисляет НАД-НКомплекс I
Комплекс II (Сукцинат дегидрогеназаКомплекс II (Сукцинат дегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (Цитохром bc1 комплексКомплекс III (Цитохром bc1 комплекс) переносит электроны с убихинона на два водорастворимыхцитохрома с, расположенных на внутренней мембране митохондрии. Убихинон передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в геме цитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и два протона и превращается в молекулу воды.
Слайд 11Слабость окислительной теории старения
Согласно окислительной теории, старение происходит в результате накопления
Нет сомнения в том, что окислительные повреждения ускоряют старение, однако окислительная теория старения сама по себе не в состоянии ответить на следующие вопросы:
1. Почему окислительные повреждения, вызываемые активными формами кислорода, не накапливаются в ходе созревания гамет, а если накапливаются, то куда они исчезают при образовании зиготы?
2. Почему окислительные повреждения не накапливаются в трансформированных клетках, а если накапливаются, то почему не препятствуют пролиферации этих клеток? Тем более, что в трансформированных клетках образуется не меньше, а больше активных форм кислорода, чем в норме.
На эти вопросы отвечает наличие теломеразы в этих клетках.
Слайд 12Вне всякого сомнения, АФК способны ускорять старение как in vitro,так и
Слайд 13Сближение окислительной и теломерной теорий старения
В последние годы появились доказательства того,
Это, однако, не совсем так:
Даже самые мощные антиоксиданты (SkQ В.П.Скулачева) не в состоянии остановить старение, а могут лишь несколько замедлить его, и что существенно – именно и исключительно за счет замедления укорочения теломер (Von Zglinicki et al, 2009) , причем не только в делящихся клетках, при репликации, но и в неделящихся.
Если бы совсем не было окислительных повреждений, теломеры все равно укорачивались бы при каждом митозе, ибо так устроен механизм репликации ДНК (Оловников, 1971), и старение, пусть медленнее, все равно прогрессировало бы, что мы и наблюдаем при действии любых антиоксидантов. А вот если теломеры не укорачиваются, что имеет место в трансформированных клетках, т.к. там экспрессируется ТЕРТ, старение действительно останавливается, несмотря на повреждающее действие активных форм кислорода, даже более интенсивное, чем в здоровых клетках.
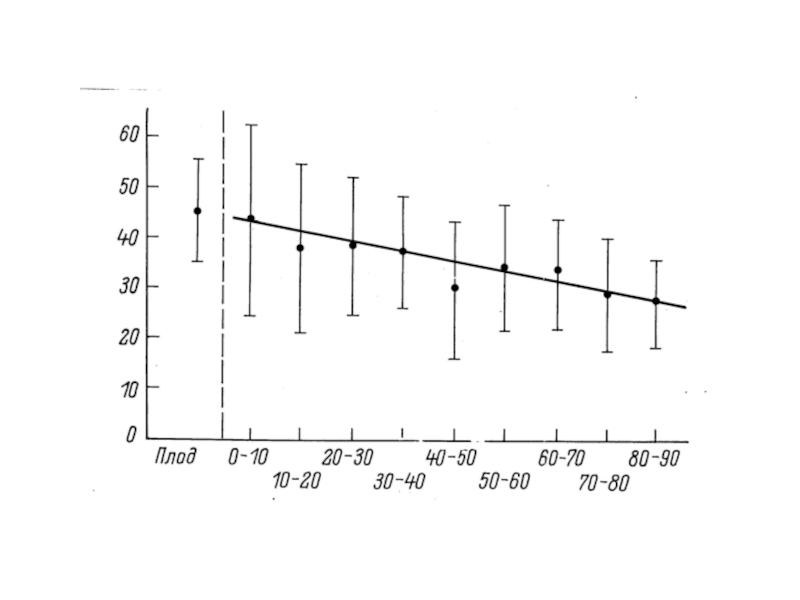
Т.о., правильно будет считать, что укорочение теломер – единственный механизм старения, а кислородные повреждения могут старение ускорять, дополнительно укорачивая теломеры, наряду с рядом других факторов – ионизирующей радиацией, ошибками репарации, эпигенетическими явлениями и даже психологическим стрессом. Но это – не механизмы старения. (Пример Наполеона).
Соответственно, активные формы кислорода могут ускорять старение, но только в пределах той доли старения, которая вызвана окислительными повреждениями именно теломер.
Слайд 14 О принципиальной невозможности существенного увеличения видовой продолжительности жизни человека Старение - побочный,
Слайд 15Можно ли замедлить старение?
С помощью антиоксидантов, или иными способами можно в
Слайд 16Нестареющие организмы
Существует мнение, что некоторые виды животных не стареют – именно
В последние годы обнаружено, что во всех клетках этих животных на протяжении всей жизни экспрессируется ТЕRТ. В результате они, хотя и стареют (со временем экспрессия ТЕRТ ослабевает), но очень медленно.
Очень велико своеобразие механизмов старения у насекомых и у некоторых примитивных водных организмов – гидр, морских звезд и т.п.
Единственный действительно нестареющий организм – это амеба. Амебы могут безгранично размножаться как в культуре, так и в природе, если для этого есть соответствующие условия. Но что особенно интересно – амебы являются также единственной группой организмов, не имеющих полового размножения. Они размножаются только вегетативно – простым делением.
Это исключение – сочетание отсутствия старения с отсутствием полового размножения - открывает важнейшую, на мой взгляд, закономерность бытия:
Природа дала живым существам возможность бессмертия, но не индивидуального (для человека – не личного), а в поколениях.
Слайд 17Голый землекоп (лат. Heterocephalus glaber) — небольшой роющий грызун) — небольшой роющий грызун семейства землекоповых) — небольшой роющий грызун семейства землекоповых. Вид отличается
Слайд 18Голый землекоп — одно из млекопитающих, обладающих активно работающей теломеразой. У
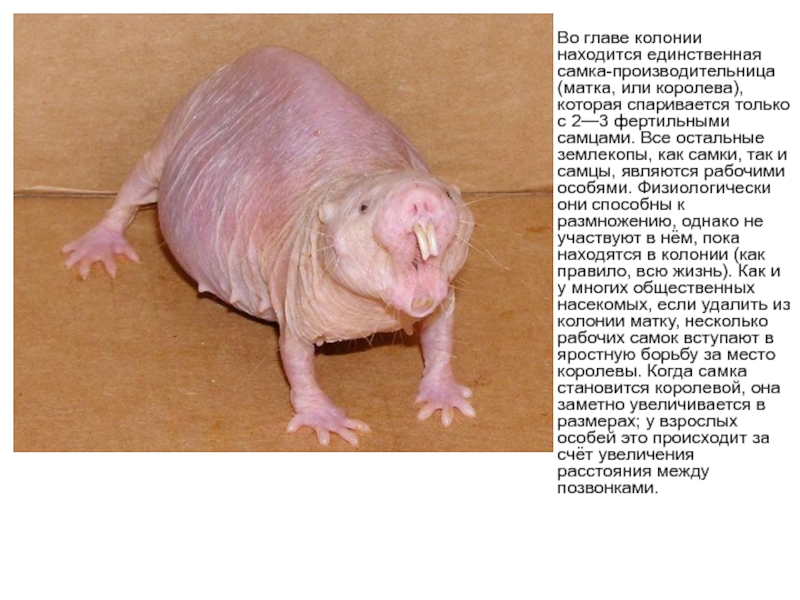
Слайд 19Во главе колонии находится единственная самка-производительница (матка, или королева), которая спаривается
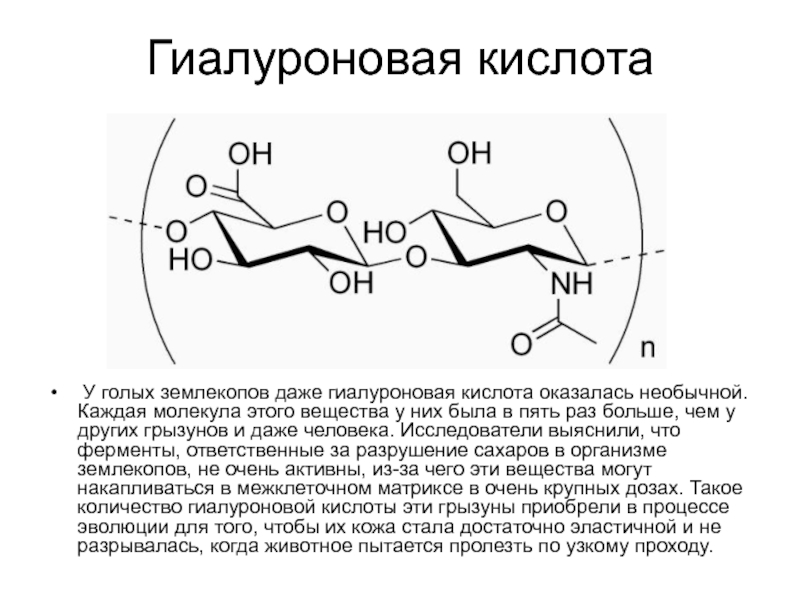
Слайд 21Гиалуроновая кислота
У голых землекопов даже гиалуроновая кислота оказалась необычной. Каждая
Слайд 22TianTian, AzpuruaTian, Azpurua, HineTian, Azpurua, Hine, VaidyaTian, Azpurua, Hine, Vaidya, Myakishev-RempelTian,
Доказательство 5-10 кратного превышения размеров НА у голого землекопа
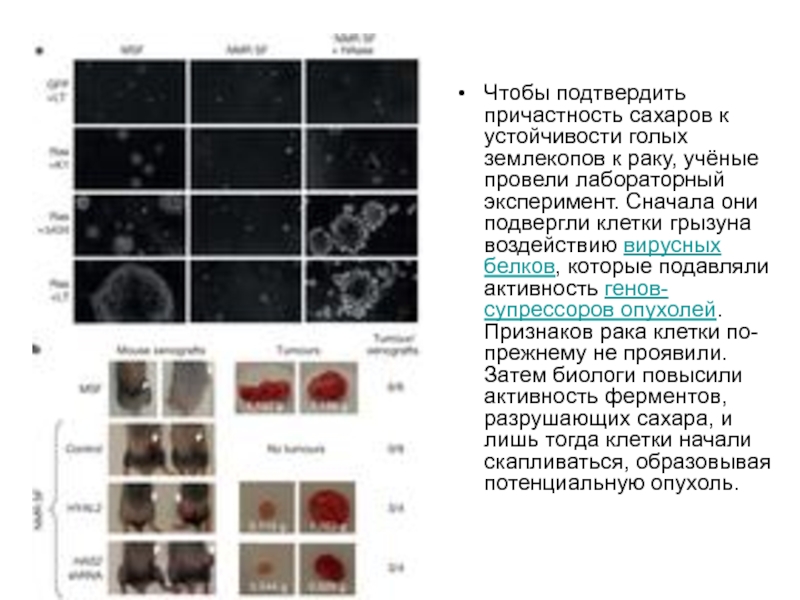
Слайд 24Чтобы подтвердить причастность сахаров к устойчивости голых землекопов к раку, учёные
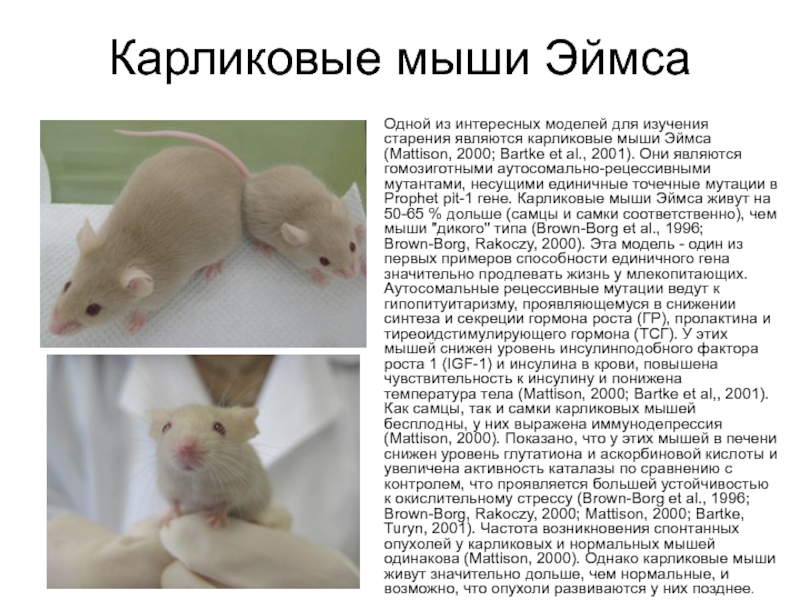
Слайд 26Карликовые мыши Эймса
Одной из интересных моделей для изучения старения являются карликовые
Слайд 27Мыши, гомозиготные по мутации "little" (lit/lit), имеют изолированный дефицит гормона роста,
выключением гена рецептора IGF-1 у мышей. Гомозиготы (Igf1-/-) умирали при рождении. Однако у самок гетерозиготных мышей с частично нокаутированным геном рецептора IGF-1 (Igf1r+/-) наблюдали увеличение средней продолжительности жизни на 33 % по сравнению с самками дикого типа (р<0.001), тогда как у самцов - лишь на 16%. У этих мышей не наблюдалось карликовости; основной обмен, температура тела, потребление корма, физическая активность и фертильность у них не отличались от контроля. Также не отличалась от контроля и частота развития спонтанных опухолей. В то же время Igf1r+/- мыши отличались большей устойчивостью к оксидативному стрессу, чем контроль дикого типа (Igf1r+/+) (Holzenberger et al., 2003).
Слайд 28Р66shc
Предполагается, что p66shc вовлечен в феноптоз, то есть запрограммированную гибель организма,
Направленная мутация гена p66shc у мышей привела к развитию устойчивости к вызванному паракватом окислительному стрессу, индуцирующему продукцию анионов супероксида, и увеличению продолжительности жизни животных на 30% (Migliaccio et al,, 1999). У p66shc-/- мышей выявлено снижение системного и тканевого окислительного стресса, атерогенеза и апоптоза в эндотелии аорты (Napoli et al., 2003).
Слайд 29Рапамицин и метформин
Ингибирование TOR–сигналинга генетическим или фармакологическим вмешательством удлиняет продолжительность жизни
что рапамицин, ингибитор mTOR, удлиняет среднюю и максимальную продолжительность жизни как у мужских, так и женских особей мышей при начале кормления на 600 день жизни. Рапамицин привел к увеличению продолжительности жизни на 14% для женских особей и на 9% для мужских. Эффект наблюдался в трех независимых экспериментах в разных лабораториях (Дэвид Харрисон, Лаборатория Джексона, Рэнди Стронг, Университет Техаса, Ричард Миллер, Университет Мичигана).
В независимом анализе рапамицин, скармливаемый мышам, начиная с 270 дня жизни, также увеличил выживаемость как мужских, так и женских особей. Такие результаты дал промежуточный анализ, проведенный в средней точке выживаемости. Рапамицин может продлить жизнь путем отсрочки смерти от рака, замедления механизмов старения,
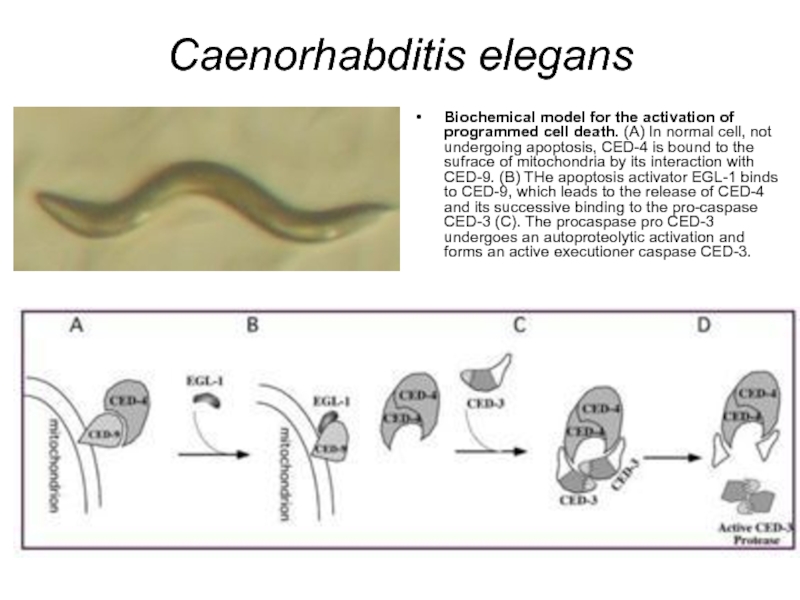
Слайд 31Caenorhabditis elegans
Biochemical model for the activation of programmed cell death. (A) In
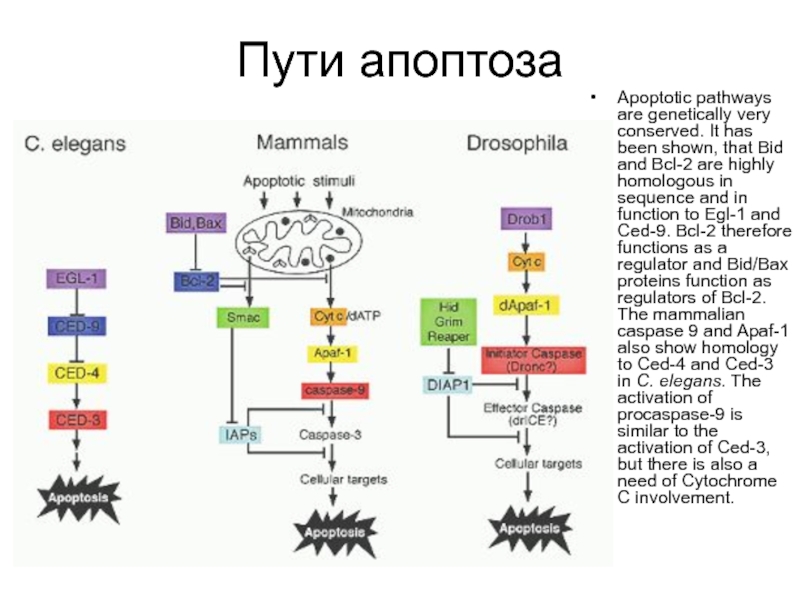
Слайд 32Пути апоптоза
Apoptotic pathways are genetically very conserved. It has been shown,
Слайд 35Работы В.П.Скулачёва
SkQ1 – это эффективный антиоксидант. Его задача – даление из
Результаты показали, что SkQ1способен тормозить апоптоз клеток HeLa и фибробластов человека, вызванный Н2О2, увеличивать медианную продолжительность жизни у грибов Podospora anserina, рачков Ceriodaphnia affinis, дрозофил, а у мышей – до двух раз.
На мышах и крысах было показано, что SkQ1 замедляет развитие таких признаков старения, как инволюция тимуса и фолликулярных клеток селезенки, уменьшение соотношения лимфоцитов и нейтрофилов в крови, остеопороз, катаракта, ретинопатия, глаукома, облысение, поседение, исчезновение эстральных циклов у самок и полового влечения у самцов, гипотермия и т. д.
Исследователи пришли к выводу, что этот антитиоксидант снижает смертность на ранних и средних этапах старения и предотвращает появление большой группы старческих дефектов
Слайд 36Концепция Михаила Батина
Фонд «Наука против старения»
1. Многим подопытным животным удалось
Слайд 372.В природе существуют животные с пренебрежимым старением. У таких организмов смертность с
Слайд 383. Учёным удалось обратить назад развитие клетки человеческого организма, увеличив потенциал
4. Несмотря на достижения в области продления жизни, внимание общества, финансирование исследований находятся на крайне низком уровне. То есть, даже при таком положении вещей наука добивается выдающихся результатов. Очевидно, что они будут гораздо выше, если этой области будет уделяться больше внимания, не говоря уже о том – если она станет приоритетной для государств и общества.
Слайд 39 5. Аргументация против продления жизни сводится в основном к нецелесообразности увеличения
Слайд 40Итак, продлить жизнь сверх положенного человеку лимита скорее всего невозможно, да
У природы нет плохой погоды,
Ход времен нельзя остановить.
Осень жизни, как и осень года,
Надо, не скорбя, благословить.
Эльдар Рязанов
«Служебный роман»