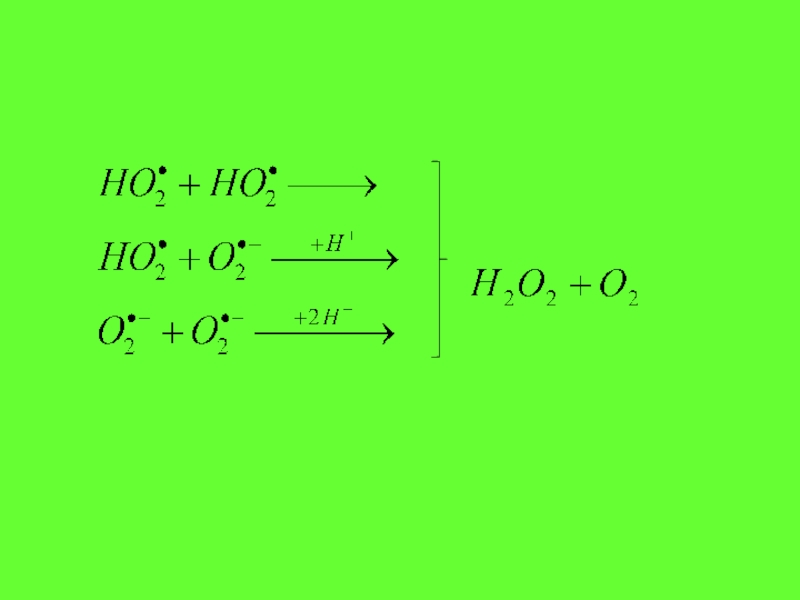- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тотығу стрестің өсімдіктерге әсері презентация
Содержание
- 1. Тотығу стрестің өсімдіктерге әсері
- 2. Оттектің активті формалары
- 3. Оттек барлық тірі ағзалардың құрамына кіреді.
- 4. Органикалық молекулалар Спиндері
- 5. Классификация электронных состояний молекулы основывается на ряде
- 7. Спектры испускания. Многоатомные молекулы в конденсир. фазе
- 8. Молекулалық оттек негізгі күйінде триплет болып келеді.
- 9. Оттектің молекуласының суға дейін тыныс алу
- 10. Ұлпаларда ОАФ аз мөлшерде болады.
- 11. ОАФ-РЫ БИОМОЛЕКУЛАЛАРДЫ ЗАҚЫМДАНУДА Молекулалық оттек өз
- 12. ·
- 13. Тiршiлiк әрекетiнiң өнiмдерiне жатпайды Атомарлық оттек О
- 14. Оттектің аткивті формалары (ОАФ) – қысқа өмір
- 15. ОАФ түзілунің бірнеше жолдары бар.Олар аэробты метаболизмде
- 18. Бос радикал сыртқы орбитальда
- 19. Супероксидті анион радикал О2-
- 20. Супероксид анион-радикал және басқа ОАФ клетканың әр
- 21. Cупероксидті анион-радикалдың түзілуі құрамында флавин бар ксантиноксидаза,
- 22. Митохондрии являются главным источником создания супероксидных анионов
- 23. Бос радикалда сыртқы орбитальда. қосылмаған электрон болады
- 24. Молекулалық оттектен басқа, олар мембраналардан жақсы өтеді,
- 25. АФК-ның генерациясында молекулалық оттектің күн сәуесінің әсерінен
- 26. Н2O2 Ол орташа тотықтырғыш болып саналады.
- 27. Cупероксид анион-радикалдың түзілуі құрамында флавин бар ксантиноксидаза,
- 28. хинон семихинон
- 30. Бірақ ең көп супероксидтер митохондриядағы және
- 31. - Клеткалық қабығында оттектің радикалдары пайда болады.
- 32. Оттектің басқа радикалдарынан және синглетті
- 33. Бір электрон және екі протондар супероксид радикалға
- 35. Осы ОАФның өмір сүру ұзақтығы 1
- 36. Хлоропластта сутектің асқын тотығы фото тыныс алуда
- 37. Сутектің асқын тотығы супероксидтің хлоропласттағы
- 38. Фентон реакциясы: Сутектің асқын
- 39. ГИДРОКСИЛ РАДИКАЛ ОН. Келесі бір электрондық
- 40. Гидроксил радикал клетканың ішінде миграция жасалмайды, себебі
- 41. Гидроксил радикал клетканың ішінде миграция жасамайды, себебі
- 42. Озон жапырақтың клеткалық плазмалеммасымен байланысады, леп тесіктердің
- 43. Озон Плазмалемма клеток листьев Нарушение регуляции
- 44. ROOH-тың түзілуін асқын тотығу деп атайды
- 45. Взаимодействуя с органическими веществами, АФК. главным образом
- 46. Реакция LООН с Fе2+ ведет к разветвлению
- 47. В липидах (L), в основном в полиненасыщенных
- 49. Синглетті оттек 1О2 Оның
- 50. Синглетті оттек (1О2), фотототығуда пайда болады фотосенсибилизаторлар
- 51. Осы процестің ең басты қорғаныс механизмі бета-каротин,
- 52. Молекулы пигмента в виде синглета или триплета.
- 53. ОАФ биологиялық маңызы Қалыпты жағдайда ОАФ және
- 54. Тотығу стресс нуклеин қышқылдарды, белоктарды, липидтерді зақымдайды.
- 55. ОАФ мутагендік әсер етеді.
- 56. Окислительные модификации белков, вызванные АФК, включают не
- 58. Образование АФК — наиболее ранний ответ растения-хозяина,
- 59. Накопление в клетке вторичных посредников — циклонуклеотидов:
- 60. МЕХАНИЗМЫ ЗАЩИТЫ
- 61. Концентрация кислорода. обеспечивающая половину максимальной скорости ферментативного
- 63. В области В цитохромоксидаза насыщена кислородом, но
- 64. Известно несколько способов снижения уровня кислорода в
- 65. Утечка ионов водорода. Г. Биверс и
- 66. Открывание пор в мембране митохондрий. Если
- 67. Образование активных форм кислорода (АФК, ROS) являющихся
Слайд 2
Оттектің активті формалары
Стресс жағдайда оттектің активті формалары түзіледі.
ОАФ-ға оттектің
(2—5%), олар өте уытты болады, барлық клетканың компоненттерін зақымдайды.
Барлық ОАФ - О2 молекуласының жартылай тотықсызданудың өнімі.
Слайд 3
Оттек барлық тірі ағзалардың құрамына кіреді.
Негізгі жағдайында оттекте екі қосылмаған
радикал болып келеді, ол жағдайда оның активтігі онша жоғары болмайды.
Триплеттік жағдайдағы (3О2), кәдімгі молекулалық оттектен басқа , оның 6 активті туындылары болады.
·
Слайд 4
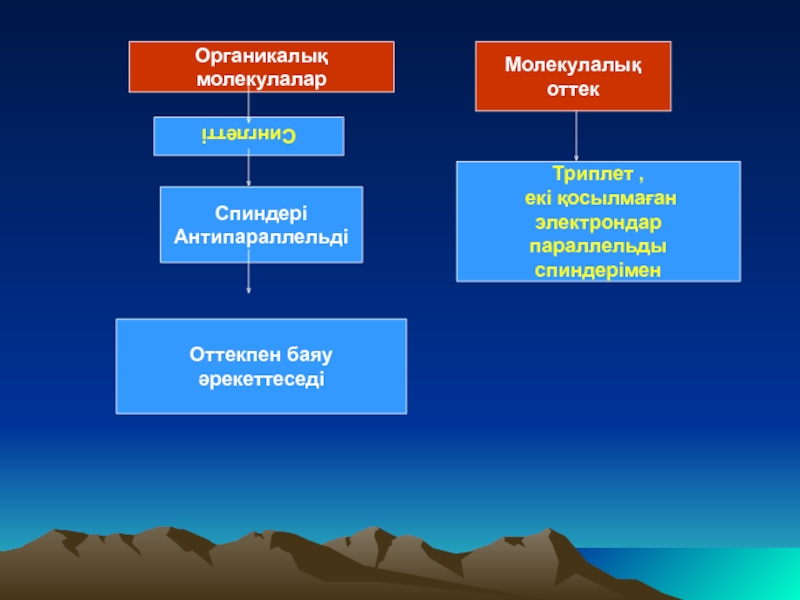
Органикалық молекулалар
Спиндері
Антипараллельді
Оттекпен баяу әрекеттеседі
Молекулалық оттек
Триплет ,
екі қосылмаған
электрондар параллельды
спиндерімен
Синглетті
Слайд 5Классификация электронных состояний молекулы основывается на ряде признаков, из к-рых, прежде
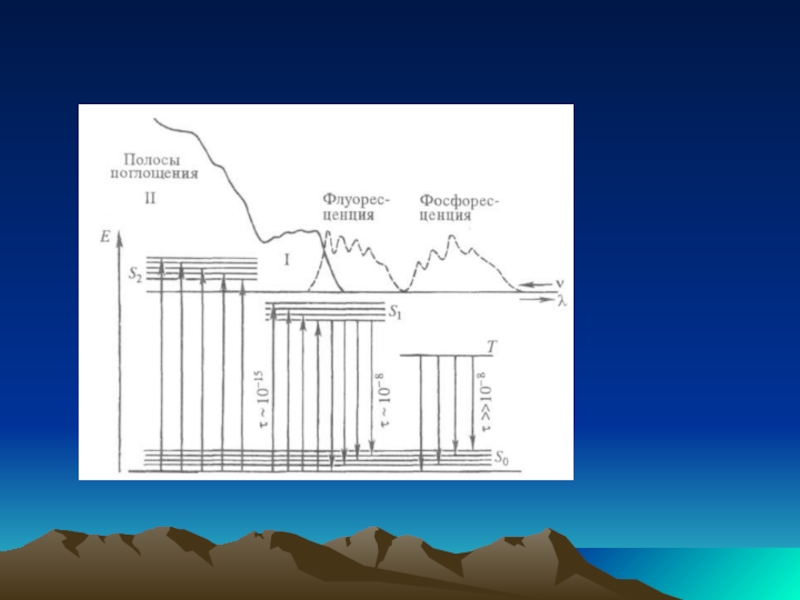
Слайд 7Спектры испускания. Многоатомные молекулы в конденсир. фазе способны заметно испускать свет
Слайд 8Молекулалық оттек негізгі күйінде триплет болып келеді. Ол екі қосылмаған электрондары
Көбінесе органикалық молекулалар синглетті болады, электрондардың спиндері антипараллельды болады.
Спиндерінің бағыты әр түрлі болғандықтан органикалық заттар оттектің молекуласымен әрекеттесуі өте баяу жүреді.
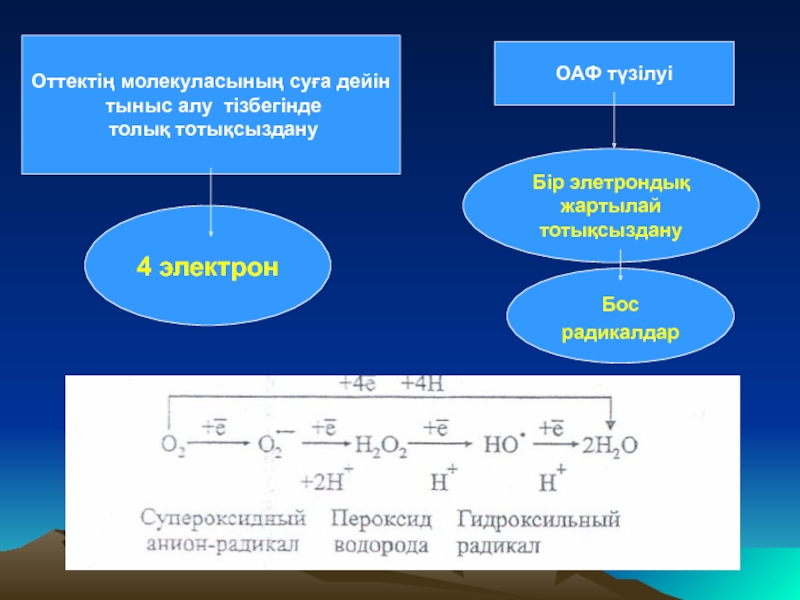
Слайд 9Оттектің молекуласының суға дейін
тыныс алу тізбегінде
толық тотықсыздану
4 электрон
ОАФ түзілуі
Бір
тотықсыздану
Бос
радикалдар
Слайд 10Ұлпаларда ОАФ аз мөлшерде болады.
Н2О2 -10-8 моль/л,
О2*- -
НО*- - 10-11 моль/л.
ОАФ-ға сингдетті оттек те жатады (1О2).
Оның түзілуінің негізгі жолы сәулелік реакциялар арқылы.
Поглощая квант света пигмент-фотосенсибилизатор (главным образом хлорофилл) переходит в синглетное (1П) или триплетное (3П) возбужденное состояние.
Слайд 11ОАФ-РЫ БИОМОЛЕКУЛАЛАРДЫ ЗАҚЫМДАНУДА
Молекулалық оттек өз өзінен бақыланбайтын химиялық реакцияларға қатспайды, оны
Оларға : оксидазалар және оксигеназалар жатады.
Бірақ қаталитикалық орталықтарында оттек соңғы өнімдеріне дейін айналады, ортаға бөлінбей, клетканы органикалықмолекулаларын зақымдамай.
Зақымдайтын агенттерге оттектің активті формаларыжатады, олар физико-химиялық процестердің барысында пайда болады.
Ең басты ОАФ (Осипов и др., 1990):
- супероксид радикалдар (О2-),
- сутектің асқын тотығы (Н2О2),
- гидроксил (бос) радикалдар (*ОН, НО2*),
- синглетті оттека 4
- иондар НО2-.
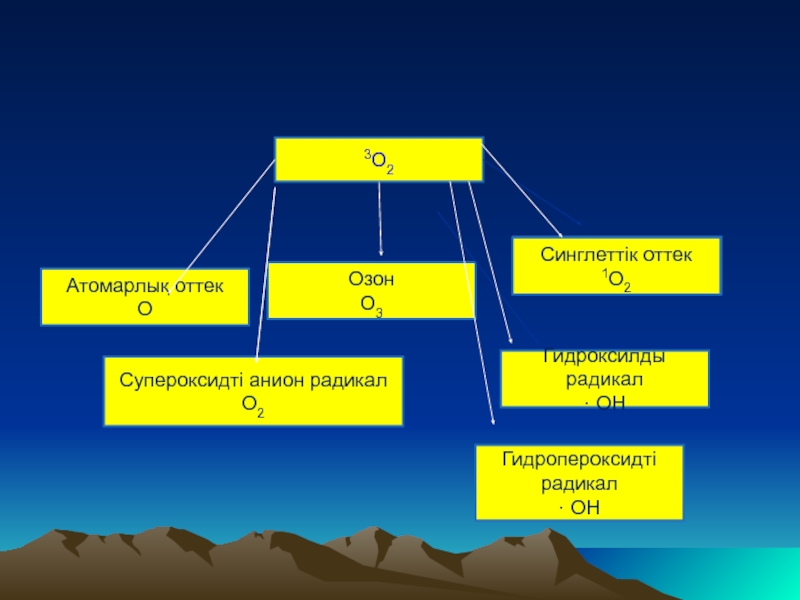
Слайд 12
·
3О2
Атомарлық оттек
О
Озон
О3
Синглеттік оттек
1О2
Супероксидті анион радикал
О2
Гидроксилды радикал
· ОН
Гидропероксидті радикал
· ОН
Синглеттік оттек
1О2
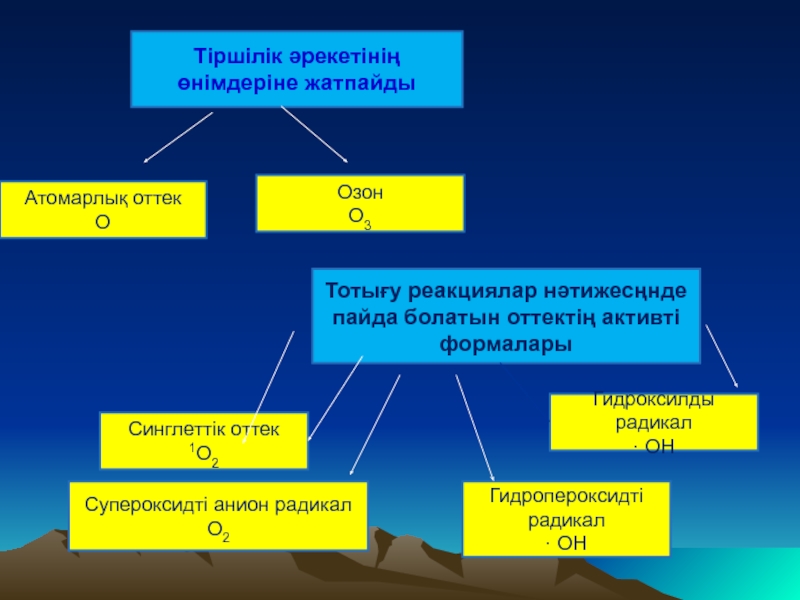
Слайд 13Тiршiлiк әрекетiнiң өнiмдерiне жатпайды
Атомарлық оттек
О
Озон
О3
Супероксидті анион радикал
О2
Гидроксилды радикал
· ОН
Гидропероксидті радикал
· ОН
Синглеттік
1О2
Тотығу реакциялар нәтижесңнде пайда болатын оттектің активті формалары
Слайд 14Оттектің аткивті формалары (ОАФ) – қысқа өмір сүретін активті реакцияларға жоғары
Слайд 15ОАФ түзілунің бірнеше жолдары бар.Олар аэробты метаболизмде , егер тыныс алу
.
ОАФК цитозоль ферменттің арқасындада жанама өнім ретінде түзіледі. Мысалы ксантиноксидаза,
Бірақ кейбір ферменттер тек ОАФ генерациялайды.
Мысалы, мембрананың NADPH (никотинамидаде-ниндинуклеотидфосфат)-оксидазасы (NADPH — oxidase — NOX).
Ола молекулалық оттекті тотықсыздандырады клетканың тысында супероксидке дейін О2*–, онда ол цитозольдық NADPH-ты тотықтырады NADP+. -дейін
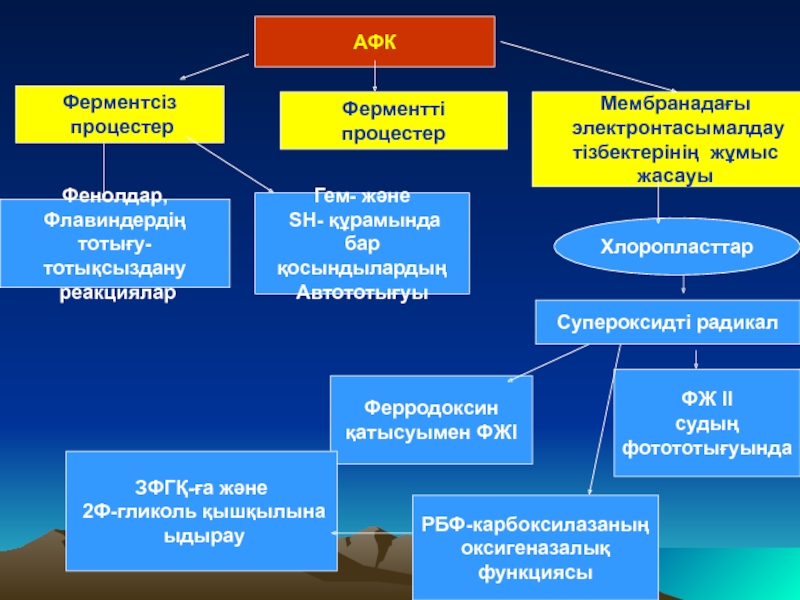
Слайд 16
АФК
Ферментсіз
процестер
Фенолдар,
Флавиндердің тотығу-
тотықсыздану
реакциялар
Гем- және
SН- құрамында бар
қосындылардың
Автототығуы
Ферментті
процестер
Мембранадағы
электронтасымалдау
тізбектерінің жұмыс жасауы
Хлоропласттар
Супероксидті радикал
Ферродоксин
қатысуымен ФЖI
ФЖ II
судың
фотототығуында
РБФ-карбоксилазаның
оксигеназалық
функциясы
ЗФГҚ-ға және
2Ф-гликоль қышқылына
ыдырау
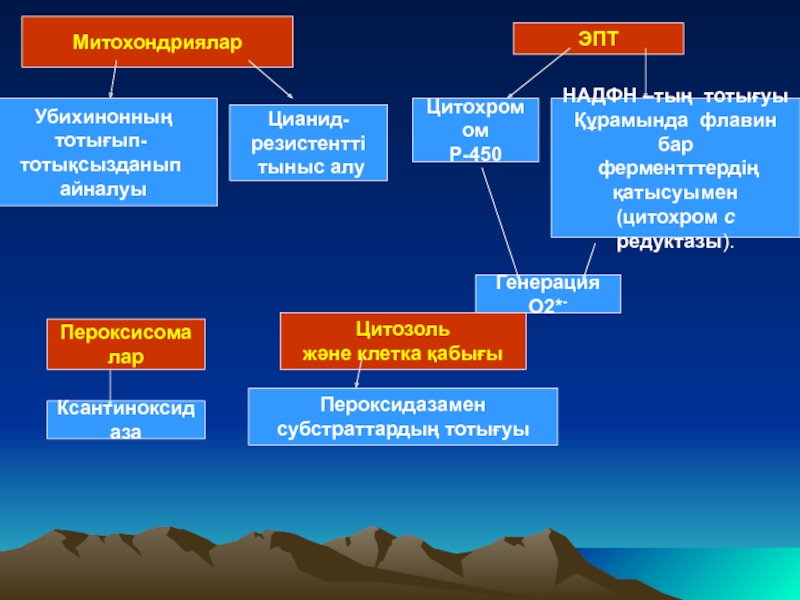
Слайд 17
Митохондриялар
Убихинонның
тотығып-
тотықсызданып
айналуы
Цианид-
резистентті
тыныс алу
ЭПТ
Цитохромом
Р-450
Генерация О2*-
НАДФН –тың тотығуы
Құрамында флавин
ферментттердің
қатысуымен
(цитохром с редуктазы).
Пероксисомалар
Ксантиноксидаза
Цитозоль
және клетка қабығы
Пероксидазамен
субстраттардың тотығуы
Слайд 19
Супероксидті анион радикал
О2-
Оттектің бір электрондық тотықсыздануының өнімі – протонданған формадағы гидропероксидті
Супероксидті радикалды сутектің асқын тотығының (Н2О2) бір электрондық тотығу нәтижесінде алуға болады
Слайд 20Супероксид анион-радикал және басқа ОАФ клетканың әр түрлі құрылымдарында түзіледі.
Олар
Слайд 21Cупероксидті анион-радикалдың түзілуі құрамында флавин бар ксантиноксидаза, сияқты ферменттің қатысуымен, микросомдық
Ксантиноксидаза пуриндерді мочевая қышқылдарға катаболиздендіреді
(пуриндер ДНКның құрамына кіреді), Микросомдық монооксигеназалар ксенобиотиктердің метаболизміне қатысады
Слайд 22Митохондрии являются главным источником создания супероксидных анионов в клетках.
В ходе
Все, что уменьшает эффективность проводимости в цепи и нарушает транспорт электроновВсе, что уменьшает эффективность проводимости в цепи и нарушает транспорт электронов , например нарушение кеточного окислительного (redox) потенциала может увеличивать производство супероксидов.
Количество супероксидов Количество супероксидов и перекисное окисление липидов Количество супероксидов и перекисное окисление липидов увеличивается в ходе апоптоза [ Bredesen ea 1995 ].
Слайд 23Бос радикалда сыртқы орбитальда. қосылмаған электрон болады
Супероксид анион радикал ол
. Супероксидті радикал өте қатты зиян әсер етеді мембраналарға
Слайд 24Молекулалық оттектен басқа, олар мембраналардан жақсы өтеді, супероксидті радикалдың заряды бар,
Ол өмір уақыты ұзақ болады. Және басқа ОАФның көзі болады.
Бір электрон және екі протон супероксидті радикалға қосылғанда сутектің асқын тотығы пайда болады.
Слайд 25АФК-ның генерациясында молекулалық оттектің күн сәуесінің әсерінен фотодиссиоциацияның нәтижесінде пайда болған
Озон оттекпен әрекеттескенде супероксид-анион пайда болады:
О3+О2 2О2 +О2.-
Содан кейін сутектің асқын тотығы, синглетті оттек және гидроксил-радикал.
Слайд 26 Н2O2
Ол орташа тотықтырғыш болып саналады.
Валенттігін ауыстыратын металдар болмаса ол
Бәрақ оның өмірі ұзақтығынан және қосқабатты липидтерден өту қабілетті бар болғандықтан мембранадан жақсы өтеді.
Слайд 27Cупероксид анион-радикалдың түзілуі құрамында флавин бар ксантиноксидаза, сияқты ферменттің қатысуымен, микросомдық
Ксантиноксидаза пуриндерді несеп қышқылға катаболиздендіреді
(пуриндер ДНКның құрамына кіреді), Микросомдық монооксигеназалар ксенобиотиктердің метаболизміне қатысады
Слайд 30
Бірақ ең көп супероксидтер митохондриядағы және хлоропласттағы электрон тасымалдаушы тізбектің жұмысында
Супероксид оттектің хлоропластта тотықсыздануының негізгі бірінші өнімі болып келеді.
Ол фотосинтездің электрон тасымалдаушы тізбектің төмен потенциалды акцепторларында молекулалық оттекке электрондардың тасымалдану нәтижесінде пайда болады:
1 ФЖ - Гемсіз құрамында темір бар белокта ферредоксинде (Fd), b563 цитохромда және Фд-НАДФ+редуктазада;
2 ФЖ – бірінші ретті хинонды электрон акцепторде - феофитинде.
Слайд 31- Клеткалық қабығында оттектің радикалдары пайда болады. Ол өсімдіктің иммундық реакцияларында,
Супероксид анионға екінші электронның қосылу нәтижесінде сутектің асқын тотығуы, гидропероксидті және асқын тотыққан аниондар түзіледі, олар радикалды өнімдерге жатпайды.
Супероксидті радикалдың су ерітінділерде активтігі төмен, Онда супероксидті және гидроперексидті радикал дисмутацияға ұшырайды – сутектің асқын тотығы пайда болады
Слайд 32 Оттектің басқа радикалдарынан және синглетті оттектен айырмашылығы - оның
Протонданғанда супероксид гидропероксидті радикалға .ОН айналады, оның тотығу әсері жоғары болады.
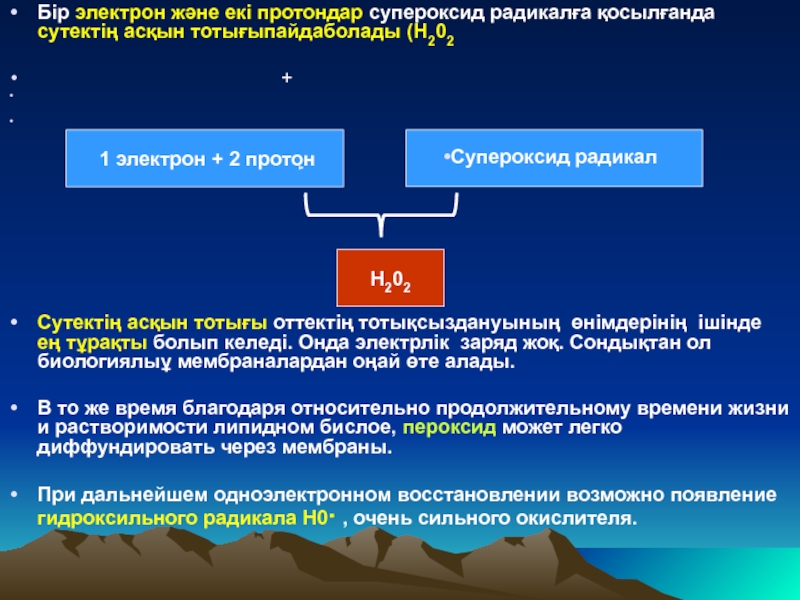
Слайд 33Бір электрон және екі протондар супероксид радикалға қосылғанда сутектің асқын тотығыпайдаболады
+
Сутектің асқын тотығы оттектің тотықсыздануының өнімдерінің ішінде ең тұрақты болып келеді. Онда электрлік заряд жоқ. Сондықтан ол биологиялыұ мембраналардан оңай өте алады.
В то же время благодаря относительно продолжительному времени жизни и растворимости липидном бислое, пероксид может легко диффундировать через мембраны.
При дальнейшем одноэлектронном восстановлении возможно появление гидроксильного радикала Н0· , очень сильного окислителя.
1 электрон + 2 протон
Супероксид радикал
Н202
Слайд 35
Осы ОАФның өмір сүру ұзақтығы 1 мс, сондықтан ол түзілген жерден
Асқын тотыңтың түзелетін жылдамдығы 100-200 нМ/м2 жапырақтың алақанының бір секундада митохондрияда, 20 есе тезірек хлоропласттарда, 50 есе – өсімдік клеткаларындағы пероксисомаларда.
Н2О2 – көп оксидазалардағы оттектің тотықсызданған өнімі.
Кейбір ферменттер, мысалы ксантиноксидаза, альдегидоксидаза, мембранамен байланысөан НАДФН-оксидазалар бір мезгілде супероксид және пероксид, олардың өатынасы концентрациядан және pHтан тәуелді.
Слайд 36Хлоропластта сутектің асқын тотығы фото тыныс алуда түзіледі, гликолат гликолаоксидазамен тотыққынада,
Сутектің асқын тотығы Генерация пероксида водорода может происходить II ФЖ хлоропласттарда су фотототыққанда, феофитин-пластохинон бөлігінде.
Және Н2О2 (через супероксид) түзілуі ФЖ1 терминалды флавиндік редуктазанығ қатысуымен жүреді Ф.
Слайд 37
Сутектің асқын тотығы супероксидтің хлоропласттағы және митохондриядағы тотықсыздандырғыштармен әрекеттескенде пайда
Бірінші ФЖ-де супероксидтің дисмутациясы жүреді.
Слайд 38 Фентон реакциясы:
Сутектің асқын тотығының токсикалық әсері осымен белгіленеді
Хабера-Вайса
,
Слайд 39ГИДРОКСИЛ РАДИКАЛ ОН.
Келесі бір электрондық тотықсызданған нәтижесінде гидроксил радикал түзіледі ОН.
Сонымен, сутектің асқын тотығының ролі тек өзінің химиялық реактивтігімен емес, ол басқа ОАФ түзу қабілетімен белгіленеді
Слайд 40Гидроксил радикал клетканың ішінде миграция жасалмайды, себебі ол тез биомолекулаларымен реакцияға
Оның негізгі көзі Фентон реакциясы металдардың қатысуымен.
Темір Fe 2+ +H2O2 Fe3+ +OH- +HO.
Металдар HO. -ты генерациялайды тек неорганикалық тұздарда емес және белоктарда да.
Слайд 41Гидроксил радикал клетканың ішінде миграция жасамайды, себебі ол тез биомолекулаларымен реакцияға
ОН-тың негізгі көзі - Фентон реакциясы металдардың қатысуымен.
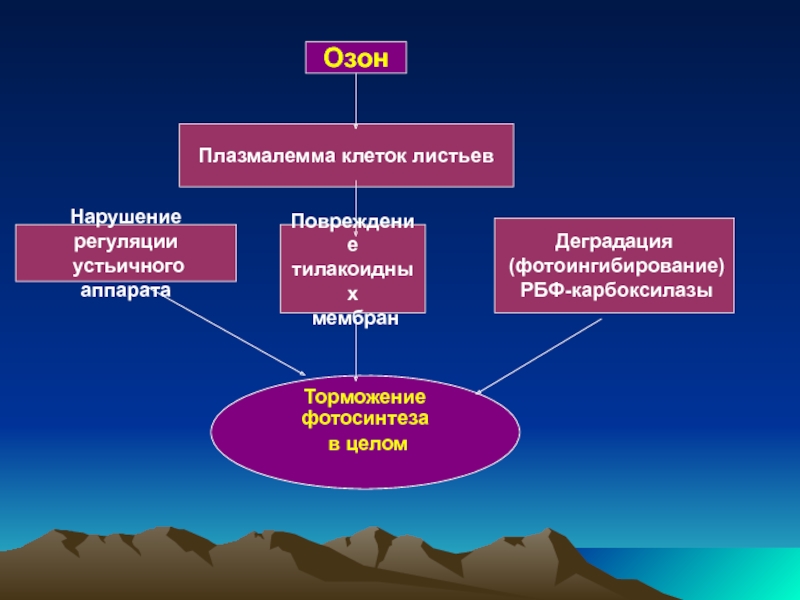
Слайд 42Озон жапырақтың клеткалық плазмалеммасымен байланысады, леп тесіктердің реттелуін бұзады, тилакоидтық мембрананы
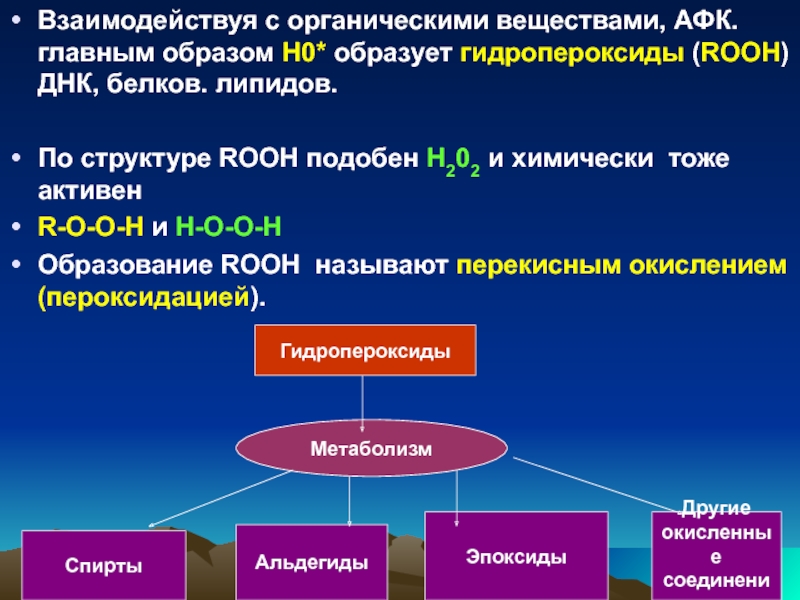
ОАФ, әсіресе НО. , органикалық заттармен әрекеттесіп липидтердің, ДНҚ-ның, белоктардың гидропероксидтерін түзеді.
Құрылым бойынша ROOH Н2О2 сияқты
/ R-O-O-H Н-О-О-Н/ және химиялық активті.
Слайд 43
Озон
Плазмалемма клеток листьев
Нарушение регуляции
устьичного аппарата
Повреждение
тилакоидных
мембран
Деградация
(фотоингибирование)
РБФ-карбоксилазы
Торможение фотосинтеза
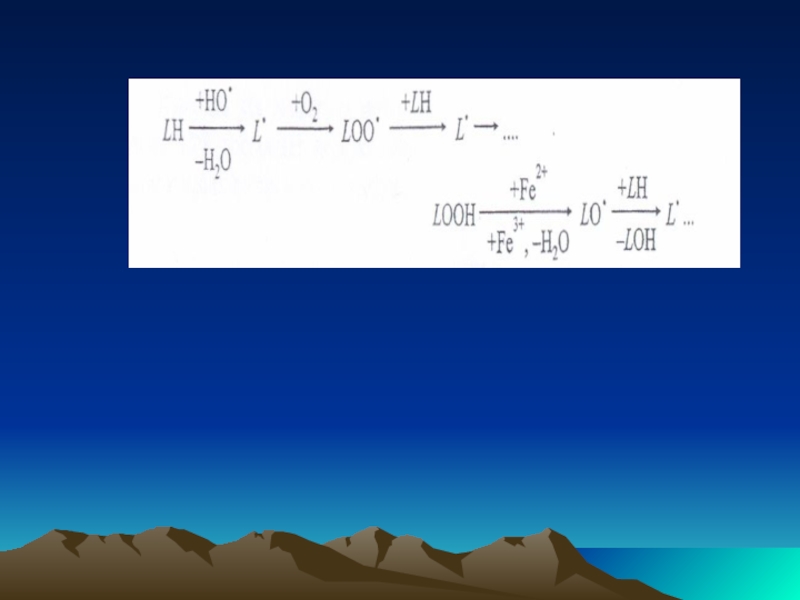
Слайд 44ROOH-тың түзілуін асқын тотығу деп атайды
Метаболизм барысында гидропероксидтер спирттерге, альдегидтерге, эпоксидтерге
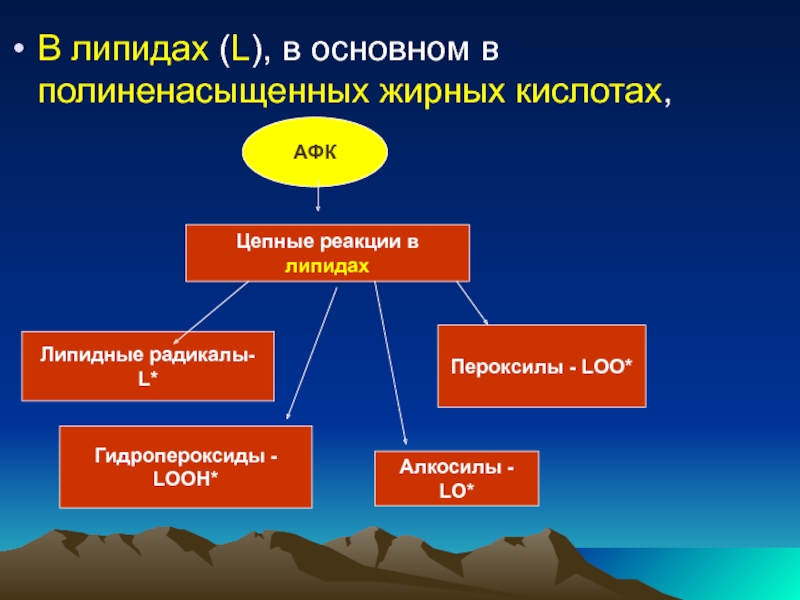
Липидтерде /L/ полиқанықпаған май қышқылдарда ОАФ тізбек реакцияларды туғызады, липидтердің радикалдары /L*/, пероксилдер /LOO*/ гидропероксидтері / LOOH/ , алкосилдер /LO*/ түзіледі
Слайд 45Взаимодействуя с органическими веществами, АФК. главным образом Н0* образует гидропероксиды (RООН)
По структуре RООН подобен Н202 и химически тоже активен
R-О-О-Н и Н-О-О-Н
Образование RООН называют перекисным окислением (пероксидацией).
Гидропероксиды
Метаболизм
Спирты
Альдегиды
Эпоксиды
Другие
окисленные
соединения
Слайд 46Реакция LООН с Fе2+ ведет к разветвлению цепи.
Далее образуются диеновые
Этот процесс, называемый перекисным окислением липидов (ПОЛ), может происходить спонтанно, неферментативно, но большое значение имеют и ферментативные реакции, например с участием липооксигеназ.
Липоксигеназа включает кислород в ненасыщенные жирные кислоты, образуя гидроксиды со смещением двойной связи
Слайд 47В липидах (L), в основном в полиненасыщенных жирных кислотах,
АФК
Цепные реакции
Липидные радикалы- L*
Пероксилы - LОО*
Гидропероксиды - LООН*
Алкосилы - LО*
Слайд 49Синглетті оттек 1О2
Оның түзілуі жарық реакциялармен байланысты. Жарықтың
Слайд 50Синглетті оттек (1О2), фотототығуда пайда болады
фотосенсибилизаторлар - флавины, гематопорфирин, хлорофилл и
ДИСМУТАЦИЯ, тотығутотықсыздану процесс,оның нәтижесінде бір органикалық немесе неорганикалық заттан бір мезгілде тотыққан және тотықсызданған формалары түзіледі.
Синглетті оттек биосубстраттарды зақымдайды, әсіресе қос байланыстары бар қосындыларды; соңғы өнімі органикалық молекулаларының гидроперекистері - биомембраналардың қанықпаған липидтерінде жүретін ең маңызыды процесс
Валенттігін өзгертетін металдарбар жағадайда осы биомолекулаларды тізбек тотығу деградацияның реакцияларына ұшыратады. (Vladimirov etc., 1980).
Слайд 51Осы процестің ең басты қорғаныс механизмі бета-каротин, ол синглетті оттекті триплетті
Нәтижесінде химиялық активті синглетті оттек пайда болады. Басқа механизм- пигменттің триплетті түрінің, оттектің, субстраттың кешенінің диссоциациясында бос радикалдар пайдаболады.
Синглетті оттек көп органикалық заттармен (RH) реакцияға түсе алады.
Онда олар гидропероксидтерді түзеді.
RH +1О2 = ROOH
Слайд 52Молекулы пигмента в виде синглета или триплета. сталкиваясь с 02, основное
передают на него энергию в результате у О2 меняется спин и образуется химически активный синглетный молекулярный кислород.
+
Квант света
Пигмент-
фотосенсибилизатор
Хлорофилл –
синглетное состояние
или триплетное
02
1О2
Слайд 53ОАФ биологиялық маңызы
Қалыпты жағдайда ОАФ және липидтердің асқын тотығы пайда
Патологиялық салдар ОАФ және пероксидтер жоғары мөлшерде болғанда пайда болады. Ол стресс жағдайда болады:
засуха,
экстремальные температуры,
загрязнители воздуха,
-УФ- и γ-излучение,
гипероксия (кислородное отравление),
нарушение минерального питания (особенно избыток Fе2+ ,
- действие тяжелых металлов, ксенобиотиков,
гипоксия и аноксия
Слайд 54Тотығу стресс нуклеин қышқылдарды, белоктарды, липидтерді зақымдайды.
Супероксид анион-радикал митохондряның ішкі мембранасында
Супероксидный
анион-радикал
Нуклеин қышқылдардың
пурин және пиримидин
негіздерәнәң
тотығуы
Тәзбектің үзілуі
Хромосомдарының
зақымдануы
Слайд 55 ОАФ мутагендік әсер етеді.
АФК, липидные
гидропероксиды
Ингибирование
синтеза ДНК
Деление клеток
Активирование
Слайд 56Окислительные модификации белков, вызванные АФК, включают не только изменение аминокислотных остатков.
Это может быть и нарушение третичной структуры, и даже денатурация белков.
ПОЛ вызывает деградацию прежде всего клеточных мембран.
Все описанные отрицательные воздействия АФК способны серьезно дезорганизовывать функционирование клеток и организма в целом.
Вместе с тем генерация АФК может быть необходима для формировання защитных реакций растений, например, при инфекционных заболеваниях.
Слайд 57
АФК, локализованные
в плазматической мембране
и клеточной стенке
Атака и повреждение
патогенной
Метаболизм
фенольных соединений
Синтез лигнина, обеспечивающего
механическую прочность
клеточной стенки
Внеклеточный защитный
барьер, препятствующий
проникновению патогенных
микроорганизмов
внутрь растительной клетки.
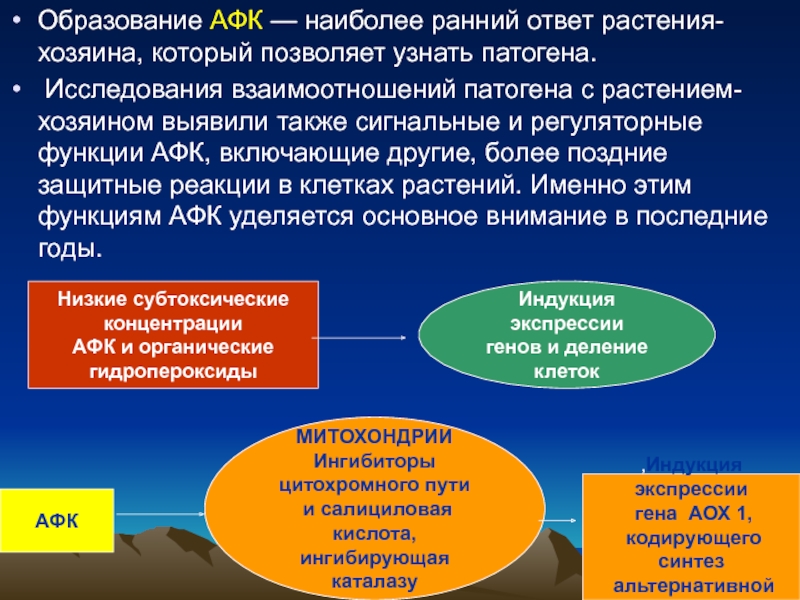
Слайд 58Образование АФК — наиболее ранний ответ растения-хозяина, который позволяет узнать патогена.
Низкие субтоксические
концентрации
АФК и органические
гидропероксиды
Индукция экспрессии
генов и деление клеток
АФК
МИТОХОНДРИИ
Ингибиторы
цитохромного пути
и салициловая кислота,
ингибирующая каталазу
,Индукция экспрессии
гена АОХ 1,
кодирующего синтез
альтернативной
оксидазы
Слайд 59Накопление в клетке вторичных посредников — циклонуклеотидов: цАМФ и цГМФ, стимулирует
У животных цГМФ образуется в результате активации гидроксильного радикала цитоплазматической гуанилциклазой АФК вызывает повышение концентрации Са2+ в цитозоле и стимуляцию фосфорилирования белков в результате активации протеинказы (особенно протеинкиназы С), протеинтирозинкиназ к ингибированию протеинфосфатаз.
Активно исследуется также вопрос о том, могут ли сами АФК непосредственно выполнять функцию вторичных посредников гормонов.
В пользу этого свидетельствует модификация эффектов гормонов под влиянием АФК и их снижение или блокада антиоксидантами
Слайд 60МЕХАНИЗМЫ ЗАЩИТЫ
Способы снижения образования активных форм кислорода
Торможение образования супероксид-аниона возможно путем
Для нормальной работы ЭТЦ дыхания необходима меньшая концентрация 02, чем для образования 02*-
Два механизма
Уменьшение
образования АФК
Функционирование
антиоксидантной
системы
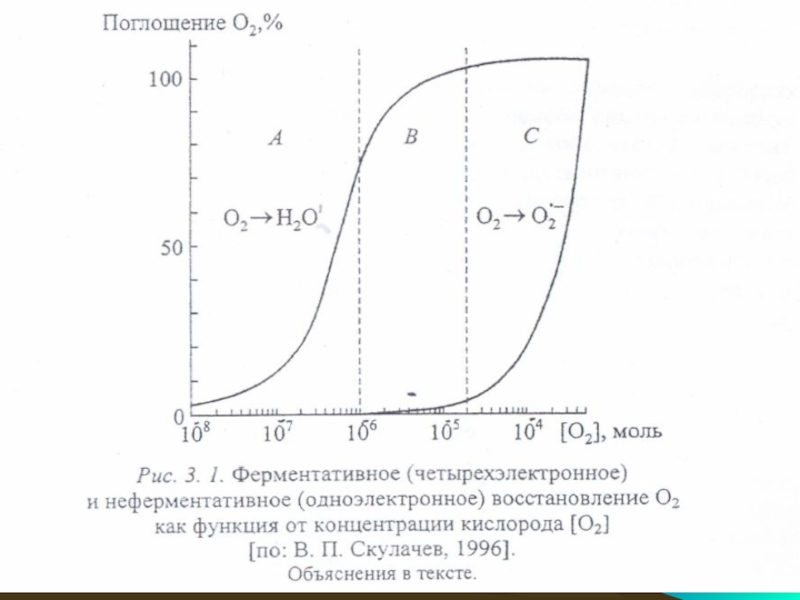
Слайд 61Концентрация кислорода. обеспечивающая половину максимальной скорости ферментативного восстановления (02 → Н20),
Скорость неферментативного восстановления
(02 — 02*-) линейно повышается с ростом концентрации 02.
Скорость поглощения кислорода на уровне, соответствующем атмосферному давлению 02 (0,22 моль/л), принята за 100%.
Абсолютная скорость поглощения кислорода, взятого за 100%, для реакции 02→ Н20 на 2 порядка больше, чем для реакции 02→02*-).
В области А молекулярного кислорода слишком мало для того, чтобы насытить цитохромоксидазу (< 5.10-7 моль/л)
Слайд 63В области В цитохромоксидаза насыщена кислородом, но его недостаточно для обеспечения
Очевидно, именно эта область оптимальна для аэробной жизни. И только в области С концентрация кислорода оказывается достаточно высокой, чтобы начали накапливаться АФК.
Однако эта концентрация все-таки очень мала (10-6—10-5 моль/л), поэтому образование АФК возможно в условиях, близких к аноксическим.
Итак, для того чтобы образование АФК стало невозможным. необходимо очень сильно снизить концентрацию кислорода.
Слайд 64Известно несколько способов снижения уровня кислорода в клетке.
Активация цианидрезистентной альтернативной оксидазы
В результате такой активации энергия ∆μН+ не переходит в АТФ, а рассеивается в виде тепла.
При стрессовых воздействиях альтернативная оксидаза обычно активируется
Слайд 65Утечка ионов водорода.
Г. Биверс и Б. Чанс установили, что образование
Значит, для прекращения накопления Н2О2 достаточно даже небольшого снижения электрохимического потенциала, вызываемого введением АДФ.
Такой эффект может достигаться и при сравнительно небольшой утечке Н+, не сопряженной с синтезом АТФ. Возможно, митохондрии располагают механизмом увеличения утечки протонов в состоянии покоя. Этот механизм мог бы предотвратить полное торможение дыхания. Сильное восстановление дыхательных ферментов и коферментов, накопление КоQ*-.
Действуя на внутриклеточном уровне, он должен включаться, когда АДФ исчерпывается. и выключаться, когда АДФ появляется вновь.
Слайд 66
Открывание пор в мембране митохондрий. Если система утечки протонов оказывается недостаточной,
Слайд 67Образование активных форм кислорода (АФК, ROS) являющихся индукторами апоптоза
При нарушении наружной
Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О2 в качеству акцептора электронов. При этом образуются О2- Н2О2, а из них -и другие активные формы кислорода (АФК)Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О2 в качеству акцептора электронов. При этом образуются О2- Н2О2, а из них -и другие активные формы кислорода (АФК) , которые разрушают митохондрии и являются мощными индукторами апоптоза. Механизмы образования АФК не ограничиваются ксантиноксидазной реакцией. Главным источником АФК в клетках являются митохондрии. Резкое увеличение АФК происходит при возрастании мембранного потенциала в митохондриях, когда снижено потребление АТР и скорость дыхания лимитируется ADP [ Korshunov, ea 1997Ксантиндегидрогеназа катализирует зависимое от NAD+ окисление ксантина до гипоксантина и последующее окисление гипоксантина до мочевой кислоты. Ксантиноксидаза катализирует те же реакции, но не с NAD+, а с О2 в качеству акцептора электронов. При этом образуются О2- Н2О2, а из них -и другие активные формы кислорода (АФК) , которые разрушают митохондрии и являются мощными индукторами апоптоза. Механизмы образования АФК не ограничиваются ксантиноксидазной реакцией. Главным источником АФК в клетках являются митохондрии. Резкое увеличение АФК происходит при возрастании мембранного потенциала в митохондриях, когда снижено потребление АТР и скорость дыхания лимитируется ADP [ Korshunov, ea 1997 ]. Доля электронного потока через дыхательную цепь митохондрий, идущая на образование O2-, достигает 1-5% (см. [ Green, ea 1998 ]). Цитоплазматическая мембрана макрофагов и нейтрофилов содержит O2- - генерирующую NADPH-оксидазу.